IgA腎病患者血漿中miR-191-5p表達及其與腎間質纖維化相關性的研究
夏薇青, 宋菊香, 楊二梅, 曹義甫, 王天智, 劉翠紅
(河北省石家莊市第三醫院腎內科, 河北 石家莊 050000)
IgA腎病以IgA或IgA為主的免疫復合物在腎小球系膜沉積為特征的炎癥性腎病,是全球最常見的原發性腎小球腎炎,也是慢性腎臟病(CKD)和腎功能衰竭的主要原因,隨著病情進展可引起貧血、骨骼疾病、骨折以及心血管疾病等并發癥,增加患者全因死亡風險[1]。腎間質纖維化(RIF)是慢性腎臟病向終末期腎功能衰竭發展的必經途徑,其組織病理學特征是腎小管細胞凋亡、細胞外基質(ECM)成分在腎間質內過度沉積和腎間質成纖維細胞增殖[2]。目前臨床在抗腎間質纖維化方面缺乏有效的治療手段,仍以預防為主,探討與腎間質纖維化相關的生物學標志物對臨床早期診治有著重要的意義。大量研究表明微小核糖核酸(miRNA)參與腎臟病理生理學調控,與RIF有著密切的關系[3]。已知炎癥、氧化應激與RIF發病有關,氧化應激、炎性細胞浸潤可促使腎間質肌成纖維細胞積累和纖維化,miR-191-5p可靶向氧化應激反應激酶1(OXSR1)抑制氧化應激反應和炎性細胞因子的產生,減輕腎細胞凋亡和腎損傷[4]。miR-191-5p是否與CKD患者RIF有關尚不清楚,本研究擬檢測IgA腎病患者血漿中miR-191-5p表達,探討其與RIF及其相關指標、腎功能之間的關系,以期為臨床診治提供參考。
1 資料與方法
1.1臨床資料:選擇2017年2月至2022年2月我院收治的80例IgA腎病患者(IgA腎病組),男47例,女33例;年齡32~64歲,平均(47.18±11.63)歲。納入標準:①符合《KDIGO 2012慢性腎臟疾病評估和管理臨床實踐指南》中IgA腎病的診斷標準[5];②年齡18周歲以上;③入組前均行腎組織活檢,病理資料完整。排除標準:①痛風或尿路結石;②腎良惡性腫瘤;③合并自身免疫疾病、感染性疾病。根據2012年KDOQI臨床實踐指南中分期標準[5]分為Ⅰ~Ⅱ期組(42例)、Ⅲ期組(38例)。根據牛津分型中TIL程度[6]將其分為三組:T0組(20例),腎小管萎縮/間質纖維化程度<25%;T1組(39例),腎小管萎縮/間質纖維化程度25%~50%;T2組(21例),腎小管萎縮/間質纖維化程度>50%。另選擇77例健康志愿者為對照組,男41例,女36例;年齡35~66歲,平均(47.92±11.24)歲。IgA腎病組和對照組基線資料比較差異無統計學意義(P>0.05),本研究已經獲得我院倫理委員會批準,受試者均簽署同意書。
1.2方 法
1.2.1實時熒光定量聚合酶鏈反應(qRT-PCR):所有受試者在入組次日清晨禁食期間采集3mL外周靜脈血,將血樣置于含有EDTA的抗凝管中混勻,放入ScientificTM落地式超高速離心機(美國賽默飛公司)離心(相對離心力8500×g/5400rpm)離心取上層液(即血漿)檢測。使用TRIzol?試劑(美國賽默飛Invitrogen)提取總RNA,RevertAidTMFirst Strand cDNA Synthesis kit(美國賽默飛)將RNA 逆轉錄為cDNA。使用 SYBR RT-PCR 試劑盒(中國大連Takara生物科技有限公司)在 StepOnePlusTM實時 熒光定量PCR系統(美國賽默飛Applied Biosystems)上進行三次重復qRT-PCR分析。使用比較循環閾值(2-ΔΔCt)的方法計算miR-191-5p相對表達水平。反應條件為:預變性95℃ 5min,然后是40個循環的95℃ 30s,95℃ 5s,60℃ 30s。反應體系,DNA模板2μL,上下游引物各1μL,Premix Ex Taq DNA 聚合酶25μL,RNase-Free ddH2O 21μL。引物序列,miR-191-5p,正向:5'-CGGAATCCCAAAAGCAGCTG-3',反向:5'-TGTCGTGGAGTCGGCAATTG-3';U6(內參)正向,5'-CTCGCTTCGGCAGCACATATACT-3'和反向,5'-ACGCTTCACGAATTTGCGTGTC-3'。
1.2.2腎功能和RIF指標:采用AU400全自動生化分析儀(日本Olympus公司)檢測腎功能指標-血肌酐(Scr)、尿素氮(BUN)含量;采用HBS-1096A全自動酶標分析儀(南京德鐵實驗設備有限公司)運用酶聯免疫吸附試驗檢測RIF指標-轉化生長因子TGF-β1、TGF-α水平,試劑盒購自美國賽默飛公司。
1.2.3腎組織活檢:IgA腎病患者入組前均行穿刺活檢,取活檢腎組織,采用4%多聚甲醛溶液中室溫固定6~8h,全自動脫水,石蠟包埋,3μm切片。取石蠟包埋切片,脫蠟水化,PASM,Masson染色,立春紅-品紅著色10min,流水沖洗搖晃至干,1%磷鉬酸鹽水溶液分色5min,去除磷鉬酸鹽,苯胺藍染色5min,水流沖洗,依次加入95%酒精、無水酒精和透明二甲苯,中性膠封片。送金域醫學檢驗中心進行病理結果分析,每個病理切片取上、中、下、左、右等5個視野,于LV150N光學顯微鏡(日本尼康公司)觀察和計算切片著色面積。
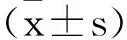
2 結 果
2.1IgA腎病組和對照組血漿miR-191-5p表達、腎功能以及RIF指標比較:IgA腎病組血漿miR-191-5p表達低于對照組(P<0.05),Scr、BUN、TGF-β1、TGF-α水平高于對照組(P<0.05),見表1。
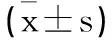
表1 IgA腎病組和對照組血漿miR-191-5p表達腎功能以及RIF指標差異
2.2不同CKD分期血漿miR-191-5p表達、腎功能以及RIF面積和指標比較:Ⅲ期組血漿miR-191-5p表達低于Ⅰ~Ⅱ期組(P<0.05),Scr、BUN、TGF-β1、TGF-α水平高于Ⅰ~Ⅱ期組(P<0.05),RIF面積大于Ⅰ~Ⅱ期組(P<0.05),見表2。
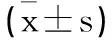
表2 不同CKD分期血漿miR-191-5p表達腎功能以及RIF面積和指標差異
2.3不同RIF分期血漿miR-191-5p表達、腎功能以及RIF面積和指標比較:T2組血漿miR-191-5p表達低于T0組和T1組(P<0.05),Scr、BUN、TGF-β1、TGF-α水平高于T0組和T1組(P<0.05),RIF面積大于T0組和T1組(P<0.05);T1組血漿miR-191-5p表達低于T0組(P<0.05),Scr、BUN、TGF-β1、TGF-α水平高于T0組(P<0.05),RIF面積大于T0組(P<0.05),見表3。
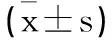
表3 不同RIF分期血漿miR-191-5p表達腎功能以及RIF面積和指標差異
2.4miR-191-5p表達與腎功能、RIF面積和指標的相關性:CKD患者血漿miR-191-5p表達與RIF面積、Scr、BUN、TGF-β1、TGF-α均呈負相關(r=-0.509、-0.379、-0.311、-0.475、-0.486,P<0.05)。
3 討 論
RIF是IgA腎病的病理標志及其進展為終末期腎功能衰竭的預測因子,其發病機制復雜,與腎小管上皮細胞表型轉化、炎癥細胞浸潤、調控纖維化細胞因子激活、ECM轉換失衡、氧化應激、慢性缺氧等多種因素有關。雖然早期RIF引起的腎臟損害是可逆的,但瘢痕形成期的RIF是不可逆的,積極探尋與RIF相關生物學指標對預防和延緩纖維化進展,抗RIF治療和預后風險評估均具有重要意義。miRNA在基因表達調控和信號轉導通路反饋回路中發揮著重要作用,參與細胞分化、增殖、凋亡、代謝、造血、身體形態發生等生理過程,越來越多證據表明miRNA失調可能與IgA腎病的發病機制和發展有關。
miR-191-5p是一種多功能的miRNA,屬于miR-191家族,在內皮細胞中表達豐富,可靶向血管內皮鋅指1抑制血管生成促進缺血性腦損傷,下調miR-191表達可增加可提高腦源性神經營養因子水平,改善異氟醚誘導的認知障礙,減緩神經元細胞凋亡。miR-191還可通過直接靶向Smad2,激活TGF-β信號通路,促使血管內皮細胞增殖,miR-191過表達將上調金屬硫蛋白1E誘導基質金屬蛋白酶表達和ECM重塑,參與主動脈瘤形成過程[7]。同樣miR-191具有免疫調節作用,研究顯示miR-191是幼稚、記憶和調節性T細胞穩態的關鍵調節因子,miR-191表達下調可減弱細胞內信號傳導與轉錄活化因子5信號通路,導致外周CD4+調節性T細胞以及幼稚T細胞和記憶CD8+細胞數量減少[8]。miR-191通過靶向調節轉錄因子-叉頭/翼狀螺旋轉錄因子P1、E2A和早期生長反應因子1促使B細胞發育,miR-191表達缺失和異位表達將導致B系細胞發育停滯[9]。
miR-191異常表達與腎臟疾病有著密切關系,已有報道表明miR-191-5p在腎細胞癌中表達下調,miR-191-5p表達缺失可促使腎癌細胞增殖、遷移和侵襲,提示miR-191-5p在腎細胞癌中發揮腫瘤抑制基因作用[10]。而在腎缺血再灌注損傷中miR-191表達上調,通過靶向抑制胱硫醚β合酶表達,促進腎小管上皮細胞凋亡和腎缺血再灌注性損傷[11]。本研究發現IgA腎病組血漿miR-191-5p表達低于對照組,且隨著分期增加而降低,miR-191-5p與Scr、BUN呈負相關,表明miR-191-5p表達缺失可能參與IgA腎病發病過程。Berillo等[12]報道同樣顯示高血壓所致慢性腎病患者血漿miR-191-5p表達下調,miR-191-5p低表達與eGFR降低和中性粒細胞與淋巴細胞比率增加有關,提示miR-191-5p低表達可能通過促使炎癥反應參與腎功能損害過程。目前miR-191-5p與RIF的關系尚不清楚,本研究發現IgA腎病患者血漿miR-191-5p表達在不同RIF分期中差異顯著,隨著RIF分期增加而下調,且與RIF面積、TGF-β1、TGF-α呈負相關,提示miR-191-5p表達缺乏可能引起RIF,進而促使CKD發病進程,推測可能的機制為:首先,炎癥細胞浸潤是促纖維化的主要途徑,炎癥信號通路的激活可引起核因子-κB活性增強,促使炎癥介質合成、TGF-β和ECM蛋白分泌,導致成纖維細胞增殖和ECM成分沉積,引起RIF。miR-191-5p具有抗炎作用,研究顯示miR-191-5p過表達可抑制NLRP3炎性體通路減輕炎癥反應和炎癥損傷[13],由此可見,miR-191-5p表達缺失可能通過加劇炎癥反應促使RIF進程。其次,活性氧的產生通過激活絲裂原活化蛋白激酶和Smad通路誘導TGF-β1,促使上皮間質轉化和RIF,miR-191-5p具有抗氧化應激作用,通過特異性靶向OXSR1 mRNA抑制p38絲裂原活化蛋白激酶/核因子-κB信號通路激活,抑制氧化應激和炎癥反應,因此miR-191-5p表達缺失可能加重氧化應激,誘導炎癥反應,促使RIF發生和進展。
綜上,IgA腎病患者血漿miR-191-5p表達降低,miR-191-5p低表達與RIF面積、Scr、BUN、TGF-β1、TGF-α增加有關,提示miR-191-5p缺乏可能與IgA腎病患者RIF以及腎功能下降有關,miR-191-5p可能通過促使RIF參與IgA腎病發病過程。本研究局限之處在于不能直接證實miR-191-5p與RIF間的關系,尚待進一步開展基礎研究探討。

