基于SEER 數據庫的原發腮腺B 細胞非霍奇金淋巴瘤分析
陳湘磊,蔡媛華,李景崗,李 鑫,3
(1.濰坊市益都中心醫院血液科,山東 青州 262500;2.福建醫科大學附屬協和醫院血液科,福建 福州 350001;3.福建醫科大學醫學技術與工程學院輸血教研室,福建 福州 350001)
惡性淋巴瘤(malignant lymphoma)約占頭頸部惡性腫瘤的5%。而頭頸部淋巴瘤約占結外淋巴瘤的1/4,主要發生部位包括腮腺、扁桃體、喉部[1]。原發腮腺惡性淋巴瘤是一種少見的腫瘤,約占腮腺腫瘤/腫瘤樣病變的0.6%~5%[2],其臨床表現并不具有特征性,因此影像學上發現的腮腺占位性病變通常不會考慮淋巴瘤的診斷[3],進而導致原發腮腺淋巴瘤的診斷與治療延誤。據報道[2],原發腮腺淋巴瘤男女發病率類似,很少在50 歲以前發病,大部分是B細胞非霍奇金淋巴瘤(NHL),80%的病例為Ann ArborⅠ~Ⅱ期,僅3%~16%的病例是霍奇金淋巴瘤,而T 細胞淋巴瘤極其罕見。由于樣本量少,各文獻報道的原發腮腺淋巴瘤的臨床特點變異較大,預后影響因子及最佳治療方案尚不明確[4,5]。基于SEER數據庫,本研究調查原發腮腺B 細胞NHL 的人口學特點、臨床特征、生存結局、美羅華使用對治療結局的影響以及淋巴瘤特異性死亡的影響因素,現報道如下。
1 資料與方法
1.1 數據來源 SEER 數據庫收集并發表美國第18腫瘤登記站的腫瘤發病率及生存數據,該登記站覆蓋了約28%的美國人口,本研究病例數據均來自SEER 數據庫(www.seer.cancer.gov),納入1987-2016 年診斷的原發腮腺B 細胞NHL 病例。納入標準:①符合國際腫瘤學分類第3 版(ICD-O-3)診斷標準;②根據體位(C620、C621、C629)與病理學特征(9590-9738、9811-9975)確定原發部位為腮腺。排除標準:①經尸檢獲取診斷;②無病理學證據;③多原發腫瘤患者。
1.2 方法 采用SEER 數據庫定義的變量“Causespecific Death Classification”進行競爭風險回歸分析(CSS)。采用發病年齡、種族、診斷時間、發病單雙側、Ann Arbor 分期(病變位于橫膈一側為Ⅰ~Ⅱ期,橫膈兩側為Ⅲ~Ⅳ期)、組織學類型(彌漫大B 細胞淋巴瘤、濾泡淋巴瘤、邊緣區淋巴瘤等)、死因、生存時間等變量用于后續統計分析。總生存時間(OS)定義為疾病診斷直至患者死亡或失訪。
1.3 統計學方法 使用R 軟件(https://www.r-project.org)進行統計分析。分別使用“MatchIt”“survival”及“cmprsk”R 包進行傾向評分匹配(PSM)、生存分析、競爭風險分析。人口學特征采用描述性統計學方法。PSM 分析采用“optimal”方法,并對組織學類型、年齡、性別、種族、診斷時間、疾病分期、發病單雙側進行匹配。K-M 方法及Log-rank 檢驗分析OS。單因素及多因素Cox 回歸分析與OS 相關的危險因子。通過繪制累積概率函數(CIF)進行競爭風險回歸分析。Fine 與Gray 多因素回歸模型[6]用于評估原發腮腺B細胞NHL 相關死亡及非原發腮腺B 細胞NHL 相關死亡。通過研究所有變量與時間的相互作用來評估比例-風險假設[7],沒有證據表明預測變量之間存在相互作用,因此沒有在模型中包含任何相互作用項。
2 結果
2.1 基線特征和腫瘤學特點 共納入1443 例原發腮腺B 細胞NHL,以1997-2016 年診斷例數居多,診斷時的中位年齡為65 歲(15~98 歲);女性發病率高于男性,白種人居多;Ann Arbor 分期以Ⅰ期居多,最常見的組織學類型為MZL,病例詳細臨床特征見表1。

表1 原發腮腺B 細胞NHL 的一般特征[n(%)]
2.2 生存分析
2.2.1 傾向評分匹配后生存分析 為了減少潛在的選擇偏差影響,采用傾向評分匹配分析來調整基線特征的差異。對指定的變量按照2∶1 比例進行了最佳匹配分析,這些變量包括組織學、性別、分期、種族、發病單雙側、診斷時間和發病年齡,匹配后共1170例原發腮腺惰性B 細胞NHL 病例納入后續分析。多因素Cox 回歸分析顯示,年齡與組織學類型是獨立的OS 預測因素,見圖1。
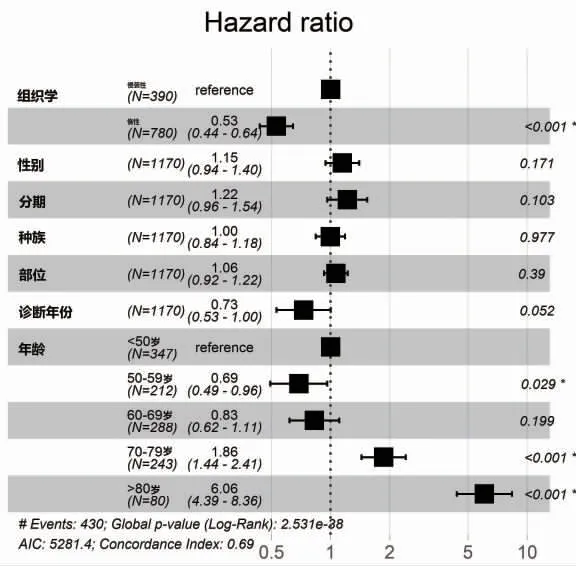
圖1 多因素Cox 分析的森林圖
2.2.2 惰性淋巴瘤生存分析 共1053 例原發腮腺惰性B 細胞NHL 納入后續分析,其中<50、50~59、60~69、70~79 及≥80 歲年齡段患者的中位OS 分別為275、241、216、121 及51 個月(P<0.05),見圖2A。組織學類型為MZL、FL 及CLL/SLL 患者的OS 分別為195、180 及78 個月(P<0.05),而LPL 患者的中位OS數據未達到,見圖2B。1 年及5 年生存率為97.32%及85.02%,見表2。單因素Cox 回歸分析顯示,<70歲患者較≥70 歲患者預后更佳;組織學類型為MZL及LPL 的患者預后無明顯差異;FL 及CLL/SLL 患者較MZL 患者預后更差;發病時的單雙側、種族、性別、疾病分期、診斷時間對原發腮腺惰性B 細胞NHL 的預后無影響;另多因素Cox 回歸分析顯示,≥70 歲的FL 患者較MZL 患者預后更差,見表3。

圖2 原發腮腺惰性B 細胞NHL 中位OS 的K-M 曲線圖

表2 原發腮腺惰性B 細胞NHL 的1、5 年生存率分析[n(%)]

表2(續)

表3 單因素及多因素Cox 分析
2.2.3 侵襲性淋巴瘤生存分析 共390 例原發腮腺侵襲性B 細胞NHL 納入后續分析,其中<50、50~59、60~69、70~79 及≥80 歲年齡段患者的中位OS 分別為121、203、185、74 及12.5 個月(P<0.05),見圖3。1 年及5 年生存率分別為84.92%及62.81%,見表4。隨年齡增長患者的生存率迅速下降。單因素及多因素Cox 分析均顯示,高齡是原發腮腺侵襲性B 細胞NHL 較差的預后因子,而組織學亞型、發病時的單雙側、種族、性別、疾病分期、診斷時間對原發腮腺侵襲性B 細胞NHL 的預后無影響,見表5。
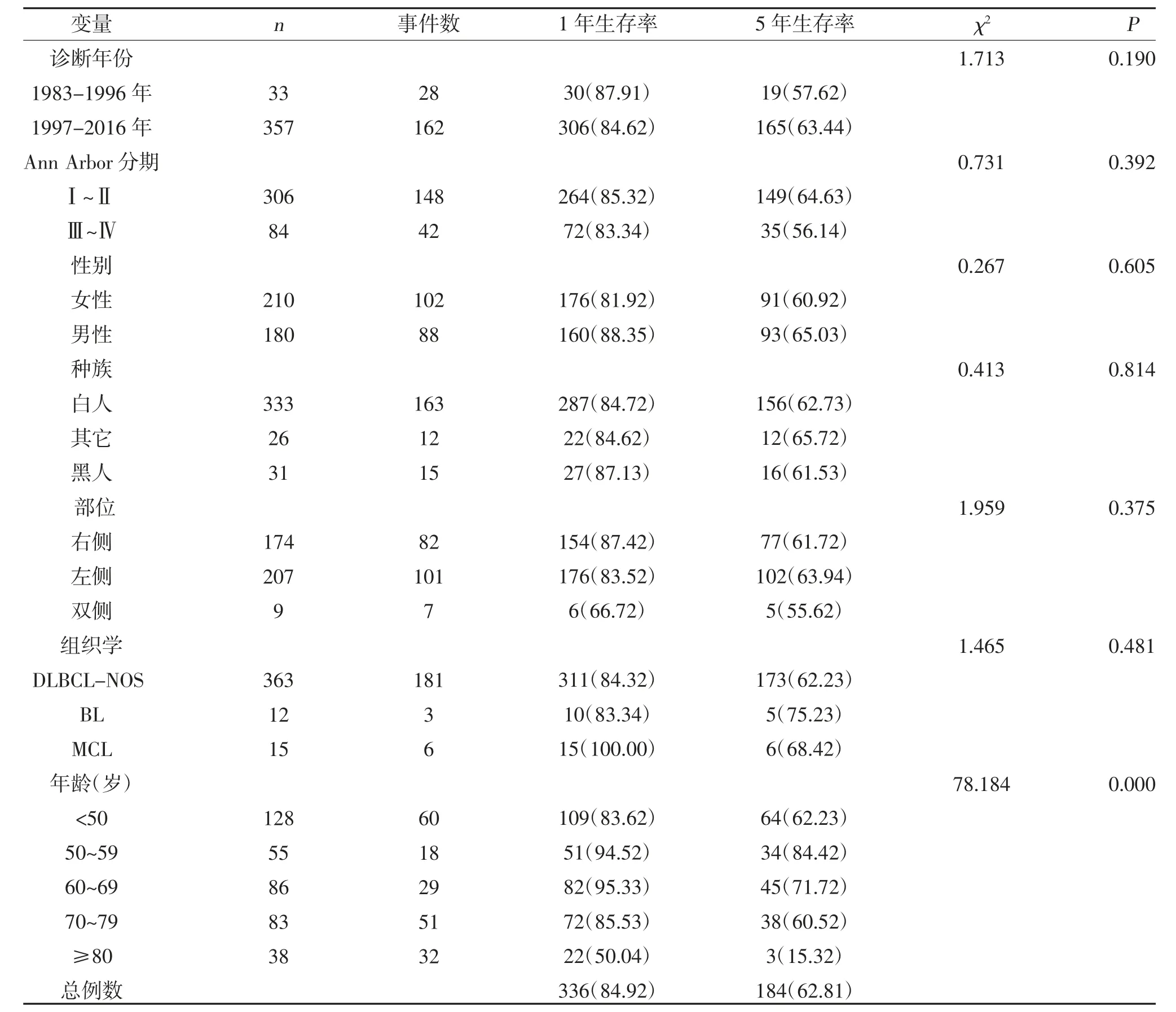
表4 原發腮腺侵襲性B 細胞NHL 的1、5 年生存率分析[n(%)]
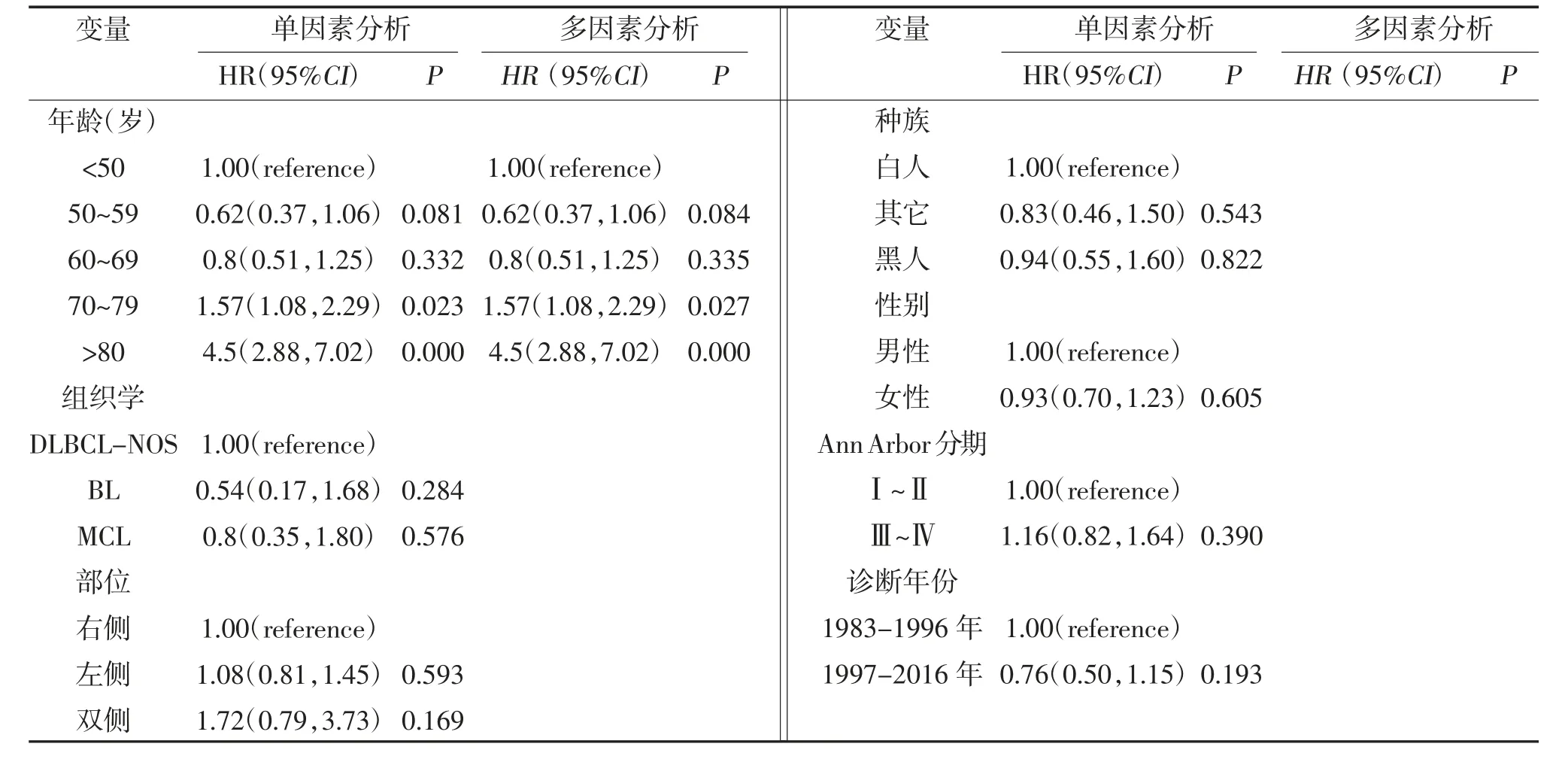
表5 單因素及多因素Cox 分析

圖3 原發腮腺侵襲性B 細胞NHL 中位OS 的K-M 曲線圖
2.3 死因與競爭風險分析
2.3.1 死因分析 納入的研究中共有546 例死亡病例,占納入總病例數的35.16%。最常見的死亡原因為NHL,占34.80%;其次為心臟病,占18.68%,見表6。

表6 患者死因隨訪結果[n(%)]
2.3.2 原發腮腺惰性B 細胞NHL 的競爭風險分析年齡、組織學類型、分期、診斷時間影響原發腮腺惰性B 細胞NHL 相關的死亡。年齡影響非原發惰性腮腺B 細胞NHL 相關的死亡。<50、50~59、60~69、70~79 及≥80 歲年齡段病例的5 年累積死亡風險分別為6.00%、4.40%、4.40%、9.60%及17.00%,見圖4A;組織學類型為MZL、FL 及CLL/SLL 患者的5 年累積死亡風險分別為4.40%、10.10%及17.20%,組織學類型為LPL 患者的5 年累積死亡風險為未達到,見圖4B;Ann Arbor 分期為Ⅰ~Ⅱ期及Ⅲ~Ⅳ期患者的5 年累積死亡風險分別為5.60%、11.70%,見圖4C;診斷時間為1983-1996 年、1997-2016 年時間段患者的5年累積死亡風險分別為5.00%、6.60%,見圖4D。
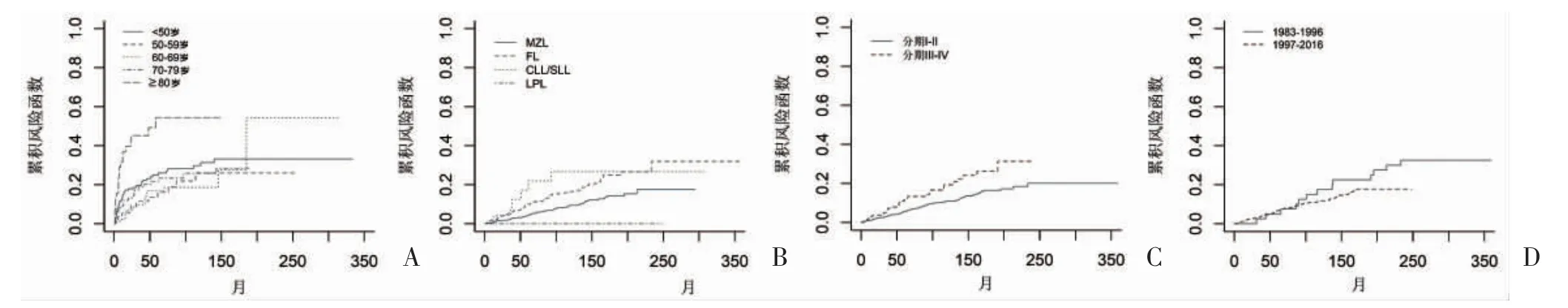
圖4 原發腮腺惰性B 細胞NHL 累積風險函數的K-M 曲線圖
2.3.3 原發腮腺侵襲性B 細胞NHL 的競爭風險分析年齡影響原發腮腺侵襲性B 細胞NHL 相關的死亡,年齡同樣影響非原發侵襲性腮腺B 細胞NHL相關的死亡。<50、50~59、60~69、70~79 及≥80 歲年齡段原發侵襲性腮腺B 細胞NHL 相關的5 年累積死亡風險分別為為25.00%、14.00%、17.00%、22.00%及54.00%,見圖5A;<50、50~59、60~69、70~79 及≥80 歲年齡段非原發侵襲性腮腺B 細胞NHL相關的5 年累積死亡風險分別為13.00%、2.00%、12.00%、18.00%及30.00%,見圖5B。

圖5 原發腮腺B 細胞NHL 累積風險函數的K-M 曲線圖
3 討論
腮腺惡性淋巴瘤較為罕見,臨床上常表現為單側腮腺進行性增大的無痛性腫物,易誤診,導致不必要的手術切除。目前最佳治療方案、預后影響因素均不明確,且研究報道多為個案、病例系列、Meta 分析等,尚缺乏大宗病例的研究[8-10]。
本研究中傾向評分匹配后的多因素Cox 分析表明,組織學亞型是重要的預后影響因子。為此,本研究隨后將納入的病例按惰性、侵襲性淋巴瘤分別進行分析,結果發現不管組織學類型為惰性還是侵襲性,診斷年份為1997-2016 年間的腮腺淋巴瘤患者生存率優于1983-1996 年間診斷的腮腺淋巴瘤,考慮原因為1997 年利妥昔單抗在美國上市,推測這一生存優勢與利妥昔單抗的臨床應用有關。有研究表明[11],靶向藥物利妥昔單抗的出現改善了惰性NHL的OS,但對腮腺惰性NHL 這一具體淋巴瘤亞型的預后影響卻未見有報道。Gupta A 等[12]研究表明,利妥昔單抗+化療提高了DLBCL 的CR 率,降低復發率,提高了EFS,但其是否增加OS 依然存有爭議。多項研究表明[13,14],CHOP 方案化療增加利妥昔單抗可提高DLBCL 患者的OS,但Sousou T 等[13]研究表明,CHOP 方案并不會增加DLBCL 患者的OS。本研究中原發腮腺侵襲性B 細胞NHL 主要組織學類型為DLBCL,利妥昔單抗上市后診斷的原發腮腺侵襲性NHL 預后更佳,但與上市前相比,其OS 并無明顯統計學差異。因此,利妥昔單抗對原發腮腺侵襲性B 細胞NHL 的OS 影響仍待進一步研究。
Ann Arbor 分期與原發腮腺侵襲性B 細胞NHL預后無關,發病單雙側與原發腮腺侵襲性及惰性B細胞NHL 預后無關。Feinstein AJ 等[10]的單因素Cox分析表明,與男性相比,女性原發腮腺B 細胞NHL死亡率更低,但本研究未發現類似的結果。既往研究表明[15],種族影響DLBCL、MCL、FL、MZL、CLL/SLL患者的預后,但這些研究并未區分種族對不同原發部位淋巴瘤預后的影響。本研究研究了種族對原發腮腺淋巴瘤預后的影響,不同種族對原發腮腺B 細胞NHL 的預后并無影響。國際預后指數(IPI)由年齡、腫瘤分期、乳酸脫氫酶(LDH)、體能狀態、結外受侵個數5 部分組成,廣泛用于評估NHL 的預后[16]。但在競爭風險存在的情況下,IPI 并不能針對淋巴瘤特異性死亡風險準確做出評估[17]。因此,鑒別新的預后標記以準確評估淋巴瘤特異性死亡風險極為迫切。本研究中競爭風險回歸分析表明,年齡、組織學類型、Ann Arbor 分期、診斷時間影響原發腮腺惰性B 細胞NHL 特異性死亡;年齡影響原發腮腺侵襲性B 細胞NHL 特異性死亡。但本研究是一項基于人群的大型研究,仍存在一些局限性:首先,回顧性研究有許多固有的偏差;其次,SEER 數據庫沒有提供治療細節(包括手術、聯合或不聯合利妥昔單抗的化療),這可能會影響結果;第三,因沒有足夠的臨床數據可用于風險分層,因此尚未進行基于IPI 風險的生存分析。
綜上所述,原發腮腺B 細胞NHL 主要的組織學亞型是MZL、DLBCL,組織學亞型和年齡與原發腮腺B 細胞NHL 的預后密切相關。

