蜜環菌β-1,6-葡聚糖通過調節人源巨噬細胞極化發揮抑制結腸癌作用
任 愛,沈丹陽,王源寧,陳 磊,孫 琳,周義發,程海榮
(東北師范大學 生命科學學院,長春 130024)
目前, 結直腸癌已成為世界第三大常見癌癥,平均每年新增病例約200萬[1].治療結腸癌的方法主要有手術、放療、化療和免疫療法.其中免疫療法因其高效、副作用低等優勢已引起人們廣泛關注[2].巨噬細胞在免疫系統中發揮重要作用,既作為固有免疫應答細胞,又作為免疫調節細胞,可誘導、抑制或調節適應性免疫反應,參與器官發育、宿主防御、急慢性炎癥、感染和代謝等各種生理病理過程[3].腫瘤組織中浸潤大量的巨噬細胞,稱為腫瘤相關巨噬細胞(tumor-associated macrophages,TAMs).巨噬細胞具有較強的可塑性,有兩種常見亞型: 1) M1型巨噬細胞即經典激活巨噬細胞,具有較強的抗原提呈能力,可促進炎癥反應、產生大量促炎因子,如TNF-α,IL-6和IL-1β等,上調M1型巨噬細胞標志物表達如CD80,CD86,iNOS等[4];2) M2型巨噬細胞, 是選擇性活化巨噬細胞,能抑制炎癥反應,促進血管生成[5],可產生大量的抑炎因子,如TGF-β,IL-4,IL-10等,以及上調M2型巨噬細胞標志物表達,如Arg-1,Ym-1,Fizz-1和CCL18等.在腫瘤微環境中,TAMs主要表現為M2型.研究表明,M2和M1 的比值與腫瘤的愈后呈明顯相關性.因此,誘導M2型巨噬細胞向M1型極化對抑制腫瘤生長具有重要意義.
多糖具有調節免疫[6]、抗腫瘤[7]、抗病毒[8]、抗炎[9]和抗氧化[10]等多種生物活性.多糖可促進促腫瘤生長的M2型巨噬細胞向抑制腫瘤生長的M1型巨噬細胞極化.其中,酵母β-葡聚糖可促進TAMs轉化為M1型巨噬細胞,并已應用于神經母細胞瘤患者的Ⅰ期臨床試驗中[11];姬松茸多糖可提高M2型巨噬細胞中TNF-α,NOS2,IL-12和IL-6的表達,即向M1表型轉化[12];豬苓多糖可顯著增加炎癥相關因子的表達,將M2型巨噬細胞轉化為M1型巨噬細胞[13].
蜜環菌(Amillariellamellea)屬擔子菌門傘菌目泡頭菌科,是一種在我國分布廣泛的食用菌.文獻[14]從蜜環菌子實體中通過乙醇分級醇沉分離得到一種β-1,6-葡聚糖并命名為 AAMP-A70,其分子量為5 600.研究表明,AAMP-A70能夠上調小鼠單核巨噬細胞RAW264.7中NO,ROS,IL-1β,TNF-α和IL-6的表達,同時也可將小鼠單核巨噬細胞RAW264.7從M2型轉化為M1型, 進而抑制結腸癌細胞HCT116的增殖[15].在此基礎上,本文采用人源單核巨噬細胞THP-1研究AAMP-A70對M2型巨噬細胞極化的影響,并分析該極化作用對人源結腸癌細胞DLD-1增殖和凋亡的影響.研究結果可豐富β-1,6-葡聚糖誘導巨噬細胞極化的研究,同時為β-1,6-葡聚糖作為抗腫瘤藥物的開發提供理論基礎.
1 材料與方法
1.1 材 料
1.1.1 實驗材料
人源單核細胞THP-1和人源結腸癌細胞DLD-1均購于美國模式培養物集存庫(ATCC).蜜環菌均一級分AAMP-A70,參考文獻[13]制備.
1.1.2 主要試劑
DMEM高糖培養基和RPMI-1640培養基購于美國Gibco公司;IL-4,IL-13和IFN-γ購于美國MCE公司;脂多糖(LPS)和佛波酯(PMA)購于美國Sigma公司;PARP,Pro-casepase-3和Cleaved-Casepase-3抗體購于美國Cell Signaling Technology公司;胎牛血清購于浙江天杭生物科技股份有限公司;ELISA試劑盒購于武漢博士德生物工程有限公司;胰酶、二甲亞砜(DMSO)和結晶紫購于北京索萊寶科技有限公司;TRNzol試劑和反轉錄試劑盒購于天根生化科技(北京)有限公司;磺胺和萘胺購于天津光復精細化工研究所.
1.1.3 主要實驗儀器
多功能酶標儀(SPARK 10M型,瑞士Tecan公司); NanoDrop微量分光光度計(ND-ONE-W型,美國Thermo Fisher Scientific公司); 實時熒光定量PCR儀(聚合酶鏈式反應,qRT-PCR, LightCycler480Ⅱ型,瑞士Roche公司);電泳儀(JY600E型,北京君意東方電泳設備有限公司);垂直電泳槽(VE-180型)、轉移電泳槽(VE-186型)和化學發光分析系統(4600型)均購于上海天能科技有限公司.
1.2 方 法
1.2.1 巨噬細胞極化實驗

圖1 THP-1細胞誘導為M1和M2型巨噬細胞及 AAMP-A70處理M2型巨噬細胞示意圖Fig.1 Schematic diagram of induction of THP-1 cells into M1 and M2-like macrophages and AAMP-A70 treatment of M2-like macrophages
THP-1按1.6×106個/孔鋪于6孔板中,采用100 ng/mL PMA處理THP-1細胞24 h即可將其誘導為M0型巨噬細胞.向該M0型巨噬細胞中加入20 ng/mL的 IL-4和IL-13再誘導24 h,即可誘導為M2型巨噬細胞.在THP-1細胞培養基中加入100 ng/mL PMA孵育 48 h后,再加入20 ng/mL的IFN-γ和100 ng/mL 的LPS,即可誘導為M1型巨噬細胞.AAMP-A70處理組(M2+AAMP-A70組)在將THP-1細胞誘導為M2型巨噬細胞24 h后,加入200 μg/mL AAMP-A70,繼續培養24 h,其示意圖如圖1所示.
1.2.2 酶聯免疫吸附(ELISA)實驗
取細胞上清液按1∶100(體積比,下同)稀釋后按100 μL/孔加入酶標板中,于37 ℃孵育90 min后,棄去液體;每孔加入 100 μL稀釋后的抗體,37 ℃孵育60 min后,棄去液體;用洗滌液洗滌5次,每次1 min.每孔加入 100 μL 稀釋后的ABC抗體,37 ℃孵育30 min后,棄去液體,用洗滌液洗滌5次,每次1 min.每孔加入90 μL的3,3′,5,5′-四甲基聯苯胺(TMB)顯色液,充分顯色后,加入100 μL終止液.采用酶標儀在 450 nm 處檢測各孔吸光值,TNF-α及VEGF相對釋放量=(AM1組,M2組或M2+AAMP-A70組/AM1組)×100%.
1.2.3 實時熒光定量PCR(qRT-PCR)
向每組細胞中加入1 mL TRNzol試劑提取mRNA,采用反轉錄試劑盒對mRNA進行反轉錄,使用NanoDrop分光光度計測定cDNA濃度和純度.根據qRT-PCR試劑盒的說明書進行實時定量PCR擴增.反應程序為: 95 ℃,5 min;反應40個循環,每個循環為95 ℃,10 s;58 ℃,10 s;72 ℃,10 s.引物由生工生物工程(上海) 股份有限公司合成,合成引物序列如下:
TNF-α,Forward: 5′-TGGAGCTGGCCGAGGAG-3′,
Reverse: 5′-AGCAGGCAGAAGAGCGTGG-3′;
Arg-1,Forward: 5′-TGGACAGACTAGGAATTGGCA-3′,
Reverse: 5′-CCAGTCCGTCAACATCAAAACT-3′;
IL-1β,Forward: 5′-AATCTGTACCTGTCCTGCGTGTT-3′,
Reverse: 5′-TGGGTAATTTTTGGGATCTACACTCT-3′;
TGF-β,Forward: 5′-CCCTGGACACCAACTATTGC-3′,
Reverse: 5′-GCAGAAGTTGGCATGGTAGC-3′;
CCR7,Forward: 5′-AGTCTTCCAGCTGCCCTACA-3′,
Reverse: 5′-TCGTAGGCGATGTTGAGTTG-3′.
1.2.4 結晶紫染色實驗
采用1.2.1的方法給藥后,取誘導后的M2組、M2+AAMP-A70組和M1組THP-1細胞,棄去培養基,加入無血清培養基繼續培養24 h.收集細胞培養上清液,并加入胎牛血清調整至終體積分數為5%.將體積分數為75%的培養上清液(conditioned medium,CM)加至DLD-1細胞中,于細胞培養箱中培養72 h后,棄培養上清液,每孔加入500 μL無水甲醇,于室溫中靜置5 min后,再加入500 μL結晶紫試劑,于室溫中染色5 min.棄染色液后流水沖洗,去除多余染色液,室溫晾干后拍照.
1.2.5 MTT實驗
將DLD-1細胞按1×104個/孔鋪于96孔板中.按1.2.4方法收集的各組上清液以不同濃度加至DLD-1中培養72 h后,棄去上清液.每組加入0.5 mg/mL MTT溶液100 μL,于37 ℃孵育4 h后,每組加入含0.04 mol/L HCl的質量分數為20%的十二烷基硫酸鈉(SDS)溶液50 μL,于37 ℃培養箱中培養12 h后,采用酶標儀于570 nm處測各孔吸光值.
1.2.6 Western-blot實驗
提取各上清液處理后的DLD-1細胞中的總蛋白,并進行蛋白定量.采用質量分數為12%丙烯酰胺凝膠分離蛋白樣品,先將蛋白轉至聚偏二氟乙烯(PVDF)膜上,再用脫脂牛奶封閉后,采用磷酸鹽緩沖液(PBST)洗滌.加入按1∶1 000稀釋的一抗工作液,置于4 ℃搖床中孵育過夜.洗滌后加入按1∶5 000稀釋的二抗工作液,室溫孵育1 h,采用PBST洗滌.將增強型化學發光劑(ECL)均勻滴于PVDF膜上,采用化學發光儀檢測凋亡相關蛋白的表達.
1.2.7 統計學分析
所有實驗數據用SPSS 19.0軟件進行統計學分析,結果均以平均值±標準差的形式(SD)表示.兩組數據的顯著性用t檢驗進行比較.當p<0.05時,表示差異顯著,表明該結果具有統計學意義.*表示p<0.05,**表示p<0.01,***表示p<0.001.
2 結果與討論
2.1 AAMP-A70對M2型人源巨噬細胞極化的影響
2.1.1 AAMP-A70對M2型人源巨噬細胞TNF-α和VEGF釋放量的影響
M1型巨噬細胞高表達促炎因子(如TNF-α和IL-6等),產生的VEGF量較低;而M2型巨噬細胞則相反.研究表明,當AAMP-A70質量濃度為200 μg/mL時,其誘導RAW264.7小鼠單核巨噬細胞活化的能力較強[14-15].因此,本文采用200 μg/mL 的AAMP-A70處理THP-1細胞誘導的M2型巨噬細胞,并采用ELISA方法檢測TNF-α和VEGF的相對含量.結果表明,M2型巨噬細胞TNF-α分泌量較低,VEGF分泌量較高,即已誘導出M2型巨噬細胞.采用AAMP-A70處理M2型巨噬細胞后,TNF-α分泌量顯著增加(p<0.001),VEGF含量顯著降低,表明AAMP-A70可促進M2型巨噬細胞向M1型極化,如圖2所示.
2.1.2 AAMP-A70對M2型人源巨噬細胞特異性標志蛋白mRNA表達的影響
研究表明, M1型巨噬細胞高表達TNF-α,IL-1β和CCR7的mRNA,低表達Arg-1和TGF-β的mRNA,M2型巨噬細胞相反.本文采用qRT-PCR方法在轉錄水平上檢測AAMP-A70對M2型人源巨噬細胞特異性標志蛋白的mRNA表達的影響,結果如圖3所示.由圖3可見,M2型巨噬細胞低表達TNF-α,IL-1β和CCR7的mRNA,高表達Arg-1和TGF-β的mRNA.AAMP-A70處理的M2型巨噬細胞具有 M1型巨噬細胞的特征,即TNF-α,IL-1β和CCR7的mRNA表達量顯著增加,Arg-1和TGF-β的mRNA表達量顯著降低.因此AAMP-A70可顯著促進M2型巨噬細胞向M1型極化.
2.2 AAMP-A70通過促進M2型巨噬細胞向M1型極化抑制結腸癌細胞的增殖
研究表明,AAMP-A70對人結腸癌細胞DLD-1、人結腸癌細胞HCT116及小鼠結腸癌細胞CT26的增殖均無直接抑制作用.本文采用結晶紫染色實驗和MTT實驗檢測AAMP-A70促進M2型巨噬細胞向M1型極化是否能夠抑制結腸癌細胞的增殖.通過鏡下觀察和結晶紫染色,結果分別如圖4和圖5所示.由圖4和圖5可見,M1型巨噬細胞培養液可顯著抑制DLD-1細胞的增殖,M2型巨噬細胞培養液處理組的DLD-1細胞無明顯變化,AAMP-A70處理的M2型巨噬細胞培養液的DLD-1細胞增殖明顯減少.
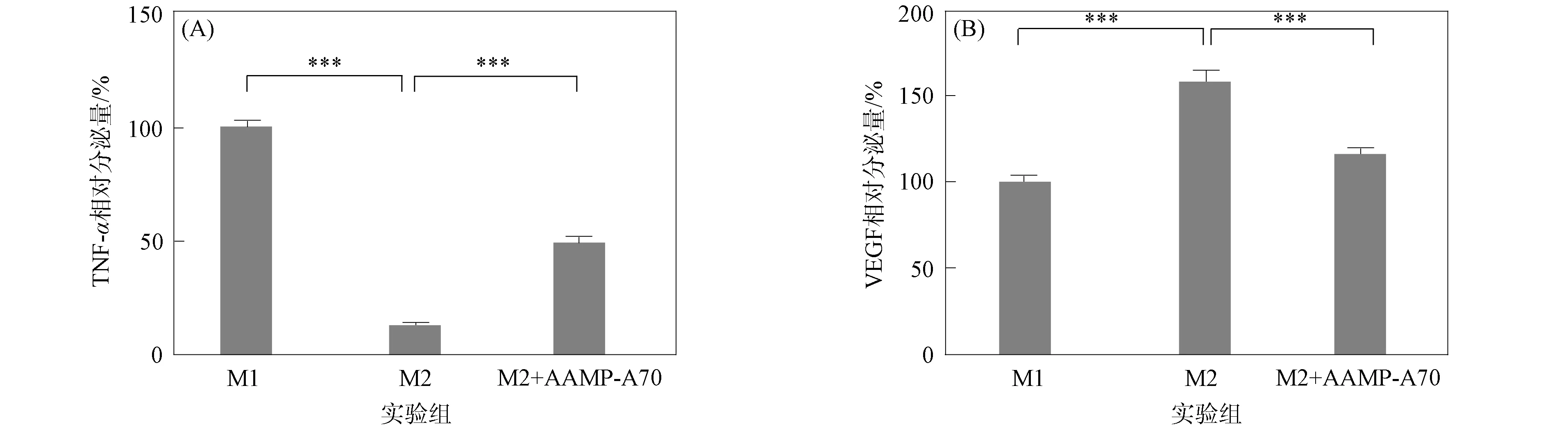
***表示p<0.001.圖2 AAMP-A70對M2型人源巨噬細胞TNF-α(A)和VEGF(B)釋放量的影響Fig.2 Effects of AAMP-A70 on TNF-α (A) and VEGF (B) production released by human M2-like macrophages
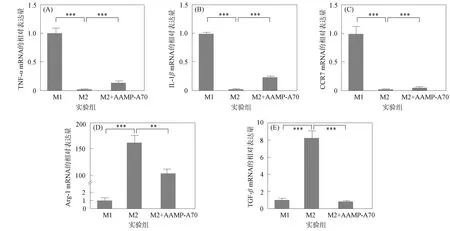
**表示p<0.01; ***表示p<0.001.圖3 AAMP-A70對M2型人源巨噬細胞極化相關特異性標志蛋白mRNA表達的影響Fig.3 Effects of AAMP-A70 on expression of polarization related specific marker protein mRNA of M2 human macrophages
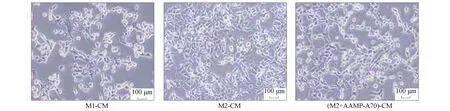
圖4 DLD-1細胞形態Fig.4 DLD-1 cell morphology
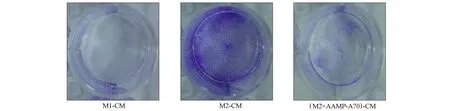
圖5 結晶紫染色實驗結果Fig.5 Experimental results of crystal violent staining
采用MTT實驗檢測各組不同濃度的巨噬細胞培養液對DLD-1細胞增殖的影響,結果如圖6所示.由圖6可見,不同體積分數的M1型巨噬細胞培養液均可顯著抑制DLD-1細胞的增殖(p<0.001),不同體積分數的M2型巨噬細胞培養液對DLD-1細胞的增殖均無影響(p>0.05),AAMP-A70處理的M2型巨噬細胞培養液隨濃度的增加對DLD-1細胞增殖的抑制作用逐漸增強.因此AAMP-A70可通過促進M2型巨噬細胞向M1型極化,從而抑制結腸癌細胞DLD-1的增殖.
2.3 AAMP-A70通過促進M2型巨噬細胞向M1型極化促進結腸癌細胞的凋亡
將M1,M2和M2+AAMP-A70組巨噬細胞培養上清液與結腸癌細胞DLD-1共培養72 h后,提取細胞總蛋白,并采用Western-blot實驗檢測凋亡相關蛋白PARP和Caspase-3的表達情況,結果如圖7所示.由圖7可見: M1型巨噬細胞培養液可顯著促進凋亡相關蛋白PARP和Caspase-3水解,即cleaved-PARP和 cleaved-Caspase-3表達;M2型巨噬細胞培養液處理DLD-1對凋亡相關蛋白無明顯影響;AAMP-A70處理M2型巨噬細胞的培養液可顯著上調PARP和Caspase-3水解.因此AAMP-A70可通過促進M2型巨噬細胞向M1型轉化誘導DLD-1發生明顯細胞凋亡.
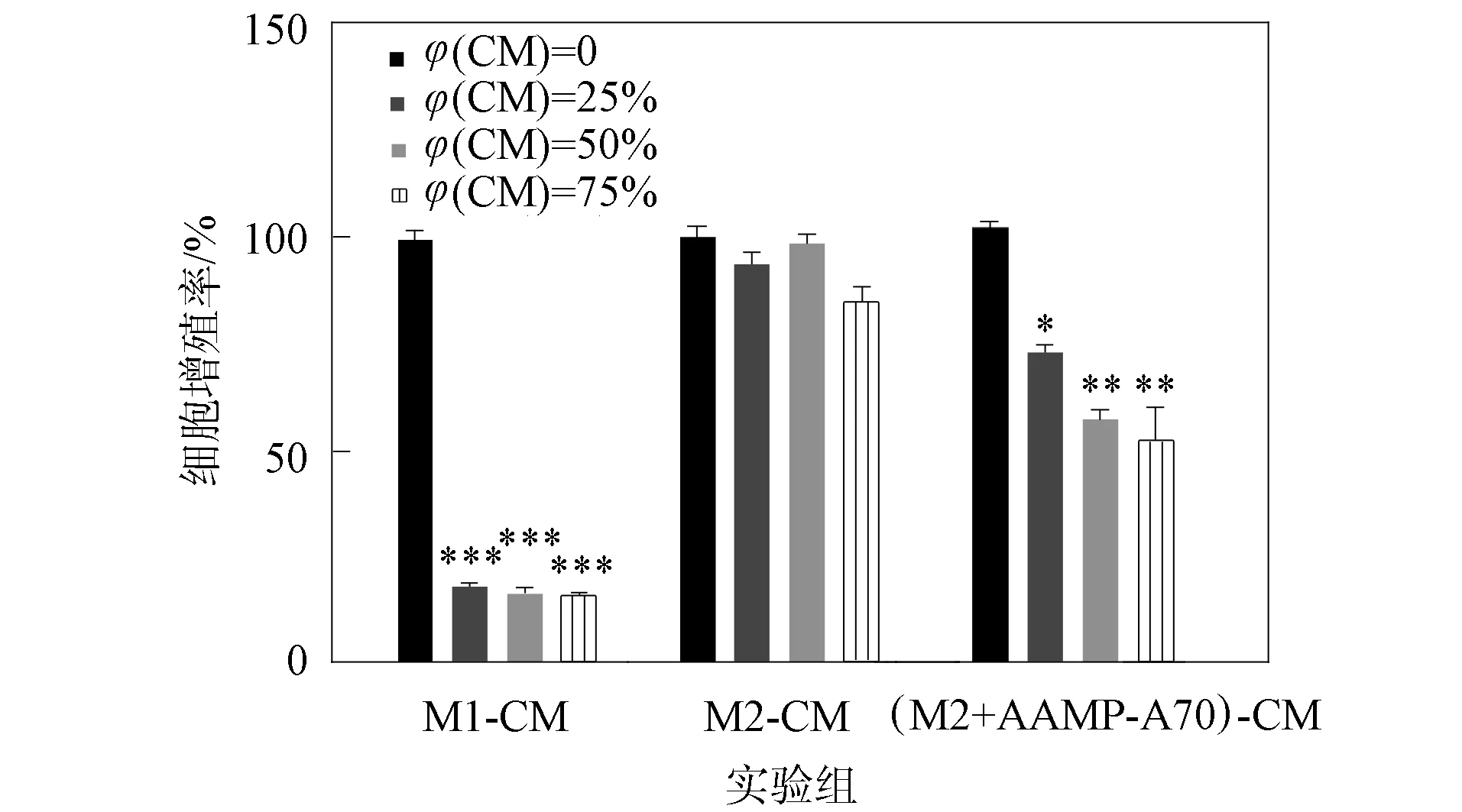
*表示p<0.05; **表示p<0.01; ***表示p<0.001.圖6 MTT實驗結果Fig.6 Experimental results of MTT
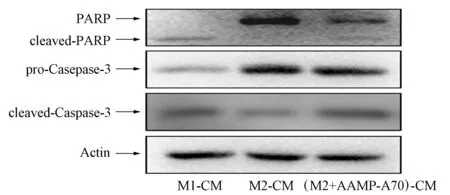
圖7 AAMP-A70處理的M2型巨噬細胞 培養液對結腸癌細胞DLD-1凋亡 相關蛋白表達的影響Fig.7 Effect of M2-like macrophage culture medium treated with AAMP-A70 on expressions of apoptotic- related proteins DLD-1 in colon cancer cells
綜上所述,AAMP-A70可促進由THP-1誘導的M2型巨噬細胞高表達M1型特異性標志分子TNF-α,IL-1β和CCR7,并抑制M2型特異性標志分子Arg-1,VEGF和TGF-β的表達,表明AAMP-A70可抑制M2型巨噬細胞向M1極化.此外,AAMP-A70可通過促進巨噬細胞極化抑制結腸癌細胞DLD-1的增殖,誘導其凋亡.

