阿司匹林丁香酚酯對LPS誘導的Caco-2細胞炎癥的作用效果對比
陶 琦,劉希望,秦 哲,李世宏,白莉霞,楊亞軍,李劍勇
(中國農業科學院 蘭州畜牧與獸藥研究所/農業農村部獸用藥物創制重點實驗室/甘肅省新獸藥工程重點實驗室,甘肅 蘭州 730050)
腸炎的發病率很高,嚴重危害養殖業發展與人類健康。目前,對腸炎的治療方法主要依靠抗生素,但這些藥物常常造成腸道菌群失調、抗生素殘留、環境污染等問題,且效果并不理想[1-2]。Caco-2細胞系(human colon adenocarcinoma cell line)是一種人結腸腺癌細胞,最早由美國堪薩斯大學藥學院Ronald T.Borchardt 實驗室,以及英國的Ciba-Geigy實驗室在20世紀80年代后期建立的,是第一個被國外制藥企業以及實驗室廣泛應用的腸道吸收細胞模型[3-4]。2002年被國際認定為動物實驗替代方法,已經被FDA批準[5]。
腸炎是指腸壁表層和深層組織的炎癥,由于致病因素的刺激導致腸道發生不同程度的水腫、充血、出血、潰瘍、化膿、壞死等病變,臨床以消化紊亂、腹痛、腹瀉以及發熱為特征[6]。腸炎一般分為2種:感染性腸炎和非感染性腸炎。感染性腸炎常由病原微生物或其他因素誘發,常見的病原主要有細菌(致病性大腸桿菌、魏氏梭菌、痢疾桿菌等)、病毒(犬瘟熱病毒、犬細小病毒、輪狀病毒等)、寄生蟲(鞭毛蟲、球蟲、弓形蟲等)、真菌(藻狀菌、曲霉菌、白念珠菌等),其中以大腸桿菌導致的細菌性腸炎最為普遍[7];非感染性腸炎多與環境、營養、免疫等應激因素有關[6]。而炎癥性腸病(inflammatory bowel disease,IBD)是一種病因未明的慢性腸道炎癥性疾病,包括潰瘍性結腸炎(ulcerative colitis,UC)和克羅恩病(Crohn's disease,CD),其發病機制尚不十分清楚,因此臨床上治療和預防腸炎仍是待解決的難題[8]。腸道也是機體免疫的重要器官[9],腸道免疫在人類炎性腸病、肥胖、糖尿病、動脈粥樣硬化、過敏性疾病及結腸癌中起著關鍵性作用[10-12]。在機體正常條件下,細胞分泌的細胞因子參與機體固有和適應性免疫應答調節,促進損傷組織的修復,參與細胞間的調控[13]。然而當機體被微生物入侵時,多種細胞因子在短期內快速分泌,超出機體免疫調節范圍,造成局部炎癥反應,損傷機體組織和器官[14]。促炎細胞因子是炎癥反應早期產物,已證實,IBD患者的腸道中分泌大量促炎細胞因子[15],如TNF-α、IL-1β、IL-6、IL-8、IL-12、IL-17 和IFN-γ。
阿司匹林丁香酚酯(aspirin eugenol ester,AEE)是利用結構拼合的前藥原理,以丁香酚(eugenol,EUG)對阿司匹林(aspirin,ASP)進行酯化修飾而合成的一種新型藥用化合物,其降低了阿司匹林對胃腸道的刺激性,同時增強了揮發油丁香酚的穩定性。研究表明,AEE具有確切的抗炎、抗氧化、降血脂、預防動脈粥樣硬化和預防血栓形成和抗急性肝損傷等作用[16-18],效果優于前體藥物ASP和EUG,具有很好的成藥性。基于以上研究成果,推測AEE可能對IBD有一定的作用效果。鑒于此,本試驗以脂多糖(lipopolysaccharide,LPS)誘導Caco-2形成細胞炎癥模型,并采用響應面法優化該炎癥模型,通過對促炎細胞因子產生的影響,探討AEE對該炎癥模型的治療、預防和保護作用,以及與其前體藥物藥效的差異,為AEE在腸炎防治方面的應用提供依據。
1 材料與方法
1.1 實驗材料人結腸腺癌細胞Caco-2購自中國科學院上海細胞庫;MEM培養基、胎牛血清(FBS)、非必需氨基酸、L-谷氨酰胺、丙酮酸鈉、胰酶購自Gibco公司;LPS(Sigma-Aldrich,批號L4391);阿司匹林丁香酚酯(含量99.8%,中國農業科學院蘭州畜牧與獸藥研究所自制);阿司匹林(含量99.8%,中國食品藥品檢定研究院);丁香酚(含量99.95%,北京中科質檢生物技術有限公司);CCK-8(Sigma-Aldrich,批號96992);IL-1β、IL-6和TNF-α ELISA檢測試劑盒購自上海酶聯;酶標儀(Thermo Multiskan GO)。
1.2 藥物配制將AEE溶解在DMSO中,配制成濃度為256 mmol/L的溶液作為母液,每種濃度用DMSO倍比稀釋后備用。將不同樣品中DMSO的最終濃度控制在0.5%以下;ASP及EUG操作同上;LPS用PBS溶解,配制成10 g/L的母液備用。
1.3 Caco-2細胞培養Caco-2細胞培養于MEM培養液(含20% FBS,1%非必需氨基酸,1%L-谷氨酰胺,1%丙酮酸鈉)中,接種于T-25 cm2細胞培養瓶(Corning?)中,置于37℃、5% CO2、90%相對濕度的細胞培養箱中進行培養,隔日換液。在倒置顯微鏡下觀察,當瓶中細胞生長達到90%左右時,用PBS洗滌除去非貼壁細胞,然后加入0.8 mL胰酶消化液進行消化傳代,進行以下試驗。
1.4 Caco-2細胞毒性試驗取對數生長期Caco-2細胞,調整細胞密度至1×105個/mL,于96孔板中每孔加入100 μL細胞懸液,培養24 h,棄掉培養液。試驗組:各孔加入100 μL不同質量濃度的LPS溶液(0.3,0.75,1.5,3,6,12,25,50,100 mg/L),每個質量濃度設置6個平行的重復孔;正常組:加入100 μL 不含LPS的細胞培養基,設置6個平行的重復孔;空白組:不含細胞的孔中,加入細胞培養液,設置6個平行的重復孔。將細胞分別培養24 h后,每孔加入10 μL的CCK-8溶液,繼續培養1~2 h后,用酶標儀測量D450 nm值。相同方法檢測AEE、ASP、EUG、ASP+EUG(1∶1)對Caco-2細胞的毒性。計算細胞活力公式如下:細胞活力=(試驗組-空白組)/(正常組-空白組)×100%。
1.5 基于響應面優化LPS誘導Caco-2細胞炎癥的作用濃度和時間以IL-1β、IL-6和TNF-α的分泌量為指標,采用響應面分析法中的User-Design,優化LPS的質量濃度和作用時間。將濃度和作用時間的參數范圍輸入Design-Expert 軟件,生成User-Design響應面試驗表,即LPS對Caco-2細胞的作用濃度和時間(表1),依此安排試驗。加入LPS后,于對應時間點從6孔板中取300 μL細胞上清液,再補充300 μL的新鮮培養液,繼續培養至相應時間點以移取上清液。根據試劑盒說明書處理上清液樣品,檢測IL-1β、IL-6和TNF-α的生成量;將結果帶入軟件分析,得出LPS誘導Caco-2細胞炎癥模型的最佳時間和最佳濃度。
1.6 AEE對LPS誘導的Caco-2細胞炎癥模型作用方式將Caco-2細胞分為空白組和試驗組,空白組不經任何處理,正常培養;試驗組進行以下處理。同時檢測不同處理組IL-1β、IL-6和TNF-α的含量。
1.6.1AEE預防作用 用不同濃度的AEE(4,16,32 μmol/L)孵育24 h后,棄上清,加入最佳濃度的LPS孵育至最佳時間后取樣檢測。
1.6.2AEE保護作用 將前述不同濃度的AEE與最佳濃度的LPS混合,孵育至最佳時間后取樣檢測。
1.6.3AEE治療作用 以最佳濃度的LPS孵育至最佳時間后,棄上清,加入前述不同濃度的AEE孵育24 h后取樣檢測。
1.7 AEE與其前體藥作用效果對比根據1.6的結果得出AEE的最佳作用濃度,然后配制相同濃度的ASP、EUG、ASP+EUG(1∶1)溶液,以相同方法進行相關試驗,對比作用效果。
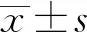
2 結果
2.1 藥物對Caco-2細胞活性的影響CCK-8法檢測LPS對Caco-2細胞活力的影響(圖1),AEE、ASP、EUG和ASP+EUG(1∶1)對Caco-2細胞活力的影響(圖2)。結果顯示,LPS質量濃度在0.3~25 mg/L時,細胞活力隨著質量濃度的增加而增加,說明在此質量濃度范圍內LPS對Caco-2細胞活力有促進作用。隨著質量濃度的繼續增加,細胞活力又有一定的下降,但細胞活力仍在95%以上。在所選的濃度范圍內,AEE和ASP對Caco-2細胞活力的影響較小,無顯著性差異。但256 μmol/L 的EUG及ASP+EUG(1∶1),對Caco-2細胞活力有顯著影響(P<0.001);故其濃度選定在0~128 μmol/L。

與空白對照組相比***P<0.001
2.2 基于響應面優化LPS誘導Caco-2細胞炎癥的作用濃度和時間
2.2.1試驗方案及結果 如表1所示。

表1 User-Design試驗設計及其結果
2.2.2響應面模型的擬合 基于表1所示的模擬響應結果,建立IL-1β、TNF-α和IL-6分泌量與時間和濃度之間的回歸模型:IL-1β=18.897 1- 0.028 8A+0.044 7B-2.506 6E-004AB+2.751 2E-004A2+0.010 3B2;TNF-α=8.495 1+0.027 7A+0.274 8B-3.224 2E-004AB-2.484 7E-004A2;IL-6=9.943 1-0.019 7A-0.124 5B+3.790 2E-004AB+2.999 2E-004A2+8.426 9E-003B2。
對IL-1β、TNF-α和IL-6分泌量與時間和濃度之間的回歸方程進行方差分析(表2),結果顯示,3個指標回歸模型的P值均小于0.05,說明該模型顯著,可進行分析和預測。

A.AEE;B.ASP;C.EUG;D.ASP+EUG(1∶1)。與空白對照組相比***P<0.001,*P<0.05
2.2.3響應曲面分析 為了更加直觀地表示各因素與響應目標之間的關系,利用三維曲面圖進一步分析各因素對IL-1β、TNF-α和IL-6分泌量的影響。由Design-Expert 8.0.5軟件對回歸模型進行優化分析得到IL-1β、TNF-α和IL-6分泌量的最佳條件是LPS質量濃度為100 mg/L,LPS作用時間為24 h,在此條件下,預測IL-1β、TNF-α和IL-6分泌量能達到最大(圖3)。

表2 回歸方程的方差分析
2.3 LPS及受試藥物的細胞毒性作用CCK-8試驗結果顯示,LPS在所選的濃度范圍內對Caco-2細胞活力無影響,甚至低濃度的LPS對其還有一定的促進作用。響應面分析的結果顯示,LPS最佳質量濃度為100 mg/L,作用最佳時間為24 h。與正常組比較,LPS組IL-1β、TNF-α和IL-6的濃度顯著升高,表明Caco-2細胞炎癥模型誘導成功。

A.IL-1β;B.TNF-α;C.IL-6
受試藥物的細胞毒性試驗結果顯示,EUG和ASP+EUG(1∶1)的濃度為256 μmol/L時,可致細胞活力顯著下降(P<0.05),可能與丁香酚的性質有關[19-20];而AEE和ASP的濃度為256 μmol/L時,對Caco-2的細胞活力無顯著影響(P>0.05),且AEE濃度為32 μmol/L時,對Caco-2細胞活力有促進作用(P<0.05)。因此,本研究中受試藥物濃度為4,16,32 μmol/L。
2.4 AEE對LPS誘導的Caco-2細胞炎癥模型的作用不同濃度AEE的作用結果如圖4所示。在各作用方式下,高濃度AEE組的細胞因子水平均低于低、中濃度組(P<0.05),且呈現一定的濃度依賴性。在該細胞模型上,AEE治療后IL-6水平顯著低于AEE預防和保護后的水平(P<0.05)(圖4A),而細胞因子IL-1β則與AEE預防和保護后的水平無顯著性差異(P>0.05)(圖4B);AEE治療后的TNF-α水平顯著低于AEE保護后的水平(P<0.05),而與AEE預防后的TNF-α水平無顯著性差異(P>0.05)(圖4C)。以上結果說明,AEE對LPS誘導的Caco-2細胞炎癥模型治療效果較好。

A.IL-6;B.IL-1β;C.TNF-α。與空白對照組相比**P<0.01,*P<0.05;與LPS組相比###P<0.001,##P<0.01
2.5 AEE與其前體藥作用效果的對比在治療作用的條件下,AEE及前體藥物的濃度均為32 μmol/L,各細胞因子的生成量見圖5。結果顯示,AEE治療后,細胞因子IL-1β、TNF-α和IL-6的量均低于ASP、EUG和ASP+EUG(1∶1)(P<0.05),表明AEE的治療效果優于其前體藥物。

與空白對照組相比***P<0.001,**P<0.01,*P<0.05;與LPS組相比###P<0.001,##P<0.01
3 討論
炎癥是機體的正常防御活動,是先天免疫系統針對組織損傷、感染或刺激做出的復雜生物反應[21]。然而,過度和不受控制的炎癥反應可能會對身體造成損害。腸上皮細胞(IEC)被認為是腸黏膜屏障的重要組成部分,IEC的物理屏障在腸道炎癥期間起著重要作用,可有效防止病原體進入,并通過分泌多種炎癥介質積極參與先天性和獲得性免疫反應[22-23]。
多項研究證明,Caco-2細胞適用于腸道炎癥的相關研究,通過相關細胞因子或LPS誘導Caco-2細胞的炎癥模型是最常用的體外腸道炎癥模型[24-25]。促炎細胞因子在調節腸道免疫中起到重要作用,其中,IL-1β、TNF-α和IL-6異常被視為IBD的重要發病機制。IL-1β是炎癥反應的重要因子,并參與多種細胞活動,包括細胞增殖、分化和凋亡。TNF-α是由157個氨基酸組成的肽類促炎因子,相對分子質量為17 kDa[26],主要作用是誘導細胞凋亡。IL-6是由184個氨基酸組成,相對分子質量為26 kDa的糖蛋白[27],是一種重要的促炎細胞因子,其表達主要受到IL-1β和TNF-α的誘導。因此,本試驗采用LPS誘導的Caco-2細胞炎癥模型來模擬腸炎的發生,通過對IL-1β、TNF-α和IL-6產生的影響,反映Caco-2細胞炎癥模型造模是否成功。通常IL-1β、TNF-α和IL-6的分泌量顯著上升,說明造模成功[28- 29]。
響應面法是優化造模條件的常用方法,其使用特定點的函數值,用多項式表達來逼近極限狀態函數,與正交試驗相比,更加接近最優值[30]。因此,本試驗采用響應面法優化LPS誘導Caco-2細胞炎癥模型的作用濃度與時間。據此確定的最佳條件為LPS質量濃度100 mg/L、作用時間24 h,此結果與吳喜喜等[24]結果一致。當LPS質量濃度為100 mg/L,作用Caco-2細胞24 h后,LPS組的IL-1β、TNF-α和IL-6水平顯著高于空白對照組(P<0.001)。結果顯示,Caco-2細胞炎癥模型誘導成功。
大鼠體內試驗結果已表明,AEE可以顯著降低與炎癥形成相關的5種關鍵內源性生物活性酶(環氧合酶-1、環氧合酶-2、C-反應蛋白、凝血酶原和花生四烯酸 5-脂肪氧化酶)的活性[31]。然而,AEE對損傷條件下IEC炎癥反應的影響尚不清楚。因此,本試驗首次通過LPS誘導Caco-2細胞形成炎癥模型來探討AEE防治腸炎的效果。結果發現,AEE治療Caco-2細胞炎癥模型后,IL-1β、IL-6和TNF-α的分泌水平均顯著地下降(P<0.05),這類似于多種中藥單體抗炎作用,例如,槲皮素[32]、木犀草素[33]和枸杞多糖[34]。AEE治療Caco-2細胞炎癥模型后IL-1β、IL-6、TNF-α的分泌量顯著低于前體藥物ASP、EUG和ASP+EUG(1∶1)的治療(P<0.05),說明AEE治療Caco-2細胞炎癥模型的效果優于前體藥物ASP、EUG和ASP+EUG(1∶1),這可能與EUG對ASP進行酯化修飾后二者發揮協同作用或產生了新的作用機制有關。
研究表明,NF-κB信號通路激活IEC產生促炎細胞因子[35]。NF-κB是一種在炎癥、細胞分化和惡性腫瘤細胞的增殖和存活中具有關鍵作用的轉錄因子,參與細胞外來刺激的反應[36-37]。在正常狀態下,NF-κB通常通過與IκB蛋白結合在細胞質中沒有活性。但當受到外源性刺激物(例如IL-1β、TNF-α、LPS和細菌等)刺激時,NF-κB被激活并與IκB分離。然后NF-κB被轉移到細胞核中,調節許多與炎癥相關基因的表達[38],包括 TNF-α、IL-1β、IL-6、IL-8、IL-10和IL-12。大量研究表明,NF-κB通路在IBD的發病機制和進展中起著關鍵作用[39-40]。TNF-α、IL-1β和IL-6分泌異常被視為IBD的重要發病機制,抑制這些促炎細胞因子產生是評估抗炎藥療效的關鍵因素[41]。AEE可顯著地降低Caco-2細胞炎癥模型中的TNF-α、IL-1β和IL-6分泌量,說明AEE可能也是通過抑制NF-κB通路達到治療腸炎的效果。
綜上所述,AEE作用于Caco-2細胞炎癥模型時,呈現一定的濃度依賴性。AEE可顯著減少IL-1β、TNF-α和IL-6細胞因子的表達與分泌,緩解炎癥反應,且AEE的治療效果要顯著優于其前體化合物;AEE對Caco-2細胞炎癥模型的治療作用優于預防和保護作用,具體抗炎機制有待進一步研究。

