低氧環境下菊苣酸對SD大鼠脂肪組織抗氧化能力、炎性因子及能量代謝的影響
行倩文,吳 華,劉嘉華,劉 波,張龍飛,陳鑫磊,王文勝
(青海大學 農牧學院,青海 西寧 810016)
氧氣為動物機體所必需的物質,參與ATP合成,為維持動物機體正常生命活動及新陳代謝過程提供能量[1]。低氧適應是動物機體克服低氧,在低氧適應環境中最大程度的從體內和外界的環境中充分攝取并能夠充分利用低氧環境空氣中的水分和氧氣,保證正常的機體自然生理功能的正常進行[2]。
菊苣酸(chicoric acid,CA)是一種天然酚類化合物,在植物中的分布比較廣,主要存在于紫錐菊、菊苣等天然植物中[3],具有抗氧化及清除自由基、抗炎、提高免疫力等作用[4]。本課題組前期研究表明,CA可加強放牧牦牛對營養物質的代謝,提高低氧條件下放牧牦牛線粒體活性,增強牦牛高海拔低氧適應性[5]。吳華等[6]研究發現添加CA能對牦牛機體適應高海拔、低氧環境,提高免疫力和抵抗炎性反應具有積極作用。
低氧是臨床許多疾病共同的病理生理因素,長期慢性低氧對機體的損害是多方位的,其對機體的危害逐漸引起人們的重視。研究發現慢性低氧時機體可表現為脂肪代謝異常。然而,目前關于低氧環境下CA對SD大鼠脂肪組織抗氧化能力、炎性及能量代謝影響的研究鮮見報道。基于此,本試驗擬在低氧環境下對SD大鼠飼喂不同濃度的CA,研究CA對于SD大鼠不同部位脂肪組織抗氧化能力、炎性及能量代謝水平的影響。以期為CA作為高海拔地區治療炎癥、提高抗氧化能力和作為維持能量代謝的飼料添加劑應用于畜禽生產的開發利用提供理論基礎。
1 材料與方法
1.1 試驗材料CA提取物購自西安銳博生物科技有限公司,為黃綠色精細粉末,成分:CA含量4%,其中CA(2.0%~2.2%)+咖啡酸(1.0%~1.5%)+綠原酸(0.5%~1.0%)+紫錐菊甙(0.3%~0.5%);超氧化物歧化酶(SOD)測定試劑盒、丙二醛(MDA)測定試劑盒、谷胱甘肽過氧化物酶(GSH-Px)測定試劑盒、過氧化氫酶(CAT)測定試劑盒、超微量Ca2+-ATP酶測試盒、超微量Na+K+-ATP酶測試盒、總蛋白(TP)測定試劑盒購自南京建成生物工程研究所;大鼠白細胞介素-6(IL-6)測定試劑盒、大鼠白細胞介素-10(IL-10)測定試劑盒、大鼠腫瘤壞死因子-α(TNF-α)測定試劑盒、脂聯素(ADP)、干擾素-γ(IFN-γ)購自江蘇酶免實業有限公司。
1.2 實驗動物選取60只健康雄性SD大鼠(6~8周齡,170~220 g)購自青海喜馬拉雅動物實驗中心有限公司(動物許可證號:SCXK(陜)2018-001),試驗大鼠于青海省河南蒙古族自治縣畜牧獸醫工作站(海拔3 500 m,氧濃度13.65%[7])進行飼養。
1.3 試驗分組與處理將60只大鼠于室溫(21±2)℃、正常光照周期條件下進行飼養。將大鼠按照體質量隨機分為4組(P>0.05),每組15只。預飼2 周后,進行正式試驗。第1組為對照組,每天上午9:00灌胃0.5 mL生理鹽水,第2,3,4 組根據大鼠體質量分別灌胃0.5 mL含10,20,40 mg/kg CA的生理鹽水。4組大鼠均自由采食和飲水。連續灌胃49 d后進行試驗。
1.4 樣品采集飼養結束后,禁食24 h,每組大鼠分別隨機抽取6只,用10%水合氯醛進行腹腔麻醉。采集肝臟、皮下脂肪和附睪脂肪組織,分別放入2 mL凍存管,迅速置于液氮中,后移置-80℃保存,待測。
1.5 抗氧化能力指標、炎性因子含量及能量代謝水平指標的測定取SD大鼠肝臟、皮下脂肪和附睪脂肪組織,按每克待測組織加入9 mL生理鹽水的比例處理,然后使用超聲細胞破碎儀在冰水浴條件下制備勻漿,4℃、2 500 r/min離心10 min,取上清液分裝,4℃保存,隨后參照ELISA試劑盒說明測定抗氧化能力指標、炎性因子含量、能量代謝水平。
1.6 統計學分析經Excel初步處理數據后,采用統計軟件 SPSS 23.0 對試驗數據進行分析,試驗結果采用Duncan's法進行多重比較,GraphPad Prism 8.0軟件進行繪圖。
2 結果
2.1 低氧環境下CA對SD大鼠抗氧化能力的影響如圖1所示,肝臟組織:與對照組相比,10,20,40 mg/kg組CAT含量顯著升高(P<0.05),MDA含量極顯著降低(P<0.01),20,40 mg/kg組GSH-Px含量極顯著升高(P<0.01),SOD含量極顯著升高(P<0.01);與10 mg/kg組相比,20,40 mg/kg組GSH-Px含量極顯著升高(P<0.01),20 mg/kg組SOD含量極顯著升高(P<0.01),40 mg/kg組SOD含量顯著升高(P<0.05);與20 mg/kg組相比,40 mg/kg組CAT含量極顯著升高(P<0.01);其余各組間差異不顯著(P>0.05)。皮下脂肪組織:與對照組相比,10 mg/kg組CAT含量顯著升高(P<0.05),MDA含量顯著降低(P<0.05),20,40 mg/kg 組CAT、GSH-Px含量極顯著升高(P<0.01),MDA含量極顯著降低(P<0.01),10,20,40 mg/kg 組SOD含量極顯著升高(P<0.01);與10 mg/kg組相比,20,40 mg/kg組CAT含量顯著升高(P<0.05),GSH-Px含量極顯著升高(P<0.01),MDA含量顯著降低(P<0.05);與20 mg/kg組相比,40 mg/kg組CAT、SOD含量顯著升高(P<0.05);其余各組間差異不顯著(P>0.05)。附睪脂肪組織:與對照組相比,10,20,40 mg/kg組GSH-Px、SOD含量極顯著升高(P<0.01),10 mg/kg組MDA含量顯著降低(P<0.05),20,40 mg/kg組CAT含量極顯著升高(P<0.01),MDA含量極顯著降低(P<0.01);與10 mg/kg組相比,20,40 mg/kg 組GSH-Px、SOD含量極顯著升高(P<0.01),40 mg/kg組CAT含量極顯著升高(P<0.01),MDA含量顯著降低(P<0.05);與20 mg/kg相比,40 mg/kg組CAT含量極顯著升高(P<0.01),40 mg/kg組MDA含量顯著降低(P<0.05);其余各組間差異不顯著(P>0.05)。

不同小寫字母表示 P<0.05,不同大寫字母表示 P<0.01。下同
2.2 低氧環境下CA對SD大鼠炎性因子的影響如圖2所示,肝臟組織:與對照組相比,10,20,40 mg/kg 組IL-10含量極顯著升高(P<0.01),IFN-γ含量極顯著降低(P<0.01),20,40 mg/kg組TNF-α含量極顯著降低(P<0.01),40 mg/kg組IL-6含量極顯著降低(P<0.01);與10 mg/kg組相比,20,40 mg/kg組IL-10含量極顯著升高(P<0.01),TNF-α含量極顯著降低(P<0.01),40 mg/kg組IL-6、IFN-γ含量極顯著降低(P<0.01);與20 mg/kg 組相比,TNF-α、IL-6、IFN-γ含量極顯著降低(P<0.01);其余組間差異不顯著(P>0.05)。皮下脂肪組織:與對照組相比,10,20,40 mg/kg組IL-10含量極顯著升高(P<0.01),TNF-α、IL-6含量極顯著降低(P<0.01),10 mg/kg組IFN-γ含量顯著降低(P<0.05),20,40 mg/kg組IFN-γ含量極顯著降低(P<0.01);與10 mg/kg組相比,40 mg/kg 組IL-10含量極顯著升高(P<0.01),20,40 mg/kg組TNF-α、IL-6、IFN-γ含量極顯著降低(P<0.01);與20 mg/kg組相比,40 mg/kg組IFN-γ含量顯著降低(P<0.05);其余組間差異不顯著(P>0.05)。附睪脂肪組織:與對照組相比,10,20,40 mg/kg組IL-10含量極顯著升高(P<0.01),40 mg/kg 組TNF-α含量顯著降低(P<0.05),20,40 mg/kg組IL-6、IFN-γ含量極顯著降低(P<0.01);與10 mg/kg組相比,20 mg/kg組IFN-γ含量極顯著降低(P<0.01),40 mg/kg組TNF-α、IFN-γ含量顯著降低(P<0.05);與20 mg/kg組相比,40 mg/kg組TNF-α含量顯著降低(P<0.05);其余組間差異不顯著(P>0.05)。
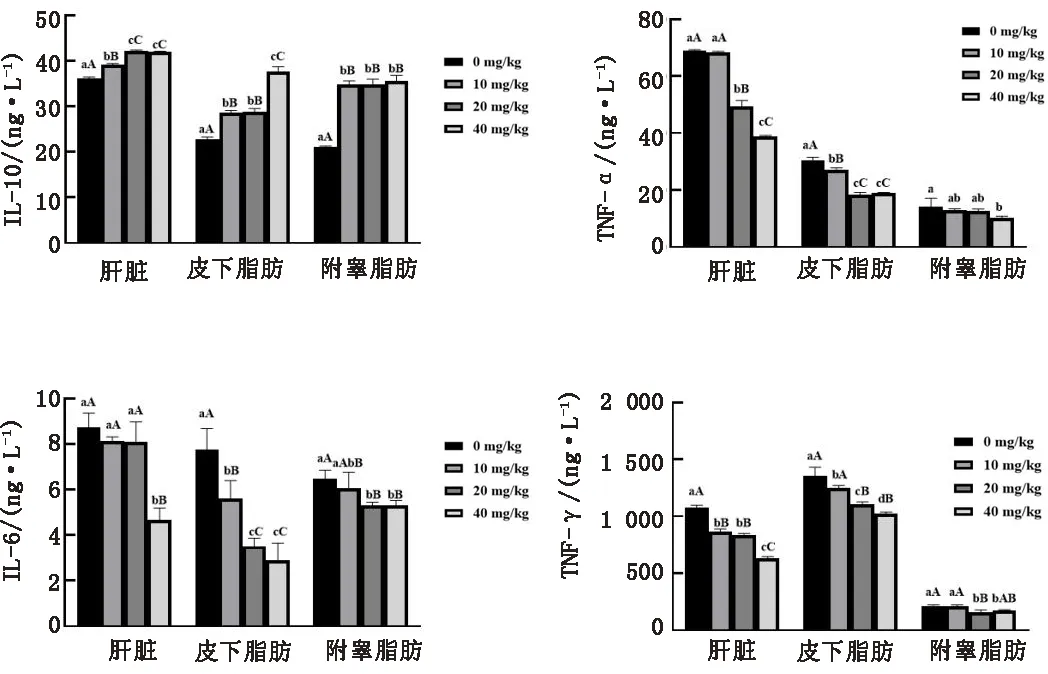
圖2 低氧環境下CA對SD大鼠炎性因子的影響
2.3 低氧環境下CA對SD大鼠能量代謝水平的影響如圖3所示,肝臟組織:與對照組相比,40 mg/kg組Ca2+-ATP酶含量極顯著升高(P<0.01),20,40 mg/kg組Na+K+-ATP酶、ADP含量極顯著升高(P<0.01);與10 mg/kg組相比,40 mg/kg組Ca2+-ATP酶含量極顯著升高(P<0.01),20,40 mg/kg 組Na+K+-ATP酶、ADP含量極顯著升高(P<0.01);與20 mg/kg組相比,40 mg/kg組Ca2+-ATP酶、ADP含量極顯著升高(P<0.01);其余組間差異不顯著(P>0.05)。皮下脂肪組織:與對照組相比,40 mg/kg組Ca2+-ATP酶含量極顯著升高(P<0.01),Na+K+-ATP酶含量顯著升高(P<0.05),10,40 mg/kg組ADP含量顯著升高(P<0.05),20 mg/kg組ADP含量極顯著升高(P<0.01);與10 mg/kg組相比,40 mg/kg組Ca2+-ATP酶含量極顯著升高(P<0.01),Na+K+-ATP酶含量顯著升高(P<0.05),20 mg/kg組ADP含量極顯著升高(P<0.01);與20 mg/kg組相比,40 mg/kg 組Ca2+-ATP酶含量極顯著升高(P<0.01),Na+K+-ATP酶含量顯著升高(P<0.05);其余組間差異不顯著(P>0.05)。附睪脂肪組織:與對照組相比,10,20,40 mg/kg組Ca2+-ATP酶含量極顯著升高(P<0.01),20,40 mg/kg組Na+K+-ATP酶、ADP含量極顯著升高(P<0.01);與10 mg/kg 組相比,20,40 mg/kg組ADP含量極顯著升高(P<0.01);其余組間差異不顯著(P>0.05)。
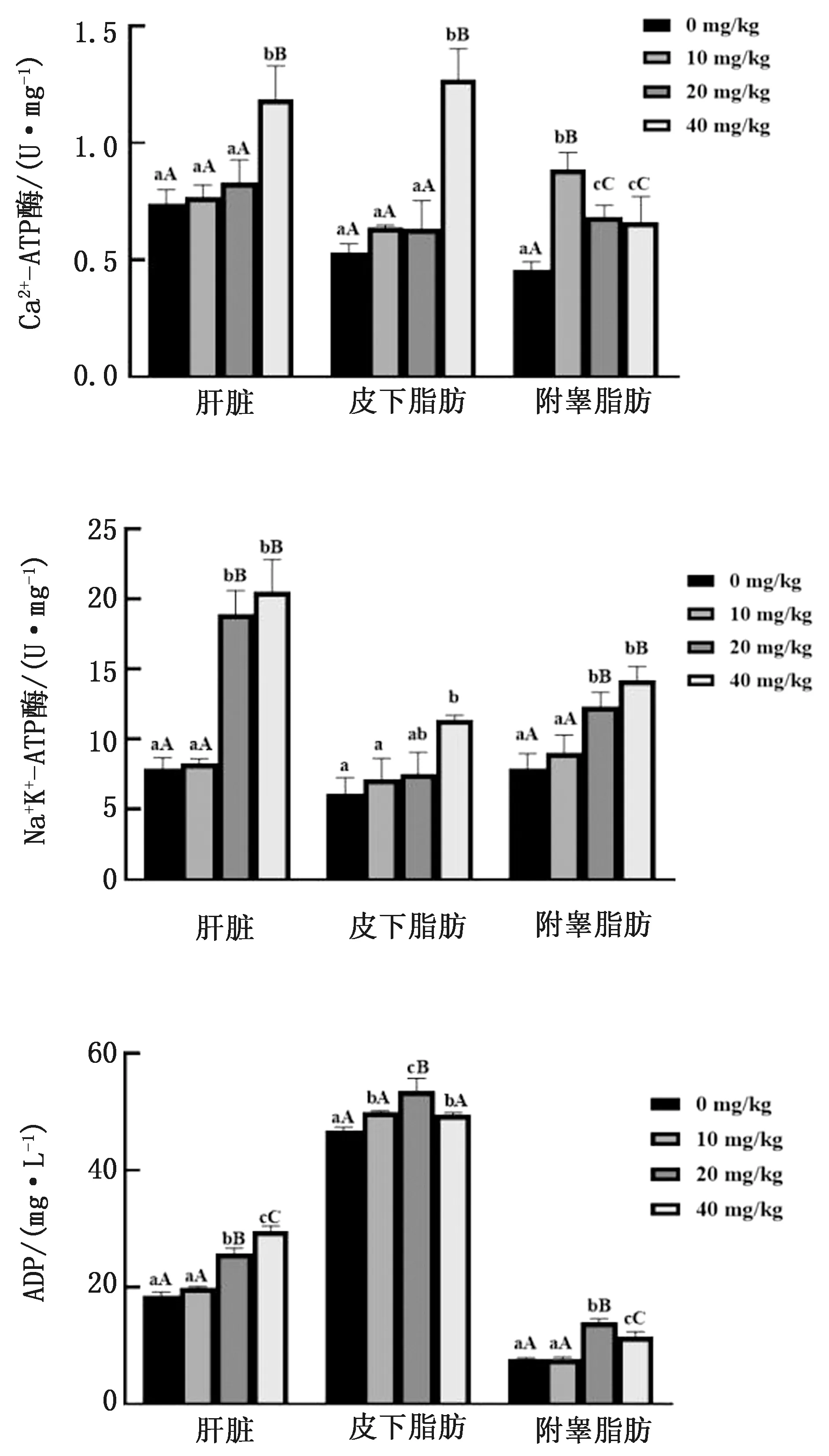
圖3 低氧環境下CA對SD大鼠能量代謝水平的影響
3 討論
氧氣作為生命之源,維持動物機體正常生命活動及新陳代謝過程,在內環境穩態中發揮著重要的作用。有研究表明海拔3 000 m以上的地區為高原低氧環境,地區氧濃度低于正常水平,對動物機體的血液、呼吸系統造成嚴重的影響,甚至引起機體組織器官損傷[8]。
3.1 低氧環境下CA對SD大鼠脂肪組織抗氧化能力的影響正常情況下,體內氧化體系與抗氧化體系維持著動態平衡,當機體在某種刺激的影響下,細胞內活性氮簇、活性氧簇等高活性分子生成增多,使抗氧化和氧化機制之間的平衡狀態被打破,導致組織損傷[9]。MDA是脂質過氧化作用的主要產物之一,能夠反映脂質過氧化作用的水平。SOD能清除超氧化自由基,防止細胞損傷,其活性可以直接反映細胞對氧自由基的清除能力,在維持組織細胞氧化和抗氧化平衡中起關鍵作用[10-11]。SOD和CAT是生物體應對氧化損傷的重要抗氧化酶,SOD將生物自身代謝或外界脅迫下產生的一系列有毒物質轉化為過氧化氫,而CAT作為過氧化氫的清除劑,可將過氧化氫還原成氧分子和水[12],從而維持細胞和機體的正常生理活動。GSH-Px特異催化GSH對H2O2的還原反應,起保護細胞膜結構和功能完整的作用[13]。本試驗結果表明,低氧環境下對SD大鼠灌喂不同濃度的CA,與對照組相比,在肝臟、皮下脂肪、附睪脂肪組織中,20,40mg/kg組CAT、SOD、GSH-Px含量均顯著升高(P<0.05),MDA含量均顯著降低(P<0.05)。不同試驗組比較,20 mg/kg組肝臟組織GSH-Px含量均顯著增加(P<0.05),MDA含量顯著降低(P<0.05),皮下脂肪組織GSH-Px含量均顯著增加(P<0.05),附睪脂肪組織SOD含量顯著增加(P<0.05),20,40 mg/kg組肝臟組織CAT、SOD含量顯著增加(P<0.05),皮下脂肪組織MDA含量顯著降低(P<0.05),附睪脂肪組織GSH-Px含量顯著增加(P<0.05),40 mg/kg皮下脂肪組織CAT、SOD含量均顯著增加(P<0.05),附睪脂肪組織CAT含量顯著增加(P<0.05),MDA含量顯著降低(P<0.05)。說明低氧環境下,CA通過清除SD大鼠脂肪組織超氧化自由基,加快過氧化氫還原成氧分子和水,降低脂質過氧化對脂肪組織的損傷,提高SD大鼠肝臟、皮下脂肪、附睪脂肪組織抗氧化能力,進而維持低氧環境下SD大鼠體內抗氧化系統動態平衡,且40 mg/kg組作用效果最好。
3.2 低氧環境下CA對SD大鼠脂肪組織炎性因子的影響低氧可以誘導機體發生炎癥反應,分泌大量炎癥因子,如促炎因子TNF-α、IL-6及抑炎因子IL-10等。其中IL-6是重要的促炎因子,其由巨噬細胞、成纖維細胞等產生[14],是介導炎癥反應的重要細胞因子,是機體發生感染的重要指標[15]。TNF-α是機體炎癥反應的起始因子,是激活細胞因子級聯反應的主要介質,一旦釋放很快引起次級因子IL-6的大量產生[16-17]。IL-10主要由輔助性T淋巴細胞(Th)2細胞產生,介導調節Th1/Th2細胞平衡[18],抑制促炎因子合成釋放,促炎因子與抑炎因子相互作用,維持體內炎性反應和免疫反應平衡[19]。IFN-γ同TNF-α是炎癥反應激活的關鍵轉錄因子[20]。低氧刺激下,IFN-γ和TNF-α可以激活細胞質中的NF-κB復合物易位至細胞核,并參與眾多促炎基因的表達[21]。本試驗結果表明,與對照組相比,在肝臟、皮下脂肪、附睪脂肪組織中,不同CA濃度組均顯著升高IL-10含量(P<0.05);20,40 mg/kg 組均顯著降低IL-6、TNF-α、IFN-γ含量(P<0.05)。不同試驗組比較,20,40 mg/kg組肝臟組織IL-10含量顯著增加(P<0.05),皮下脂肪組織TNF-α、IL-6含量顯著降低(P<0.05),附睪脂肪組織IL-6、IFN-γ含量顯著降低(P<0.05);40 mg/kg組肝臟組織TNF-α、IL-6、IFN-γ含量顯著降低(P<0.05),皮下脂肪組織IL-10含量顯著增加(P<0.05),IFN-γ含量顯著降低(P<0.05),附睪脂肪組織IL-10含量顯著增加(P<0.05),TNF-α含量顯著降低(P<0.05)。說明低氧環境下,CA通過增加SD大鼠脂肪組織抑炎因子IL-10含量,降低促炎因子TNF-α、IL-6含量和IFN-γ表達量,提高SD大鼠肝臟、皮下脂肪、附睪脂肪抗炎能力,保護SD大鼠肝臟、皮下脂肪、附睪脂肪組織因低氧而造成的炎性反應,且40 mg/kg組作用效果最好。
3.3 低氧環境下CA對SD大鼠脂肪組織能量代謝的影響脂聯素(ADP)在細胞葡萄糖和脂肪酸等能量代謝過程中發揮重要的調節作用,并參與細胞增殖肥大和免疫功能的調控[22]。其還在內分泌、代謝和炎癥信號方面起作用,并控制能量的穩態[23]。Na+-K+-ATP酶和Ca2+-ATP酶是細胞膜上重要的酶蛋白,這兩種蛋白酶基因起源相同,此外還有相似的結構功能,能主動將Ca2+、Na+運送到細胞外,攝入K+。Na+-K+-ATP酶是將細胞膜內Na+移到細胞外,同時將細胞外的K+移入膜內,從而形成2種離子的分布不平衡;Ca2+-Mg2+-ATP酶的作用是將Mg2+移入胞內,將Ca2+移到細胞外,維持內環境的相對穩定[24]。大鼠在低氧暴露環境訓練,骨骼肌線粒體產生的大量氧自由基作用于線粒體膜引起膜脂質過氧化,影響Ca2+-Mg2+-ATP酶活性,導致其活性下降[25]。也有研究表明,急性低氧應激使大鼠線粒體游離鈣濃度下降[26],并使大鼠心肌線粒體Ca2+-Mg2+-ATP酶的活力較正常大鼠顯著降低[27]。線粒體內Ca2+增加會激活線粒體脫氫酶和刺激線粒體呼吸,從而產生ATP以滿足能量的需求[28]。線粒體是細胞內重要的鈣儲存庫,線粒體膜上的ATP酶是調節和維持細胞內線粒體鈣穩態的關鍵因素。Na+-Ca2+跨膜轉運是利用Na+-K+-ATP酶產生的電化學梯度作為能源。低氧可抑制線粒體的氧化磷酸化過程,使能量代謝發生障礙,同時線粒體攝鈣能力下降,導致胞質中Ca2+濃度升高,最終引起心肌損傷[29]。線粒體內Ca2+增加會激活線粒體脫氫酶和刺激線粒體呼吸,從而產生ATP以滿足能量的需求[28]。本試驗結果表明,與對照組相比,在肝臟、皮下脂肪、附睪脂肪組織中20 mg/kg組均顯著升高ADP含量(P<0.05),40 mg/kg組均顯著升高Na+K+-ATP 酶、Ca2+-ATP酶含量(P<0.05)。不同試驗組間比較,20,40 mg/kg組肝臟組織Na+K+-ATP酶含量顯著增加(P<0.05),皮下脂肪組織ADP含量顯著增加(P<0.05),附睪脂肪組織Ca2+-ATP酶、Na+K+-ATP酶、ADP含量顯著增加(P<0.05),40 mg/kg組肝臟組織Ca2+-ATP酶、ADP含量顯著增加(P<0.05),皮下脂肪組織Ca2+-ATP酶、Na+K+-ATP酶含量顯著增加(P<0.05)。說明低氧環境下,CA通過升高ADP的含量維持SD大鼠脂肪組織內能量的穩態,升高Na+K+-ATP 酶、Ca2+ATP 酶的含量,激活線粒體脫氫酶和刺激線粒體呼吸,產生較多的ATP以滿足能量的需求,促進脂肪組織中線粒體的氧化磷酸化過程,使SD大鼠脂肪組織能量代謝恢復至正常水平,維持內環境的相對穩定。從而維持SD大鼠肝臟、皮下脂肪、附睪脂肪組織在低氧環境下的能量代謝平衡,且40 mg/kg組作用效果最好。
綜上所述,CA通過提高低氧環境下SD大鼠肝臟、皮下脂肪和附睪脂肪組織GSH-Px、CAT、SOD含量,降低MDA含量,增強其抗氧化能力,提高脂肪組織IL-10含量,降低IL-6、TNF-α、IFN-γ含量,抑制機體炎癥的發生以及升高脂肪組織Ca2+-ATP酶、Na+K+-ATP酶、ADP含量,加強其能量代謝水平,進而提高SD大鼠低氧適應能力,且以40 mg/kg組作用最佳。為CA作為高海拔地區治療炎癥、提高抗氧化能力和作為維持能量代謝的飼料添加劑應用于畜禽生產的開發利用提供理論基礎。

