羅格列酮對小鼠卵母細胞體外成熟的影響
張笑夢,金慶國*
(1.延邊大學 農學院 吉林省延邊黃牛種質資源保護工程研究中心,吉林 延吉 133002;2.延邊大學 東北寒區肉牛科技創新教育部工程研究中心,吉林 延吉 133002)
胚胎體外培養是大量生產胚胎的有效途徑之一。在胚胎體外培養過程中,培養基的營養結構、pH值、滲透壓、環境中氧氣濃度以及溫度濕度等培養條件都影響著胚胎的體外發育[1]。在哺乳動物卵母細胞成熟過程中,應激因素的存在,使卵母細胞內的氧化代謝產物增加或自身抗氧化保護機制不足,引起卵母細胞內活性氧(ROS)堆積。
在生理條件下,ROS有多種來源,包括線粒體呼吸鏈(主要來源)、NADPH 氧化酶、黃嘌呤氧化酶、脂氧合酶、一氧化氮合酶和環氧合酶[2]。由于ROS的強氧化性,過度堆積時會攻擊卵母細胞的生物大分子物質,如核酸、蛋白質、脂質等[3]。大量研究表明,ROS的堆積會導致細胞內穩態破壞[4],影響線粒體功能[5]、誘導卵母細胞凋亡,影響紡錘體正常組合從而影響卵母細胞減數分裂,進而影響卵母細胞的體外成熟。卵母細胞的體外成熟是體外胚胎生產的關鍵,卵母細胞的成熟發育能力對后續的受精率、分裂率以及囊胚率都有直接影響[6]。
為了提高體外胚胎生產效率,抗氧化劑已廣泛應用到卵母細胞體外成熟中。羅格列酮(RSG)為過氧化物酶體增殖物激活受體γ(PPARγ)的強效激動劑。PPAR是配體激活型轉錄因子,它們能與視黃醇X受體形成異二聚體(RXRs),從而調節各種基因轉錄[7]。有研究表明,RSG可以提高心肌細胞中超氧化物歧化酶(SOD)的表達水平,抑制心肌細胞的凋亡[8]。楊蕓瑞等[9]研究發現,RSG可以提高糖尿病大鼠血清中SOD和谷胱甘肽(GSH)的活性,顯著降低氧化應激造成的損傷。RSG在肺臟組織中表現出了抗炎抗氧化的特性[10]。雖然RSG已在許多領域獲得了廣泛關注,但在動物生殖領域,特別是在雌性配子發育過程中的作用鮮有報道。本試驗通過在M16成熟培養基中添加RSG,來探究RSG對小鼠卵母細胞體外成熟質量的影響。
1 材料與方法
1.1 實驗動物4~6周齡體質量約28 g昆明小鼠,購自延邊大學動物實驗中心。
1.2 主要試劑及儀器孕馬血清促性腺激素(PMSG)和人絨毛膜促性腺激素(hCG)(寧波第二激素廠);M2培養液和M16培養液(南京愛貝生物公司);RSG(Selleck,BRL 49653);體視顯微鏡(OLYMPUS公司);CO2培養箱(賽默飛世爾科技公司);熒光顯微鏡(Nikon公司)。
1.3 卵母細胞的采集4~6周齡昆明小鼠腹腔注射10 IU的PMSG,48 h后采用頸部脫臼法處死小鼠,摘取卵巢,放入預平衡過的M2小滴中,在體視顯微鏡下用注射器劃開卵泡,使卵丘-卵母細胞復合物流出,收集卵丘細胞包裹完好的卵母細胞。
1.4 卵母細胞的培養將收集的卵母細胞放入預平衡的M16成熟培養基中,對照組和試驗組(RSG組)分別用0,20 μmol/L[11]RSG的M16成熟培養液清洗4次,于38.5℃、5% CO2飽和濕度環境中培養12 h。
1.5 卵母細胞內ROS水平檢測用0.1 mol/L PBS按1∶1 000稀釋DCFH-DA(南京建成E004-1-1),DCFH-DA工作濃度為10 μmol/L。小鼠卵母細胞經1% BSA的PBS清洗4次后放入10 μmol/L的DCFH-DA中,38.5℃避光培養。15 min后取出卵母細胞,經1% BSA的PBS清洗4次后,置于倒置熒光顯微鏡下成像,使用Image J軟件對熒光圖像進行分析。
1.6 卵母細胞內GSH水平檢測用0.1 mol/L PBS按1∶1 000稀釋CMF2HC,CMF2HC工作濃度為10 μmol/L。小鼠卵母細胞經1% BSA的PBS清洗4次后,放入10 μmol/L的CMF2HC中,38.5℃ 避光培養。15 min后取出卵母細胞,經1% BSA的PBS清洗4次后,置于倒置熒光顯微鏡下成像,使用Image J軟件對熒光圖像進行分析。
1.7 卵母細胞內線粒體功能的檢測用0.1 mol/L PBS按1∶1 000稀釋JC-1,將小鼠卵母細胞經1% BSA的PBS清洗4次,放入稀釋的JC-1中,38.5℃培養20 min,取出后用1% BSA的PBS清洗4次,置于倒置熒光顯微鏡下成像,使用Image J軟件對熒光圖像進行分析,紅色熒光和綠色熒光的比值高低代表線粒體功能強度。
1.8 實時熒光定量qRT-PCR每組收集20個成熟卵母細胞,使用DynaBeads mRNA Direct Kit試劑盒(Dynal Asa,挪威)提取其mRNA,逆轉錄合成cDNA。實時熒光定量PCR反應體系(20 μL):cDNA 2 μL,SYBR mix 10 μL,引物0.8 μL,ROX Low 0.4 μL,ddH2O 6.8 μL。采用KAPA SYBR?FAST熒光定量試劑盒(Kapa Biossystem,南非)。qRT-PCR反應程序:95℃ 3 s,60℃ 20 s,72℃ 1 s。用2-ΔΔCt法對qRT-PCR結果進行分析。

表1 實時熒光定量PCR引物序列
2 結果
2.1 RSG對小鼠卵母細胞第一極體排出率的影響由表2可知,與對照組相比,20 μmol/L RSG處理組的卵母細胞第一極體排出率顯著高于對照組(P<0.05)。

表2 RSG對小鼠卵母細胞第一極體排出率的影響
2.2 RSG對小鼠卵母細胞ROS水平的影響由圖1可知,20 μmol/L RSG處理組的卵母細胞ROS水平顯著低于對照組(P<0.05)。

A.ROS熒光染色圖;B.ROS柱狀分析圖。相同字母表示差異不顯著(P>0.05),不同字母表示差異顯著(P<0.05)。下同
2.3 RSG對小鼠卵母細胞GSH水平的影響由圖2可知,20 μmol/L RSG處理組的卵母細胞GSH水平顯著高于對照組(P<0.05)。

A.GSH熒光染色圖;B.GSH柱狀分析圖
2.4 RSG對小鼠卵母細胞線粒體功能的影響由圖3可知,使用20 μmol/L RSG處理小鼠卵母細胞可顯著提高線粒體膜電位水平(P<0.05),提高線粒體功能。
2.5 RSG對小鼠卵母細胞氧化應激相關基因表達的影響由圖4可知,與對照組相比,添加20 μmol/L RSG處理小鼠卵母細胞中抗氧化相關基因GPX-3、CAT和SOD-2的mRNA表達水平顯著提高(P<0.05)。
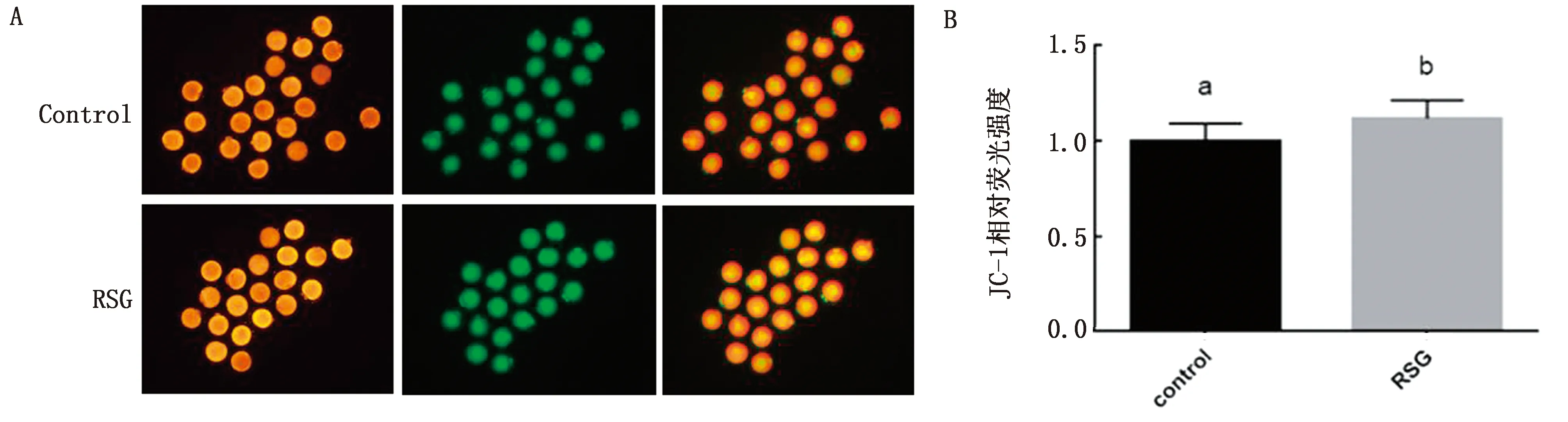
A.JC-1熒光染色圖;B.JC-1柱狀分析圖

圖4 RSG對小鼠卵母細胞氧化應激相關基因表達的影響
3 討 論
本試驗向M16培養基中加入20 μmol/L的RSG,通過計算小鼠卵母細胞成熟率,檢測小鼠成熟卵母細胞ROS、GSH水平、線粒體功能及抗氧化相關基因的表達來探究RSG對小鼠卵母細胞體外成熟的影響。結果表明,RSG顯著降低了卵母細胞內ROS水平,提高了谷胱甘肽酶的活性,改善了線粒體功能,抗氧化相關基因表達相對提高,進而提高了卵母細胞成熟率。
由于暴露于氧化環境和卵母細胞從卵泡保護性抗氧化環境中被分離,卵母細胞內產生的ROS不能被及時中和,使得卵母細胞發育能力遭到破壞造成氧化應激[12]。有研究表明, PPARγ的噻唑烷二酮類藥物表現出抗氧化性和抑制細胞凋亡的活性[13]。本試驗中,在體外成熟過程中添加RSG后,卵母細胞中ROS的含量明顯降低,說明RSG可以有效清除卵母細胞中的ROS。GSH 是一種直接抗氧化劑和幾種抗氧化酶的底物[14]。GSH通過谷氨酸半胱氨酸連接酶和谷胱甘肽合成酶催化的雙酶反應合成,因其本身含有巰基極易被氧化,所以具有清除自由基以及保護蛋白質和酶等生物大分子巰基的功能,因此GSH水平的高低反映了細胞的還原能力[15]。在本試驗中,RSG組相較于對照組,GSH的水平顯著提高,這與EL-NAA等[16]的研究結果一致。有研究表明,RSG可以通過促進PPARγ的轉錄活性,上調CAT和SOD的表達,從而起到抗氧化作用[17],這與本試驗結果一致。因此,RSG可以通過調節氧化還原平衡,減少氧化應激造成的損傷。
細胞內的生命活動都離不開線粒體提供能量,因此線粒體功能也是衡量卵母細胞質量的重要指標[18]。線粒體功能障礙會導致卵母細胞質量下降并干擾胚胎發育[19]。在卵母細胞成熟過程中,線粒體功能影響著卵母細胞第一極體排出率以及影響卵母細胞成熟后mtDNA的拷貝數,mtDNA拷貝數對后續的受精和早期胚胎的發育具有重大影響[20]。在本試驗中,添加RSG可以提高線粒體膜電位,改善線粒體功能,這與DUNNING等[11]的研究結果一致。
綜上所述,在小鼠卵母細胞成熟培養基中添加RSG可以降低卵母細胞內ROS水平,提高GSH水平,改善線粒體功能,提高抗氧化相關基因的表達,提高小鼠卵母細胞成熟率,從而提高了小鼠卵母細胞的質量。

