黃芪丹參提取物改善急性呼吸窘迫綜合征大鼠肺損傷的作用和機制研究?
沈楨巍,石 怡,吳珊珊,李佳敏,陳 偉△
(1.上海中醫藥大學,上海 201203;2.上海太平康復醫院,上海 201315;3.上海中醫藥大學附屬龍華醫院,上海 200032)
急性肺損傷(acute lung injury,ALI)是一種因異物或者病原體入侵而導致的以肺水腫為主要特征的臨床綜合征,發病多為非心源性因素導致,其典型的病理特征為進行性低氧血癥并伴隨呼吸窘迫(氧合指數<300 mmHg)。ALI快速進展可導致急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)和患者死亡事件[1,2]。根據2012年歐洲危重癥協會主持修訂的ARDS診斷標準,臨床上依據患者氧合狀況將ARDS分成輕、中和重度3級。由于ARDS多發于中老年或體弱者群體,近年來病例數量的上升給我國醫療資源帶來了極為沉重的負擔。隨著經濟發展和醫療手段的革新,現階段對ARDS的臨床診療也有了極大的進步和改善。但由于ARDS致病因素較為復雜,易被感染、創傷、中毒和(或)理化吸入等多種條件誘發,故其臨床診療仍是危重癥醫學所要應對和解決的難題[3,4]。截至目前,雖然已有眾多關于ARDS發病機理的解釋,但普遍認為ARDS是機體炎癥反應的結果。相關研究表明,病原體入侵導致的炎癥反應以及肺部中性粒細胞異常且持續性活化與ARDS患者肺組織損傷之間可能存在某種關聯[5,6]。在ARDS進展中,患者肺部會呈現一個局部缺氧的環境,低氧條件下中性粒細胞數量會增加,而中性粒細胞的活化又會加劇炎癥因子釋放和炎癥介質的形成,因此中性粒細胞在病理條件下的活化與ARDS患者肺部病變的嚴重程度可能具有正向關聯性[7]。白細胞介素(interleukin,IL)4與其受體IL-4Rα組成的IL-4/IL-4Rα調控通路一直被認為是中性粒細胞炎癥活化的重要途徑[8]。而黃芪丹參藥對已被證實對于各類缺血再灌注導致的心肌、腦組織損傷均具有良好的改善作用,其藥效發揮主要基于其抗炎活性[9]。本研究對黃芪和丹參提取物在ARDS大鼠肺損傷中的作用進行評價并初步闡明其作用機制。
1 材料
1.1 動物
40只8周齡健康SD大鼠,體質量180~200 g,購于蘇州西山科技有限公司,動物許可證號:SYXK(滬)2017-0003,分籠飼養于海軍軍醫大學動物實驗中心SPF級、恒溫恒濕環境中,溫度為20~24 ℃,相對濕度在(50±0.5)%,實驗期間所有大鼠均自由飲水和標準喂食。所有實驗操作嚴格遵守衛生部及海軍軍醫大學動物實驗管理條例,倫理學批件編號:2020LCSY065。
1.2 主要藥物、試劑與儀器
黃芪丹參提取物由海軍軍醫大學藥理教研室提取完成,其中測得黃芪總皂苷含量68.5%,丹參總酚酸含量62.8%。黃芪丹參提取物使用無菌磷酸鹽緩沖液配制為1 mg/mL保存母液,黃芪總皂苷與丹參總酚酸的配比為2:5,-20℃條件下保存。
細胞及組織蛋白提取定量試劑盒(貨號:785012,78510),化學底物發光試劑盒(貨號:32109),腫瘤壞死因子(tumor necrosing factor,TNF)-α、IL-1β和IL-6含量檢測試劑盒(貨號:ERA56RB, BMS630,KMC0061),RPMI1640細胞培養基(貨號:12633012),胎牛血清(貨號:10099141),熒光定量檢測試劑盒(貨號:A25742)和RNA提取試劑(貨號:15596018)均購于于美國賽默飛公司;蛋白IL-4Rα,半胱氨酸蛋白酶3水解體(Caspase 3-cleaved)與β肌動蛋白(β-actin)一抗(貨號:sc-28361、sc-373730、sc-8432)購于Santacruz公司;羊抗兔二級抗體(貨號:ab6721),髓過氧化物酶(myeloperoxidase,MPO)活性檢測試劑盒(貨號:ab105136)、細胞凋亡檢測試劑盒(貨號:ab14082)均購于英國艾博抗公司;細菌脂多糖(lipopolysaccharide,LPS)(貨號:L2630)和油酸(貨號:O1383)為sigma公司產品;中性粒細胞分離液(貨號:17-0891-01)購于聯碩生物;RNA反轉錄試劑盒(貨號:FSQ-201)為日本TOYOBO公司產品。PCR引物合成由上海生工生物工程有限公司完成。
Varioskan LUX型酶標儀、Attune CytPix型流式細胞儀為美國賽默飛公司產品,DMi1型倒置顯微鏡為德國徠卡公司產品,CW-SAR-830型小型動物呼吸機為美國CWE公司產品,C7型熒光定量PCR儀為北京同洲維普科技有限公司產品。
2 方法
2.1 給藥及ARDS造模
大鼠適應性喂養1周后隨機分為5組(n=8)。假手術組:不做處理但通過尾靜脈注射給予造模試劑等體積的磷酸鹽緩沖液(phosphate buffer saline,PBS);ARDS模型組:通過油酸與LPS誘導法建立ARDS模型;黃芪和丹參提取物(低劑量)治療組:10 mg/(kg·d)每天灌胃1次,連續給藥3 d后,ARDS造模;黃芪和丹參提取物(高劑量)治療組:30 mg/(kg·d)每天灌胃1次,連續給藥3 d,后ARDS造模;IL-4Rα沉默且黃芪和丹參提取物(高劑量)治療組:給藥前24 h通過鼻腔滴加50 μL重組慢病毒Lv-shRNA-IL-4Rα,再予黃芪和丹參提取物高劑量給藥和ARDS造模。ARDS模型建立參照Wei Y等[1]大鼠ADRS模型制備方案,即SD大鼠經尾靜脈注射0.05 mL/kg油酸,過30 min后再次尾靜脈注射2.5 mg/kg的LPS構建ARDS模型。
2.2 標本獲取
動物標本獲取之前先進行大體觀察:監測指標包括大鼠飲食、精神、毛發、應激特征以及步態等外表是否異常,鼠尾是否發紺,呼吸是否困難等。在ARDS造模后6 h,通過異氟烷吸入法麻醉實驗大鼠,腹主動脈采血,完整摘除肺組織,去除肺門大血管,在近氣管分叉處結扎右主支氣管,右肺后葉組織用于肺濕干重比計算,其余右肺組織于液氮中保存。將去尖的注射器針頭進入左主支氣管,緩慢注入3 mL無菌PBS進行左肺灌洗,約30 s后緩慢、均勻回收PBS洗液。操作共進行3次,肺泡灌洗液(bronchoalveolar lavage fluid,BALF)回收率一般要求大于80%。BALF回收完成后,摘取左肺并在肺內注入4%多聚甲醛溶液,再整體轉移至10%福爾馬林溶液中固定,進行石蠟包埋和組織切片,用于病理染色。
2.3 肺組織濕干重比檢測
剪取大鼠右肺后葉組織,吸水紙清理后,立即轉移至鋁箔紙,電子天平稱重,真空干燥箱55 ℃烘烤72 h,稱取組織干重,并計算各組動物的肺濕干重比。
2.4 BALF樣本來源中性粒細胞制備及免疫印跡檢測
向15 mL無菌離心管中加入3 mL中性粒細胞分離液,再放入3 mL BALF,室溫2000×g離心20 min,后溶液出現4層,從上到下依次為:單核細胞層、分離液、中性粒細胞、其余的分離液及其他細胞沉淀。小心吸取自上而下第3層細胞至干凈的2 mL離心管,加入1.5 mL的Hank’s緩沖液,離心后丟棄上清液,保留沉淀。重復2次即獲得中性粒細胞。提取細胞總蛋白后用于IL-4Rα及Caspase 3-cleaved蛋白表達檢測,免疫印跡檢測使用濃度為10%的分離膠,兔抗鼠一抗使用稀釋比例依次為IL-4Rα,1:500、Caspase 3-cleaved,1:300和β-actin,1:1000。羊抗兔二抗使用稀釋比例為1:3000。蛋白相對表達量為目標條帶與內參β-actin蛋白的光密度比值。
2.5 肺組織病理學檢測及肺損傷評分
肺組織病理切片及HE染色按照常規方案進行。染色完成后將切片置于120×放大倍數光鏡下隨機選取5個視野,參照肺損傷評分標準(表1)進行評分。對肺泡間隔厚度、肺泡出血情況、肺泡腔或血管壁炎癥細胞浸潤程度、肺泡內纖維蛋白沉積4項指標,分別依據病變輕重評為0~3分,總分12分。4項評定分數根據相關權重相加所得總分即為肺損傷評分,最后取5個視野肺損傷評分的平均值為最終得分。

表1 肺損傷的組織病理學評分表
肺損傷評分=[平均每視野肺泡間隔增厚點數+平均每視野肺泡出血點數+2×(平均每視野肺泡內炎癥細胞浸潤點數)+3×(平均每視野肺泡內纖維蛋白沉積點數)]/肺泡總數。
2.6 BALF來源中性粒細胞凋亡檢測
將制備好的中性粒細胞重懸于細胞凋亡試劑盒自帶的細胞重懸緩沖液,震蕩充分混勻后即加入5 μL的Annexin-V/FITC和10 μL體積的碘化丙啶染液,充分混勻后轉移至避光處靜置15 min,流式細胞儀檢測細胞凋亡率。
2.7 BALF炎癥因子及肺組織中MPO含量檢測
BALF中炎癥因子TNF-α,IL-1β和IL-6含量,大鼠肺組織中MPO活性檢測,均通過即酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)進行檢測,檢測步驟及方法嚴格參照ELISA試劑盒說明書進行。
2.8 肺組織中趨化因子mRNA檢測
取液氮保存的大鼠肺組織約100 mg,Trizol法提取總RNA,反轉錄制備cDNA進行熒光定量PCR檢測。PCR反應體系和條件參數設置參照熒光定量檢測試劑盒說明書。CCL2上游引物:5’-GTCGGCTGGAGAACTAC-3’,CCL2下游引物:5’-CTTATTGGGGTCAGCACAGA-3’;CCL3上游引物:5’-CCCGACTGCCTGCTGCTTCT-3’,CCL3下游引物:5’-GATCTGCCGGTTTCTCTTGGTCA-3’;CCL17上游引物:5’-ACCAATGTAGGCCGAGAGTGC-3’,CCL17下游引物:5’-GGCCCCCTTGAAGTAGTCCA-3’;β-actin上游引物:5’-GGCCGGGACCTGACAGACTACCTC-3’,β-actin下游引物:5’-GTCACGCACGATTTCCCTCTCAGC-3’。數據分析以β-actin為內參,通過2-ΔCt法計算目標基因表達相對值。
2.9 統計學方法
使用SPSS25.0軟件對實驗數據進行組間差異分析,數據用均數±標準差表示,GraphPad Prism 7.0作圖,兩兩比較釆用獨立樣本t檢驗。以P<0.05表示差異有統計學意義。
3 結果
3.1 肺組織濕干重比測定及肺組織病理學觀察及肺損傷評分
與假手術組比較,ARDS模型組大鼠肺組織濕干重比明顯增加(P<0.01),而黃芪丹參提取物給藥能夠以劑量依賴的方式明顯降低ARDS大鼠肺組織濕干重比(P<0.05)。結果還表明,IL-4Rα沉默能夠明顯逆轉藥物的上述作用,即Lv-shRNA-4Rα感染且黃芪丹參提取物給藥的ARDS大鼠肺組織濕干重比明顯高于高劑量藥物處理組(P<0.05),見圖1A。HE染色結果表明,與假手術組比較,ARDS模型組大鼠肺泡上皮明顯腫脹,毛細血管擴張充血,肺泡腔體內可見大量介質滲出和大量炎性浸潤,肺泡間質呈現明顯增生狀,肺組織損傷評分明顯升高(P<0.01),而黃芪丹參提取物處理組大鼠肺組織的上述病變有所減輕,且藥物作用呈現劑量依賴性,其中高劑量治療組與ARDS模型組比較,差異有統計學意義(P<0.01)。結果還表明,Lv-shRNA-IL-4Rα感染能夠明顯逆轉藥物的上述作用,即IL-4Rα沉默且黃芪丹參提取物給藥的ARDS大鼠肺組織損傷評分明顯高于高劑量藥物處理組(P<0.01),見圖1B、C。

注:**與Sham組比較P<0.01;#與ARDS組比較P<0.05,##與ARDS組比較P<0.01;^與CASE-H+ARDS組比較P<0.05,^^與CASE-H+ARDS組比較P<0.01。Sham:假手術組;ARDS:模型組;CASE-L+ARDS:黃芪丹參提取物低劑量治療組;CASE-H+ARDS:黃芪丹參提取物高劑量治療組;IL-4Rα-RNAi+CASE-H+ARDS:IL-4Rα基因沉默且黃芪丹參提取物高劑量治療組。A.大鼠肺濕干重比分析(n=8);B.肺組織HE染色(×120放大倍數);C.肺組織損傷評分(n=8)
3.2 中性粒細胞凋亡率檢測結果
ARDS模型組大鼠BALF來源中性粒細胞凋亡率稍低于假手術組,但差異無統計學意義(P>0.05),而黃芪丹參提取物處理組大鼠BALF來源中性粒細胞凋亡率與模型組比較明顯上調,且呈劑量依賴性(P<0.01)。Lv-shRNA-IL-4Rα感染能夠明顯逆轉藥物的上述作用,即與高劑量治療組比較,IL-4Rα沉默且黃芪丹參提取物處理組ARDS大鼠BALF來源中性粒細胞凋亡率再次降低(P<0.01),見圖2。

注:細胞凋亡率表示為前期凋亡和后期調亡率之和;**與Sham組比較P<0.01;^^與CASE-H+ARDS組比較P<0.01。Sham:假手術組;ARDS:模型組;CASE-L+ARDS:黃芪丹參提取物低劑量治療組;CASE-H+ARDS:黃芪丹參提取物高劑量治療組;IL-4Rα-RNAi+CASE-H+ARDS:IL-4Rα基因沉默且黃芪丹參提取物高劑量治療組。
3.3 BALF炎癥因子及肺組織中MPO含量檢測結果
ELISA檢測結果表明,與假手術組比較,ARDS模型組大鼠BALF中炎癥因子TNF-α,IL-1β和IL-6含量明顯上升(P<0.01)。與模型組比較,黃芪丹參提取物給藥的ARDS大鼠BALF中炎癥因子TNF-α,IL-1β和IL-6含量明顯降低,且呈劑量依賴性,其中高劑量治療組與ARDS模型組比較,差異有統計學意義(P<0.01)。結果還表明,Lv-shRNA-IL-4Rα感染能夠明顯逆轉藥物的上述作用,即IL-4Rα沉默且黃芪丹參提取物給藥的ARDS大鼠BALF炎癥因子含量再次上調,且明顯高于高劑量藥物處理組(P<0.05)。MPO活性檢測數據表明,MPO在各組動物肺組織中含量與BALF炎癥因子變化趨勢完全一致,見圖3。

注:**與Sham組比較P<0.01;##與ARDS組比較P<0.01;^與CASE-H+ARDS組比較P<0.05,^^與CASE-H+ARDS組比較P<0.01。Sham:假手術組;ARDS:模型組;CASE-L+ARDS:黃芪丹參提取物低劑量治療組;CASE-H+ARDS:黃芪丹參提取物高劑量治療組;IL-4Rα-RNAi+ CASE-H+ARDS:IL-4Rα基因沉默且黃芪丹參提取物高劑量治療組。A.TNF-α;B.IL-1β;C.IL-6;D.MPO
3.4 BALF來源中性粒細胞中IL-4Rα與Caspase-3cleaved蛋白表達檢測結果
免疫印跡檢測結果表明,與假手術組比較,ARDS模型組大鼠BALF來源中性粒細胞中IL-4Rα表達明顯減弱(P<0.01),而黃芪丹參提取物給藥組大鼠BALF來源中性粒細胞中IL-4Rα表達明顯升高,且呈劑量依賴性,其中高劑量組與ARDS模型組比較,差異均具有統計學意義(P<0.01)。Lv-shRNA-IL-4Rα感染能夠明顯逆轉藥物的上述作用,即IL-4Rα沉默且黃芪丹參提取物給藥組ARDS大鼠BALF來源中性粒細胞IL-4Rα表達再次下調,且明顯低于高劑量藥物處理組(P<0.05)。檢測結果還表明,Caspase3-cleaved表達變化趨勢與IL-4Rα完全一致,見圖4。

注:**與Sham組比較P<0.01;##與ARDS組比較P<0.01;^^與CASE-L+ARDS組比較P<0.01;&&與CASE-H+ARDS組比較P<0.01。Sham:假手術組;ARDS:模型組;CASE-L+ARDS:黃芪丹參提取物低劑量治療組;CASE-H+ARDS:黃芪丹參提取物高劑量治療組;IL-4Rα-RNAi+ CASE-H+ARDS:IL-4Rα基因沉默且黃芪丹參提取物高劑量治療組。A.IL-4Rα;B.Caspase 3-cleaved;C.免疫印跡檢測目的條帶
3.5 肺組織中趨化因子含量檢測結果
熒光定量PCR檢測表明,與假手術組比較,ARDS模型組大鼠肺組織中趨化因子CCL2,CCL3和CCL17 mRNA表達量顯著上升(P<0.01),而黃芪丹參提取物給藥組ARDS大鼠肺組織中CCL2,CCL3和CCL17 mRNA表達量明顯降低,且呈劑量依賴性,其中高劑量組與ARDS模型組比較,差異具有統計學意義(P<0.05)。Lv-shRNA-IL-4Rα感染能夠明顯逆轉藥物的上述作用,即IL-4Rα沉默且黃芪丹參提取物給藥組ARDS大鼠肺組織中CCL2,CCL3和CCL17 mRNA表達量再次上調,且明顯高于高劑量藥物處理組(P<0.05),見圖5。
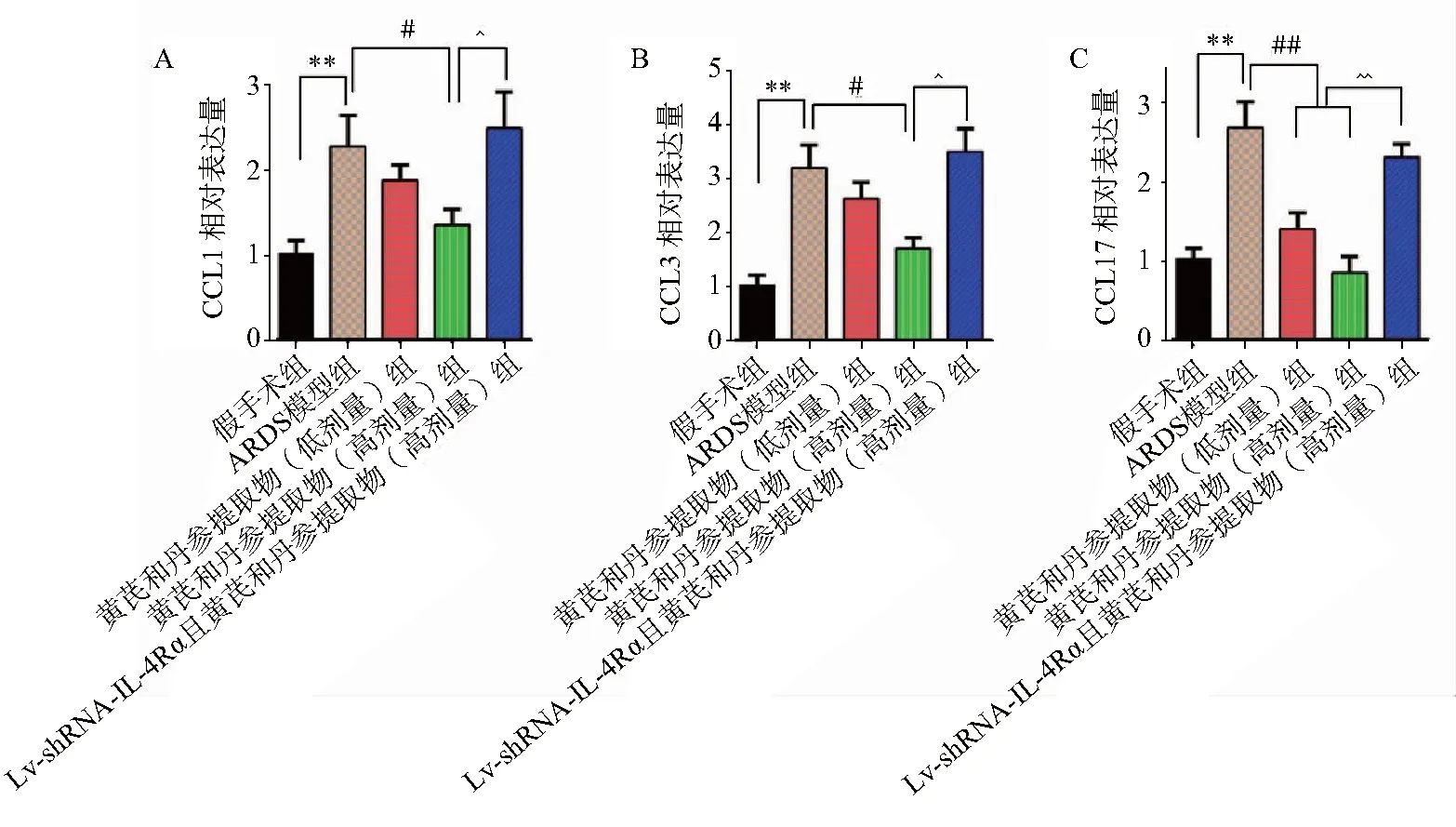
注:**與Sham組比較P<0.01;#與ARDS組比較P<0.05,##與ARDS組比較P<0.01;^與CASE-H+ARDS組比較P<0.05,^^與CASE-H+ARDS組比較P<0.01。Sham:假手術組;ARDS:模型組;CASE-L+ARDS:黃芪丹參提取物低劑量治療組;CASE-H+ARDS:黃芪丹參提取物高劑量治療組;IL-4Rα-RNAi+ CASE-H+ARDS:IL-4Rα基因沉默且黃芪丹參提取物高劑量治療組。A.CCL2;B.CCL3;C.CCL17
4 討論
中性粒細胞活化在ARDS導致肺損傷進展過程中起到關鍵作用[10],ARDS患者外周血中的中性粒細胞會被招募至肺部病變組織,并在低氧條件下活化,釋放炎癥因子和介質,進一步導致肺組織損傷及纖維化病變[11]。現有研究均表明中性粒細胞有潛力成為ARDS治療的靶標細胞[12],積極摸索開發和完善以中性粒細胞功能調控為核心的ARDS治療方案,對于改善ARDS所致肺損傷無疑具有重大意義,其核心內容即為在ARDS發生初期,通過阻斷中性粒細胞遷移以防止肺部炎性反應進展[13-16]。中性粒細胞在ARDS肺損傷中的相關作用雖已被研究多年[10-12],但其具體作用和機制仍未完全闡明而有待進一步深入探究。近年來,IL-4在炎癥調控中的作用被廣泛研究和證實。中性粒細胞在嚴重缺氧條件下能夠被活化,具體表現為生存能力獲得明顯的提升以及能夠促進炎癥因子大量釋放。有研究表明IL-4在ARDS小鼠肺組織中表達降低,通過添加外源IL-4無論在體內亦或是體外均能有效降低ARDS病理條件下中性粒細胞生存率[7]。IL-4能夠以脯氨酰羥化酶-2依賴性的方式降低人和小鼠中性粒細胞在體外缺氧模型中的細胞活性及存活率[8]。這一研究結論與IL-4長期以來被認為具有組織修復、平衡等基本功能是一致的[17]。Alison J等[8]研究表明,急性肺損傷時IL-4/IL-4Rα途徑被激活,通過抑制低氧條件下缺氧誘導因子(hypoxia-inducible factor,HIF)1α的表達,促進ARDS病理條件下中性粒細胞的凋亡,并最終抑制病變部位炎癥因子含量和促進炎性反應消退。動物研究數據表明,LPS誘導會導致動物肺部內源性IL-4被大量釋放,并促進中性粒細胞中IL-4Rα表達上調,這說明可能在炎癥反應早期即存在IL-4/IL-4Rα調控通路[18,19]。以上均提示通過IL-4/IL-4Rα通路活化,降低ARDS病理條件下中性粒細胞存活率,或為限制ARDS進展初期劇烈炎性反應出現的有效途徑。
ARDS屬于中醫“喘證”“喘脫”“暴喘證”范疇。中醫認為喘為氣虧不足以息所致,而《靈樞》曰:“宗氣不下,脈中之血,凝而留止”[20]、《醫林改錯》又曰:“元氣既虛,必不能達于血管,血管無氣,必停留而瘀”,說明肺氣虧虛,宣發肅降失司,肺氣上逆或氣無所主致喘,而肺氣不行則血脈不利,血停致瘀,故臨床可選用補氣活血之法治療ARDS。相關研究顯示補氣活血法代表方藥補陽還五湯可通過改善病理、抑制炎癥因子及膠原蛋白、調控高遷移率族蛋白(high mobility group protein,HMG)B1信號通路、抑制細胞外調節蛋白激酶(extracellular regulatory protein kinases,ERK)1/2信號通路等途徑以多機制、多通道、多靶點發揮抗肺纖維化作用[21]。而本研究選取了補氣活血經典藥對黃芪、丹參提取物作為研究靶點,其中黃芪作為補氣諸藥之最,能夠益元氣而補三焦,丹參有“一味丹參,功同四物湯”之效,可活血祛瘀生新,二者相配能補氣活血,補而不滯。現代藥理學研究表明,黃芪具有調節免疫、抑制炎癥反應、抗氧化、抗感染等作用,而丹參能夠改善微循環、抗血小板聚集、擴張血管、抗氧化應激、抑制炎癥反應[21]。王麗娜等[22]研究發現黃芪-丹參藥對可有效抑制小鼠肺泡炎癥和控制肺纖維化進展,其作用機制可能與抑制TNF-α、人磷酸化κB抑制蛋白激酶(human phosphorylatedκB inhibitory protein kinase,P-IKK)、核因子κB(nuclear factor kappa-B,NF-κB)、IL-1β等表達有關。丹參有效成分丹參酮可顯著減輕博萊霉素所致的大鼠肺泡炎和肺纖維化程度,其機制可能與抑制炎癥反應細胞的浸潤活化、細胞外基質沉積及調控尿激酶型纖溶酶原激活物及其抑制物之間的平衡有關[23]。
在本研究中,首先對大鼠進行黃芪丹參提取物灌胃給藥,采用油酸與LPS打擊建立大鼠ARDS模型,后通過多項指標對ARDS大鼠肺損傷進行綜合評價。實驗結果表明,黃芪丹參提取物給藥能夠明顯降低ARDS大鼠肺組織的濕/干重比、炎性浸潤、MPO和趨化因子CCL2,CCL3和CCL17 mRNA含量以及BALF中炎癥因子TNF-α,IL-1β和IL-6相對含量。此外還從大鼠BALF中分離中性粒細胞用于IL-4/IL-4Rα成員蛋白表達檢測,數據顯示藥物預處理能夠顯著提高ARDS大鼠BALF來源中性粒細胞中IL-4Rα以及凋亡誘導因子Caspase 3-cleaved表達,這與HIF-1α通過降低Caspase-3蛋白水解而關閉細胞程序死亡的報道是一致的,同時亦從側面再次驗證了黃芪丹參提取物、中性粒細胞生存率與ARDS患者肺損傷三者之間存在密切聯系。在研究中還用慢病毒途徑在大鼠肺部靶向IL-4Rα,依據其是否能夠逆轉提取物抗ARDS損傷作用來對IL-4Rα在藥物反應過程中的關鍵作用進行評價。
總之,本研究表明黃芪丹參提取物能夠改善ARDS導致的大鼠肺損傷,作用途徑與其能夠上調中性粒細胞IL-4Rα表達并促進凋亡誘導因子Caspase-3的水解活化有關,Caspase-3水解活化后誘導中性粒細胞程序性死亡為黃芪丹參提取物降低和改善ARDS病理條件下肺部炎性級聯反應和組織損傷的直接原因。

