電針聯(lián)合跑輪訓(xùn)練緩解大腦中動(dòng)脈栓塞大鼠腦神經(jīng)損傷和認(rèn)知功能障礙的機(jī)制研究
楊坤,胡鋒,閔慧,梅求安,許明軍
腦卒中是世界上第二大最常見的死因,每年有600萬人死于卒中。急性缺血性卒中是最常見的卒中形式[1-2]。臨床上,卒中的治療僅限于恢復(fù)血流的干預(yù)措施-藥物或機(jī)械溶栓。然而,實(shí)際上只有11%的卒中患者實(shí)際上接受了組織型纖溶酶原激活劑,而在這些患者中,有一半未能表現(xiàn)出臨床改善。因此,迫切需要確定新的、更有效的缺血再灌注相關(guān)方法治療神經(jīng)元損傷[3-4]。tau是一種與微管組裝相關(guān)的蛋白質(zhì),參與維持神經(jīng)元形態(tài)以及軸突和樹突狀過程的形成[5],為了使tau正常發(fā)揮作用,它需要在特定殘基處被磷酸化。在腦缺血和血管再灌注期間,tau傾向于過度磷酸化,從而導(dǎo)致其聚集,這種現(xiàn)象通常與神經(jīng)變性和細(xì)胞死亡相關(guān)[6]。tau的病理性積累是一組被歸類為tau病的神經(jīng)退行性疾病的特征[7]。在神經(jīng)元和神經(jīng)膠質(zhì)細(xì)胞中觀察到tau病理學(xué),這可能與缺血性卒中后的腦血管損傷有關(guān),并且可能在卒中中發(fā)揮關(guān)鍵作用[8-10]。證據(jù)表明,電針通過各種信號通路減少細(xì)胞凋亡,對多器官系統(tǒng)的缺血性損傷發(fā)揮保護(hù)作用[11-12],電針通過改善神經(jīng)退行性疾病的認(rèn)知功能來提供神經(jīng)保護(hù)作用[13],電針通過各種途徑減輕炎癥反應(yīng)來治療腦缺血性損傷[14]。眾所周知,體育鍛煉可能有助于預(yù)防和治療卒中。嚙齒動(dòng)物的跑輪運(yùn)動(dòng)可以模仿人類的身體“活躍”生活方式。電針聯(lián)合跑輪訓(xùn)練既可以發(fā)揮電針的穴位刺激效應(yīng),同時(shí)可以通過跑輪促進(jìn)大腦機(jī)能恢復(fù)。因此,本課題研究電針聯(lián)合跑輪訓(xùn)練對大腦中動(dòng)脈栓塞(middle cerebral artery occlusion,MCAO)模型大鼠海馬對腦中動(dòng)脈閉塞大鼠tau蛋白及磷酸化程度的影響。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物 30只成年雄性SD大鼠(16周齡,質(zhì)量350~450g)購自南京模型動(dòng)物中心。大鼠都在標(biāo)準(zhǔn)的塑料籠子中飼養(yǎng),在特定的無病原體條件下以12h的明暗循環(huán)。飼養(yǎng)室的溫度保持在20~25°C,濕度穩(wěn)定在50%~60%。MCAO模型:大鼠急性局灶性腦缺血是由腔內(nèi)MCAO引起的。用于大鼠的4mm遠(yuǎn)端尼龍單絲(長30mm,直徑0.16mm)部分涂有直徑為0.21~0.22mm的硅樹脂(澳大利亞),11mm遠(yuǎn)端單絲(長50mm,直徑0.23mm)段涂有用于大鼠的0.28~0.30mm直徑的硅膠。MCAO是通過將單絲通過頸總動(dòng)脈插入左頸內(nèi)動(dòng)脈,在頸動(dòng)脈分叉處前進(jìn)20~21mm直到感覺到輕微的阻力。在假手術(shù)動(dòng)物中,閉塞細(xì)絲僅插入頸動(dòng)脈分叉上方5mm處。
1.2 方法 在適應(yīng)1周后,大鼠被隨機(jī)分為3組各10只,對照組進(jìn)行了假手術(shù)處理,并安置于沒有跑輪的消毒后的聚丙烯籠中;MCAO組如前所述進(jìn)行MCAO手術(shù)處理后置于消毒后的聚丙烯籠中;觀察組大鼠進(jìn)行MCAO手術(shù)后的第7天,被飼養(yǎng)在帶有直徑12cm跑輪的聚丙烯籠中,每天使用跑輪12h,運(yùn)動(dòng)干預(yù)持續(xù)時(shí)間為10周,同時(shí)每天早上8點(diǎn)對該組大鼠進(jìn)行電針治療,將針直徑0.3mm灸針插入大鼠右肢的外關(guān)和足三里穴位約3mm處,用電針治療儀進(jìn)行電刺激,型號為G6805-II。對大鼠施用連續(xù)波電針治療(20Hz,1mA)30min,每天1次,連續(xù)3周。
1.3 評定指標(biāo)
1.3.1 組織收集和保存 所有大鼠均采集樣本,取材時(shí)間點(diǎn)為大鼠在行為測試后第2天,禁食過夜。將血樣保存在冰上,直到將樣品在4°C下以3000g離心10min。將大腦迅速從顱骨中取出并用冰冷的PBS清洗,立即將左側(cè)海馬和額葉、頂葉-顳葉皮層從全腦中分離出,并儲(chǔ)存在-80℃冰箱。見圖1。

圖1 大鼠腦的大體病理圖
1.3.2 脫氧核糖核苷酸末端轉(zhuǎn)移酶介導(dǎo)的缺口末端標(biāo)記法(TdT-mediated dUTP nick-end labeling,TUNEL)染色 TUNEL用于原位染色DNA末端以檢測基因組DNA片段。腦組織切片在暗室中用100μL末端脫氧轉(zhuǎn)移酶反應(yīng)混合物覆蓋2h。在熒光顯微鏡(DM6000B,徠卡公司,德國)下檢測到同側(cè)丘腦的熒光信號。
1.3.3 莫里斯水迷宮(Morris water maze,MWM)測試 3組干預(yù)后進(jìn)行MWM測試。3組在連續(xù)5d的定向?qū)Ш綔y試中,將小鼠置于充滿水(24±1°C)的圓形水池(直徑:120cm,高度:40cm)中以找到一個(gè)隱藏的平臺(tái)(水面以下1.0cm)。小鼠在80s內(nèi)找到平臺(tái)則試驗(yàn)終止,讓小鼠在平臺(tái)上休息10s。否則,如果80s后沒有找到平臺(tái),則人工引導(dǎo)小鼠到平臺(tái)20s進(jìn)行學(xué)習(xí)。為了評估空間學(xué)習(xí)記憶功能,記錄小鼠潛伏期時(shí)間及探測試驗(yàn)時(shí)間。
1.3.4 Nissl染色 腹腔注射10%水合氯醛后,從大鼠中分離腦組織并在4°C下在4% PFA中保存3d。將組織進(jìn)行石蠟包埋并切成30μm厚的切片用于免疫熒光顯微鏡檢查。腦切片用于尼氏染色和免疫熒光。Nissl染色切片經(jīng)受0.1%甲酚紫(默克公司,美國)以評估缺血體積和完整神經(jīng)元的數(shù)量。
1.3.5 蛋白質(zhì)印跡 通過免疫印跡法測定丘腦中tau、p-Tauser396、p-Tause404和凋亡相關(guān)蛋白的水平。在深度麻醉下,用50ml冰冷的0.9%鹽水對大鼠進(jìn)行心內(nèi)灌注。立即在冰上分離左側(cè)丘腦并在細(xì)胞裂解緩沖液中勻漿。在10%十二烷基硫酸鈉-聚丙烯酰胺凝膠上從每個(gè)樣品中分離出相同數(shù)量的蛋白質(zhì),電泳轉(zhuǎn)移到聚偏二氟乙烯膜(默克公司,美國)上。在室溫下用5%脫脂牛奶的tris緩沖鹽水和0.2% Tween 20 (TBST)封閉膜90min,與兔抗大鼠β-肌動(dòng)蛋白多克隆抗體(1:1200,Sigma公司)在4°C下孵育過夜,小鼠抗大鼠tau抗體(1:1000,Millipore公司,美國)和 兔抗大鼠p-tau-396單克隆抗體、兔抗大鼠凋亡蛋白Bcl2相關(guān)X蛋白(Bcl2 Associated X Protein,Bax)多克隆抗體、兔抗大鼠B淋巴細(xì)胞瘤-2基因(B-cell lymphoma-2,Bcl-2)多克隆抗體和兔抗大鼠B細(xì)胞淋巴瘤/白血病-xl基因(B cell lymphoma/leukemia - XL gene,Bcl-xL)多克隆抗體(1:1000,Abcam 公司,美國)和 小鼠抗大鼠GAPDH單克隆抗體(1:1000)。二抗是抗小鼠 IgG(1:2000,上海碧云天公司)或抗兔 IgG(1:2000)。用 TBST 徹底洗滌后,將膜與 HRP 偶聯(lián)的二抗(1:1000, 7042P2, CST,美國)一起孵育。使用增強(qiáng)的化學(xué)發(fā)光試劑盒在放射自顯影膠片上觀察免疫反應(yīng)性。
1.3.6 免疫組織化學(xué) 切片用85℃ 0.01 M 檸檬酸鹽緩沖液(pH 6.0)預(yù)處理3min,用3%過氧化氫處理15min,在0.1M PBS中沖洗3次。用5%正常山羊血清和1%牛血清白蛋白在室溫下封閉2h后,將切片與一抗在4°C下孵育過夜,在相同的PBS中沖洗3次。使用小鼠-兔ABC試劑盒(PK-6200)檢測信號。使用了以下一抗:小鼠抗NeuN(1:1000,Abcam 公司,美國)、小鼠抗tau(1:500,Abcam 公司,美國)、兔抗p-Tauser396 -p-Tause404(1:500,ab30665, 英國劍橋?qū)嶒?yàn)室)和兔抗 CD68(1:100,Abcam公司,美國)。在4°C下24h。使用熒光顯微鏡分析組織。
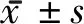
2 結(jié)果
2.1 TUNEL染色凋亡分析 通過TUNEL染色分析大鼠腦組織中神經(jīng)細(xì)胞凋亡,MCAO組TUNEL染色陽性細(xì)胞凋亡率較對照組升高(P<0.05),觀察組TUNEL染色陽性細(xì)胞凋亡率較MCAO組降低(P<0.05)。見圖2,表1。

表1 3組大鼠丘腦中TUNEL陽性細(xì)胞凋亡情況比較

圖2 TUNEL分析(注:標(biāo)尺為綠色在右下側(cè),為100μm)
2.2 MWM行為測試 通過MWM測量大鼠的認(rèn)知功能,MCAO組發(fā)現(xiàn)隱藏平臺(tái)的潛伏期較對照組增加(P<0.05),探測試驗(yàn)時(shí)間減少(P<0.05),觀察組發(fā)現(xiàn)隱藏平臺(tái)的潛伏期時(shí)間較MCAO組減少(P<0.05),探測試驗(yàn)時(shí)間增加(P<0.05)。見表2。

表2 3組MWM行為測試結(jié)果比較
2.3 凋亡蛋白表達(dá)分析 MCAO組Bax蛋白表達(dá)較對照組升高(P<0.05),觀察組Bax蛋白表達(dá)較MCAO組降低(P<0.05),MCAO組Bcl-2和Bcl-xL蛋白表達(dá)較對照組降低(P<0.05),觀察組Bcl-2和Bcl-xL蛋白表達(dá)較MCAO組升高(P<0.05)。見圖3,表3。

圖3 3組蛋白印跡分析凋亡蛋白表達(dá)比較
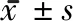
表3 3組凋亡蛋白表達(dá)比較
2.4 大鼠神經(jīng)損傷情況 通過尼氏染色和免疫熒光染色分析大鼠丘腦組織中神經(jīng)元損傷情況,MCAO組完整神經(jīng)元數(shù)量較對照組減少(P<0.05),觀察組完整神經(jīng)元數(shù)量較MCAO增多(P<0.05),MCAO組CD68的平均光密度較對照組升高(P<0.05),觀察組CD68的平均光密度較MCAO組降低(P<0.05)。見圖4,表4。

圖4 3組尼氏和免疫熒光染色情況比較
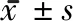
表4 3組尼氏染色和免疫熒光染色結(jié)果比較
2.5 tau磷酸化水平 通過免疫組織化學(xué)檢測大鼠海馬中p-Tau絲氨酸396/404的磷酸化蛋白水平,MCAO組p-Tauser396和p-Tause404磷酸化表達(dá)較對照組升高(P<0.05),觀察組p-Tauser396和p-Tause404磷酸化表達(dá)較MCAO組降低(P<0.05)。見圖5,表5。

圖5 3組p-Tau396/404磷酸化表達(dá)比較
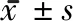
表5 3組p-Tau396/404磷酸化水平比較
2.6 tau蛋白 通過蛋白印跡分析大鼠海馬中tau蛋白的變化,MCAO組p-Tauser396、p-Tause404和總tau蛋白表達(dá)較對照組升高(P<0.05),觀察組p-Tauser396、p-Tause404和總tau蛋白表達(dá)較MCAO組降低(P<0.05)。見圖6,表6。

圖6 3組蛋白印跡分析tau蛋白表達(dá)比較
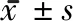
表6 3組tau蛋白表達(dá)情況比較
3 討論
tau蛋白是一種微管相關(guān)蛋白,是細(xì)胞骨架的重要組成部分,是確保微管系統(tǒng)完整性和穩(wěn)定性的關(guān)鍵[15]。大腦皮層和海馬中由過度磷酸化的tau蛋白組成的細(xì)胞外Aβ斑塊和細(xì)胞內(nèi)神經(jīng)原纖維纏結(jié)(neurofibrillary tangles,NFTs)是卒中后腦部的典型病理變化。tau過度磷酸化導(dǎo)致的NFT沉積被認(rèn)為是卒中后腦損傷的早期病理標(biāo)志[16]。微管相關(guān)蛋白tau在中樞神經(jīng)系統(tǒng)神經(jīng)元的軸突中高度表達(dá)。其與微管的結(jié)合可以維持微管的穩(wěn)定性,這對于維持正常的軸突質(zhì)運(yùn)輸和突觸可塑性具有重要意義[17]。過度磷酸化tau蛋白的聚集或其降解紊亂有助于NFT在神經(jīng)元中的沉積。NFTs在神經(jīng)元樹突棘的沉積介導(dǎo)Aβ的神經(jīng)毒性,導(dǎo)致樹突棘的缺失和形態(tài)改變,直接導(dǎo)致神經(jīng)元突觸功能受損。隨著全球老齡化的加速,卒中的患病率正在增加。因此,為這種破壞性疾病找到一種有效的治療方法至關(guān)重要且緊迫。預(yù)防tau過度磷酸化和自噬降解缺陷導(dǎo)致的神經(jīng)原纖維纏結(jié)積累可能是一種有前途的卒中后干預(yù)策略[18]。因此,本研究對tau蛋白和tau相關(guān)蛋白表達(dá)進(jìn)行了測試。
電針是在傳統(tǒng)針灸和電療的基礎(chǔ)上,作為預(yù)防和治療卒中的工具[19]。電刺激針療法能有效改善缺血性腦卒中患者上肢運(yùn)動(dòng)功能,與單純手法針刺相比,效果更好。研究顯示,缺血性卒中的電針治療可能是從影響神經(jīng)遞質(zhì)與基因表達(dá),血流變、干預(yù)蛋白或其他超微結(jié)構(gòu)等方面來體現(xiàn)其療效的。此外,已有文獻(xiàn)表明,其機(jī)制可能是通過抑制炎癥反應(yīng),對血清蛋白的改變,改善腦血流,保護(hù)神經(jīng)元等方面實(shí)現(xiàn)。臨床上,電針治療通常通過卒中患者的外關(guān)和足三里穴位進(jìn)行。多項(xiàng)實(shí)驗(yàn)研究表明,在穴位外關(guān)或足三里處進(jìn)行電針刺激可為腦缺血大鼠提供神經(jīng)保護(hù)作用。在中樞神經(jīng)系統(tǒng)中,星形膠質(zhì)細(xì)胞和小膠質(zhì)細(xì)胞在調(diào)節(jié)炎癥反應(yīng)中發(fā)揮重要的功能作用。星形膠質(zhì)細(xì)胞和小膠質(zhì)細(xì)胞的激活與神經(jīng)損傷和神經(jīng)退行性疾病引起的神經(jīng)炎癥密切相關(guān)。研究表明,針灸可通過多種途徑對卒中產(chǎn)生保護(hù)作用,如減輕神經(jīng)炎癥、抑制Aβ蛋白沉積和tau過度磷酸化、增強(qiáng)葡萄糖腦代謝、減少氧化應(yīng)激和抑制神經(jīng)元凋亡[20]。來自臨床試驗(yàn)和動(dòng)物研究的越來越多的證據(jù)表明,針灸可能是治療卒中后認(rèn)知功能障礙的潛在方法。
本研究表明,如果在MCAO的早期和癥狀前階段開始跑輪運(yùn)動(dòng),可能會(huì)觀察到跑輪運(yùn)動(dòng)對MCAO病理學(xué)的保護(hù)和有益作用。筆者分析認(rèn)為,在卒中患者死后的大腦、血漿和腦脊液中存在不同程度的代謝紊亂。代謝特征受損與認(rèn)知評分、海馬體積和皮質(zhì)厚度以及總tau和p-tau生物標(biāo)志物相關(guān),有氧運(yùn)動(dòng)對tau磷酸化和相關(guān)tau激酶具有保護(hù)作用。此外,運(yùn)動(dòng)可以改變參與多種代謝途徑的代謝物的平均濃度。
本研究還表明,MCAO大鼠記憶缺陷會(huì)導(dǎo)致行為表現(xiàn)受損,這表明MCAO模型組中受損的空間記憶使使用標(biāo)記點(diǎn)找到平臺(tái)變得更加困難,并表明該模型是成功的。然而,大鼠進(jìn)行電針聯(lián)合跑輪訓(xùn)練后導(dǎo)致逃逸潛伏期顯著降低,這表明電針聯(lián)合跑臺(tái)訓(xùn)練能夠改善MCAO大鼠的認(rèn)知能力并改善了記憶缺陷。同時(shí),電針聯(lián)合跑輪訓(xùn)練通過增強(qiáng)MCAO大鼠的學(xué)習(xí)和記憶能力有效地改善了MWM性能。筆者分析認(rèn)為,電針聯(lián)合跑輪訓(xùn)練治療是可以減輕tau過度磷酸化導(dǎo)致的記憶缺陷和神經(jīng)損傷,MCAO大鼠認(rèn)知功能的改善可能與其tau磷酸化和tau蛋白水平有關(guān),包括絲氨酸396和404在內(nèi)的多個(gè)位點(diǎn)的異常磷酸化。因此,電針與跑臺(tái)訓(xùn)練兩種療法聯(lián)合應(yīng)用能改善局灶性腦缺血后大鼠神經(jīng)功能,同時(shí)減小腦梗死體積,減少細(xì)胞凋亡率,減輕局灶性腦缺血引起的內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)。電針聯(lián)合跑輪運(yùn)動(dòng)導(dǎo)致MCAO大鼠海馬和皮質(zhì)中p-Tauser396和404的減少,即tau磷酸化的減少可能是MCAO大鼠認(rèn)知功能改善的部分原因。
綜上所述,本研究結(jié)果表明,電針聯(lián)合跑輪訓(xùn)練可通過抑制tau過度磷酸化和tau蛋白表達(dá)減少M(fèi)CAO大鼠腦神經(jīng)損傷并改善學(xué)習(xí)和記憶能力。

