CRISPR/Cas 系統對金黃色葡萄球菌耐藥及毒力基因的影響
謝龍飛 肖丹瑜 常依 張旭財 李小申 熊文廣

摘要: 【目的】了解金黃色葡萄球菌(以下簡稱“金葡菌”) Staphylococcus aureus 中成簇的規律間隔短回文重復序列(Clustered regularly interspaced short palindromic repeats,CRISPR) 的分布情況,分析其對抗生素耐藥基因和毒力基因水平轉移的影響。【方法】從公共數據庫獲取組裝完整的金葡菌基因組575 個,利用生物信息學方法,統計CRISPR 結構的攜帶情況,菌株多位點序列分型(Multi-locus sequence typing,MLST) 型別分布和菌株耐藥基因、毒力基因的分布情況;對CRISPR 結構陽性(CRISPR+) 和CRISPR 結構陰性(CRISPR?) 的金葡菌耐藥基因和毒力基因攜帶數目進行差異顯著性分析。同時對實驗室60 株金葡菌二代測序數據進行分析,驗證公共數據庫分析結果。對實驗室60 株金葡菌中原噬菌體、接合質粒的攜帶情況進行統計,討論CRISPR 結構對菌株原噬菌體和接合質粒的影響。【結果】基因組組裝完整的575 株金葡菌中,有62 株攜帶CRISPR 結構(CRISPR+),513 株不攜帶CRISPR 結構(CRISPR?);CRISPR+金葡球菌攜帶耐藥基因、毒力基因的數目顯著小于CRISPR?金葡菌。實驗室60 株金葡菌中,有14 株為CRISPR+,46 株為CRISPR?;CRISPR+金葡菌攜帶更少的耐藥基因和毒力基因,與公共數據庫分析結果一致。對原噬菌體和接合質粒的分析結果顯示,CRISPR?菌株攜帶更多的原噬菌體序列,與CRISPR+菌株之間差異顯著(P<0.05);接合質粒方面,CRISPR?和CRISPR+菌株無顯著性差異。【結論】CRISPR 結構可能限制了金葡菌中耐藥基因和毒力基因的水平轉移,CRISPR?菌株更容易受到噬菌體和可移動質粒的干擾。本研究為進一步研究金葡菌耐藥基因和毒力基因的傳播提供了參考。
金黃色葡萄球菌( 以下簡稱“ 金葡菌” )Staphylococcus aureus 是一種革蘭陽性球菌,可引起肺和皮膚組織感染,甚至危及生命。作為一種機會致病菌,金葡菌已成為外科手術感染及醫療器械污染中最常見的病原體[1-3]。近年來,隨著抗生素的大量使用,金葡菌耐藥性逐漸增強,耐甲氧西林金黃色葡萄球菌(Methicillin-resistant Staphylococcusaureus,MRSA) 的出現引起了全球的廣泛關注。有研究表明,金葡菌可通過噬菌體、質粒、轉座子及葡萄球菌盒式染色體( S t a p h y l o c o c c a l c a s s e t t echromosome mec,SCCmec) 等方式進行耐藥基因的水平轉移[4-6]。mecA 作為MRSA 菌株攜帶的耐藥基因,已有研究表明mecA 主要通過SCCmec 元件進行水平轉移[7-8]。
SCCmec 是一種具有高度多樣性的移動遺傳因子。1999 年首次測定了1982 年分離的日本金葡菌N315 菌株的mec 整體結構及DNA 序列。1 年后,mec DNA 被發現是由2 個位點特異性重組酶基因c c rA 和c c rB 驅動的新基因元件,命名為S C Cmec[9]。SCCmec (SCC 家族的主要成員) 是一種攜帶mec 基因(mecA、mecB 和mecC) 以及控制其表達的基因mecR1(編碼信號轉導蛋白mecR1) 和mecI(編碼抑制蛋白mecI) 的移動遺傳元件,并作為葡萄球菌菌株間基因信息交換的載體。SCCmec 位于葡萄球菌染色體復制起點附近,插入在插入位點attB (orfX 的3'端)。SCCmec 有3 個基本的遺傳因素:ccr 基因復合體(由ccrAB 或ccrC 及其周圍的ORFs 組成)、mec 基因復合體(由mec 基因、插入序列和周圍的ORFs 組成) 和連接區(J 區)。在ccr 基因復合體中,通過ccrAB 或ccrC 位點特異性重組,可以將多個耐藥和耐重金屬基因插入SCCmec 中,SCCmec 可通過ccrAB 或ccrC 的精確切除和整合,整合到葡萄球菌菌株的染色體上;因此,不同的葡萄球菌菌株交換遺傳信息,以適應不同的環境和抗生素選擇的壓力[10]。SCCmec 編碼一種新的特異性青霉素結合蛋白(PBP2a),與金葡菌內源性青霉素結合蛋白相比,PBP2a 與β–內酰胺的結合親和力降低,導致抗生素失活。與其他對β–內酰胺類抗生素的抑制機制不同,MRSA 還能夠通過PBP2a 持續合成獨特的細胞壁成分。由于獲得了SCCmec 元件,甲氧西林敏感金葡菌( M e t h i c i l l i n - s e n s i t i v eStaphylococcus aureus,MSSA) 進化為MRSA[11]。根據各類型SCCmec 在J 區域的差異,將SCCmec 分為不同的型和亞型。III 型SCCmec 在巴西、波蘭、伊朗、土耳其、馬來西亞、泰國、中國和中國臺灣等國家或地區為主要檢出類型[12]。本研究通過對實驗室60 株二代測序金葡菌基因組序列SCCmec 元件進行比對分析,發現CRISPR 陽性(CRISPR+) 和CRISPR 陰性(CRISPR?) 不同菌株中都攜帶SCCmec元件,SCCmec 元件的主要類型為III 型,另外有1 株為VIII 型,1 株為XII 型,與報道結果一致。
成簇的規律間隔短回文重復序列(Clusteredregularly interspaced short palindromic repeats,CRISPR) 是存在于原核生物中的一種適應性免疫系統。有研究表明,約50% 的細菌攜帶CRISPR/Cas 系統[13]。它能夠靶向切割核酸序列,從而抵御噬菌體、質粒等外源基因的入侵,保持細菌自身遺傳結構的穩定[14]。CRISPR/Cas 系統能否限制細菌耐藥基因和毒力基因的水平轉移,目前還沒有明確的結論。M a r r a f f i n i 等[ 1 5 ] 發現表皮葡萄球菌RP62a 菌株的CRISPR/Cas 系統可以阻止質粒的結合轉移。張蒙蒙等[ 1 6 ] 發現葡萄球菌中CRISPR/Cas 系統可以限制mecA 等耐藥基因的轉移。目前,金葡菌中CRISPR/Cas 系統對細菌耐藥基因和毒力基因的影響還不清楚。本研究以NCBI 數據庫5 7 5 株金葡菌的基因組序列為研究對象,探討CRISPR 結構對其耐藥基因和毒力基因的影響,并通過對實驗室分離菌株二代測序基因組序列進行分析,做進一步驗證。
1 材料與方法
1.1 材料
575 株金葡菌基因組序列下載自NCBI 數據庫(https://www.ncbi.nlm.nih.gov/genome/genomes/154),60 株金葡菌基因組為本研究前期臨床分離菌株的二代測序數據。
1.2 方法
1.2.1 CRISPR 位點的識別與提取 通過CRISPRsfinder (https://crispr.i2bc.paris-saclay.fr/Server/) 在線進行,統計具有CRISPR 位點的金葡菌,將金葡菌基因組分為CRISPR+和CRISPR? 2 大類。1.2.2 金葡菌多位點序列分型及系統發育樹的構建 對575 株金葡菌通過Center for GenomicEpidemiology 在線網站(http://www.genomicepidemiology.org/) 進行多位點序列分型(Multi-locussequence typing,MLST),構建系統發育樹。對CRISPR+和CRISPR?菌株ST 型別進行韋恩圖的繪制,分析二者的相關性。
1.2.3 耐藥基因、毒力基因的統計 通過Center forGenomic Epidemiology 網站下載整理耐藥基因和毒力基因數據庫,預測金葡菌基因組的ORF,利用blastn 軟件進行耐藥基因和毒力基因的比對(序列一致率>80%,覆蓋率>70%)。
1.2.4 原噬菌體和接合質粒的比對分析 實驗室6 0 株金葡菌基因組通過P H A S T ER 在線網站(http://phaster.ca/) 比對原噬菌體的攜帶情況,統計結果為完整噬菌體序列。通過Center for GenomicEpidemiology 在線網站比對接合質粒存在情況(序列一致率>95%)。
1.2.5 統計學分析 采用SPSS 21.0 軟件進行統計學分析,CRISPR+和CRISPR?與耐藥基因和毒力基因之間的關系采用χ2 檢驗,以P<0.05 為差異有統計學意義。
2 結果與分析
2.1 金葡菌基因組中CRISPR 結構分布概況
公共數據庫575 株金葡菌中有62 株(11%) 含有確證的CRISPR 位點(CRISPR+),513 株(89%)無或僅含有可疑的CRISPR 結構(CRISPR?)。實驗室6 0 株金葡菌中有1 4 株( 2 3 % ) 含有確證的CRISPR 位點(CRISPR+),46 株(77%) 無或僅含有可疑的CRISPR 結構(CRISPR?)。
2.2 金葡菌MLST 型別及相關性分析
對5 7 5 株金葡菌基因組進行M L S T 分型,536 株可以進行ST 分型,共得到81 個ST 型別。對基因組進行系統發育樹的構建,如圖1A 所示。我們將ST 型別數量≥10 的菌株標注不同的顏色,其他型別菌株以白色顯示,同時將新ST 型菌株以黑色標注。系統發育樹顯示,ST8 型別的菌株所占的比例最高,為19%(111/575);其次是ST5,占比達到13%(77/575)。在CRISPR+菌株中,最具有代表性的型別是ST398;CRISPR?菌株中,最具有代表性的型別是S T 8 。通過繪制韋恩圖來分析CRISPR+與CRISPR?菌株的關系,如圖1B 所示,CRISPR+與CRISPR?之間有11 個共同的ST 型,菌株之間具有相關性。
2.3 金葡菌耐藥基因的分析
2.3.1 金葡菌耐藥基因分布 公共數據庫基因組中,62 株CRISPR+金葡菌中陽性率最高的耐藥基因是tet(38),占比高達90%(56/62);其次是blaZ,占比60%(37/62)。與CRISPR+菌株相比,513 株CRISPR?菌株中ant(4')-Ib、aph(3')-Ⅲa、aad(6) 和msr(A) 的陽性率高(P<0.05)。CRISPR?菌株耐藥基因的種類多于CRISPR+菌株(表1)。
實驗室菌株基因組中,14 株CRISPR+金葡菌中陽性率最高的耐藥基因是b l a Z , 占比5 7 %(8/14)。與CRISPR+菌株相比,46 株CRISPR?菌株中ant(6)-Ia、cfr、mecA 的陽性率高(P<0.05)。CRISPR+菌株的耐藥基因種類少于CRISPR?菌株(表2)。
2.3.2 金葡菌耐藥基因數目 在菌株攜帶耐藥基因的數量方面,CRISPR+菌株攜帶的耐藥基因數量更少。公共數據庫基因組CRISPR+菌株中,有58%(36/62) 的菌株攜帶耐藥基因的數量≥10 個,低于CRISPR?菌株(77%,395/513);實驗室菌株基因組CRISPR+菌株中,有29%(4/14) 的菌株攜帶耐藥基因的數量≥10 個,低于CRISPR?菌株(74%,34/46)(表3)。
同時,我們分別對2 組數據中CRISPR+和CRISPR?菌株攜帶耐藥基因數目進行箱線圖繪制。公共數據庫基因組中,CRISPR+菌株整體攜帶耐藥基因數量的平均值低于CRISPR?菌株,差異極顯著(P<0.01)(圖2A)。實驗室基因組中,CRISPR+菌株整體攜帶耐藥基因數量的平均值低于CRISPR?菌株,差異顯著(P<0.05)(圖2B)。
2.4 金葡菌毒力基因的分析
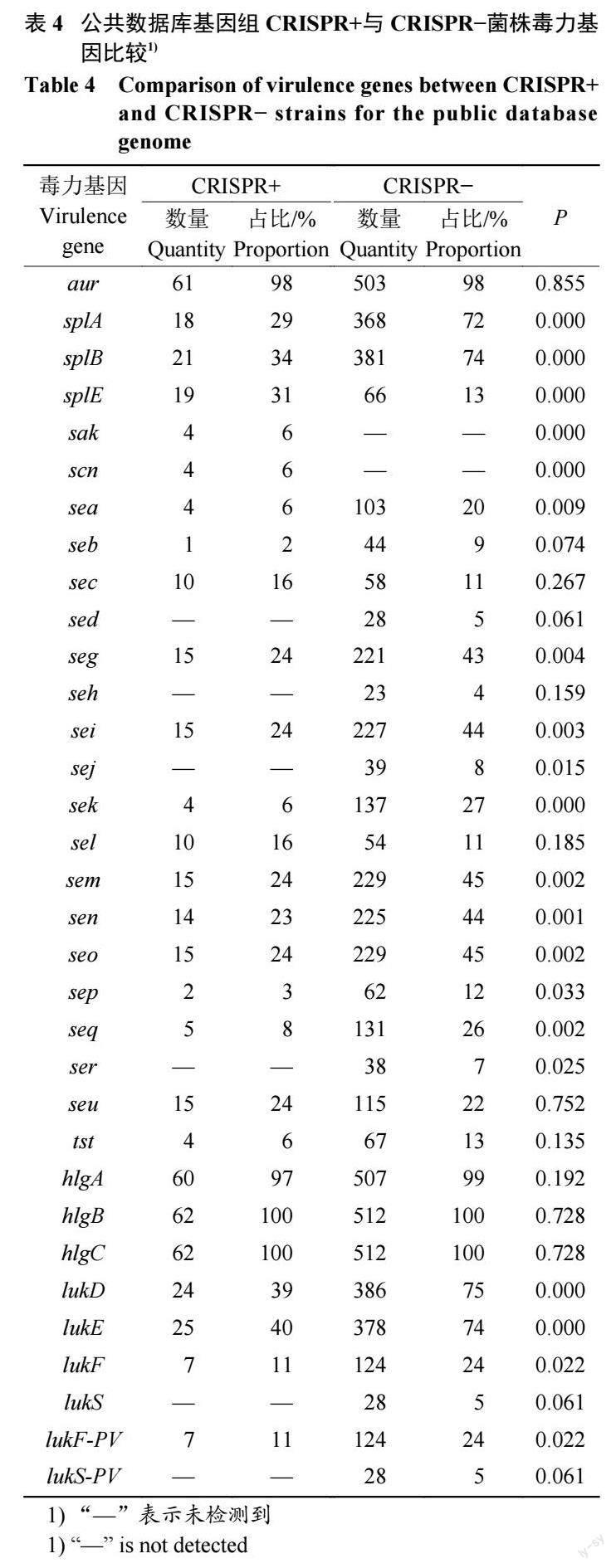
2.4.1 金葡菌毒力基因分布 由表4 可知,公共數據庫基因組中,CRISPR+金葡菌陽性率最高的毒力基因是hlgB、hlgC,占比高達100%(62/62);其次是aur,占比98%(61/62)。與CRISPR+菌株相比, C R I S P R ?菌株中s p l A 、s p l B 的陽性率高(P<0.05)。CRISPR?菌株毒力基因的種類多于CRISPR+菌株。
實驗室菌株基因組中,CRISPR+金葡菌陽性率最高的毒力基因是aur、hlgA、hlgB 和hlgC,占比71%(10/14)。與CRISPR+菌株相比,CRISPR?菌株中sei、sem、sen、seo 和seu 的陽性率高。CRISPR+菌株的毒力基因種類少于CRISPR?菌株(表5)。
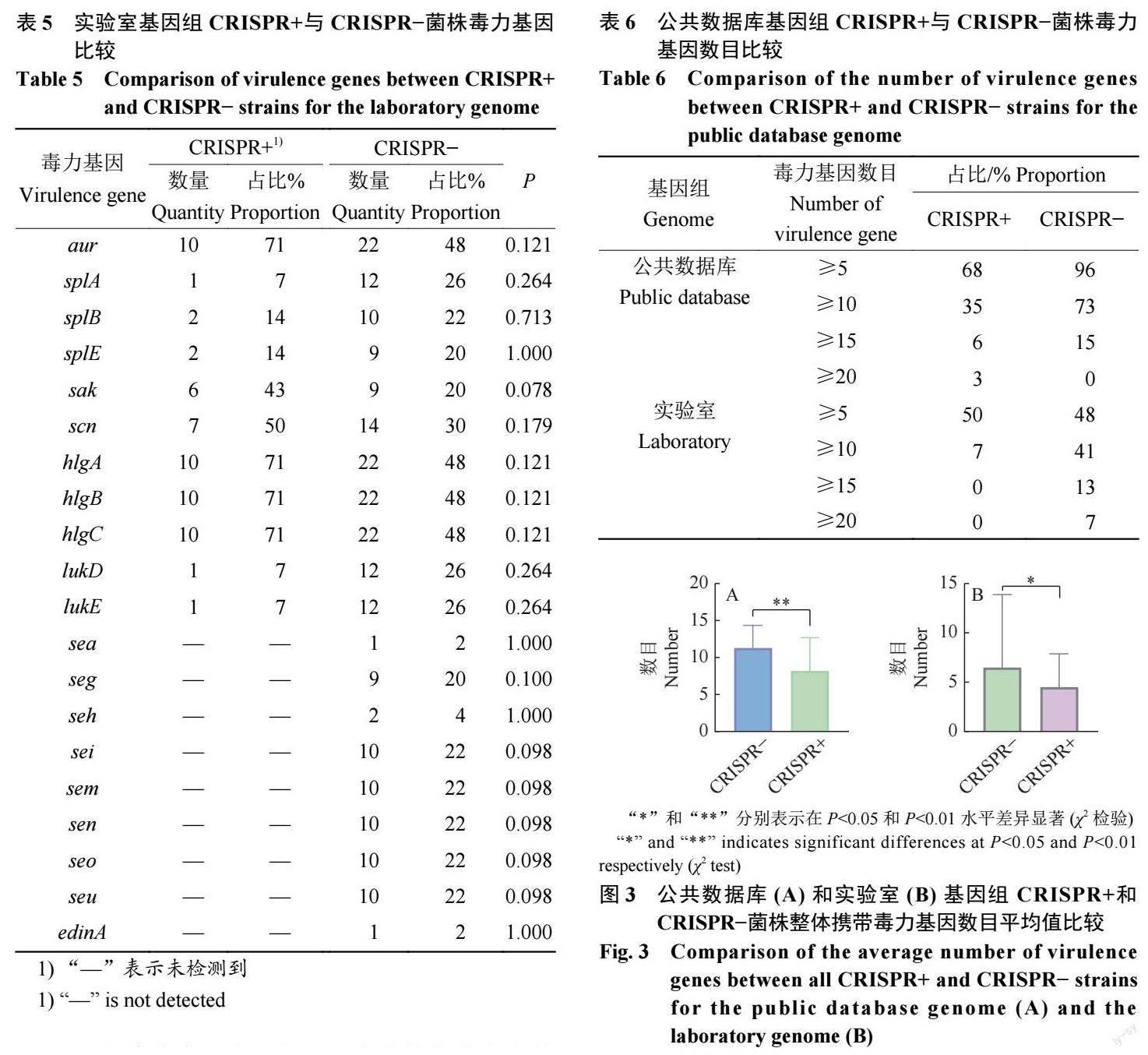
2.4.2 金葡菌毒力基因數目 在菌株攜帶毒力基因的數量方面,CRISPR+菌株攜帶的毒力基因更少。公共數據庫基因組C R I S P R + 菌株中, 有35%(22/62) 的菌株攜帶毒力基因的數量≥10 個,低于CRISPR?菌株(73%,374/513);實驗室菌株基因組CRISPR+菌株中,有7%(1/14) 的菌株攜帶毒力基因的數量≥10 個,低于CRISPR?菌株(41%,19/46)(表6)。
同時,我們分別對2 組數據中CRISPR+和CRISPR?菌株攜帶毒力基因數目進行箱線圖繪制。公共數據庫基因組中,CRISPR+菌株整體攜帶毒力基因數目的平均值低于CRISPR?菌株,差異極顯著(P<0.01)(圖3A)。實驗室基因組中,CRISPR+菌株整體攜帶毒力基因數目的平均值低于CRISPR?菌株,差異顯著(P<0.05)(圖3B)。
2.5 原噬菌體和接合質粒的比對分析
實驗室60 株金葡菌基因組原噬菌體比對結果顯示,CRISPR+金葡菌中原噬菌體的攜帶率為29%(4/14),CRISPR?金葡菌中原噬菌體的攜帶率為67%(31/46)。CRISPR?菌株攜帶更多的原噬菌體序列,與CRISPR+菌株之間差異顯著(P<0.05)。接合質粒的分析結果顯示,CRISPR+金葡菌中接合質粒的攜帶率為86%(12/14),CRISPR?金葡菌中接合質粒的攜帶率為8 0 % ( 3 7 / 4 6 )。C R I S P R ?和CRISPR+菌株基本一致,無顯著差異(P>0.05)。
3 討論與結論
3.1 討論
CRISPR/Cas 系統作為原核生物的一種適應性免疫系統,能抵御外來基因元件如噬菌體、質粒的入侵,保持細菌自身遺傳結構的穩定。日本學者于1987 年首次在大腸埃希菌中發現該結構[17],Barrangou等[13] 首次用試驗證明CRISPR/Cas 系統具有抵御外來噬菌體干擾的功能。本研究結果顯示,CRISPR+金葡菌菌株大多含有較少的耐藥基因和毒力基因,CRISPR 結構能夠限制耐藥基因、毒力基因的水平轉移,使細菌的遺傳結構保持穩定[18]。
但是,從進化的角度看,基因的水平轉移可以使細菌獲取新的遺傳物質,有利于細菌在復雜的環境中生存[19-20]。本研究在對毒力基因進行分析的過程中發現,極少數CRISPR+金葡菌攜帶的毒力基因數目高于CRISPR?菌株,這與Palmer 等[21] 的研究一致,說明在外源基因獲取壓力下,CRISPR/Cas 系統往往處于失活狀態。
細菌耐藥性的產生主要依賴于耐藥基因的水平轉移,CRISPR/Cas 系統是否能夠限制耐藥、毒力基因的水平轉移,不同研究有不同的報道。有研究表明,一些種類的細菌幾乎不攜帶CRISPR/Cas 系統[22];同時,也有相關研究表明,宿主菌可以通過丟失CRISPR 結構來獲得高度有益的外源DNA[23]。
Touchon 等[24] 分析了263 株大腸埃希菌的CRISPR/Cas 系統,對CRISPR 結構與耐藥性的關系進行了分析,結果表明,CRISPR 結構的存在并不能阻止耐藥基因和質粒的水平轉移。洪麗娟等[25] 發現志賀菌中CRISPR 結構對菌株耐藥基因和耐藥表型均無影響。然而,張蒙蒙等[16] 發現葡萄球菌基因組中CRISPR/Cas 系統攜帶率低,且基因座、Cas 基因的結構和功能均不完善,僅較少的菌株中含有完整的CRISPR/Cas 系統,完整的葡萄球菌CRISPR/Cas 系統可能限制mecA 基因的水平轉移。Palmer 等[21] 發現CRISPR/Cas 系統的存在限制了糞腸球菌中來自可移動元件的耐藥基因間的水平傳播。Marraffini等[15] 通過試驗證明葡萄球菌RP62a 的CRISPR/Cas系統能夠抵御噬菌體的入侵。同時,Watson 等[26] 研究表明CRISPR/Cas 系統可以通過轉導增強基因的水平轉移。對于CRISPR 結構與毒力基因的關系,Wiedenheft 等[27] 研究表明銅綠假單胞菌CRISPR/Cas 系統的存在與小鼠中某些毒力基因的表達密切相關。
3.2 結論
本研究通過對公共數據庫金葡菌基因組中CRISPR/Cas 系統、耐藥基因和毒力基因進行比對分析,并利用實驗室金葡菌基因組進行驗證,發現金葡菌中CRISPR 結構的存在可能影響金葡菌耐藥、毒力基因的水平轉移。CRISPR?菌株攜帶更多的原噬菌體序列,表明CRISPR?菌株更容易受到噬菌體和可移動質粒的干擾。本研究結果對進一步研究金葡菌耐藥基因和毒力基因的傳播有參考意義。
參考文獻:
CHEN L, TANG Z Y, CUI S Y, et al. Biofilm productionability, virulence and antimicrobial resistance genesin Staphylococcus aureus from various veterinary hospitals[J]. Pathogens, 2020, 9(4): 264. doi: 10.3390/pathogens9040264.
SHOPSIN B, KREISWIRTH B N. Molecular epidemiologyof methicillin-resistant Staphylococcus aureus[J].Emerging Infectious Diseases, 2001, 7(2): 323-326.
KRISHNA S, MILLER L S. Host-pathogen interactionsbetween the skin and Staphylococcus aureus[J]. CurrentOpinion Microbiology, 2012, 15(1): 28-35.
毛婷婷. 金黃色葡萄球菌CRISPR 結構及耐藥毒力分子特征[D]. 鄭州: 鄭州大學, 2019.
LINDSAY J A. Staphylococcus aureus genomics and theimpact of horizontal gene transfer[J]. International Journalof Medical Microbiology, 2014, 304(2): 103-109.
ANITHA P, ANBARASU A, RAMAIAH S. Gene networkanalysis reveals the association of important functionalpartners involved in anti-biotic resistance: A reporton an important pathogenic bacterium Staphylococcusaureus[J]. Gene, 2016, 575(2): 253-263.
左祥, 查艷景, 王征. 金黃色葡萄球菌的臨床分布及耐藥基因研究[J]. 中國病原生物學雜志, 2017, 12(6): 566-569.
ITO T, OKUMA K, MA X X, et al. Insights on antibioticresistance of Staphylococcus aureus from its wholegenome: Genomic island SCC[J]. Drug Resistance Updates,2003, 6(1): 41-52.
ITO T, KATAYAMA Y, HIRAMATSU K. Cloning andnucleotide sequence determination of the entire mecDNA of pre-methicillin-resistant Staphylococcus aureusN315[J]. Antimicrobial Agents and Chemotherapy, 1999,43(6): 1449-1458.
KATAYAMA Y, ITO T, HIRAMATSU K. A new classof genetic element, staphylococcus cassette chromosomemec, encodes methicillin resistance in Staphylococcusaureus[J]. Antimicrobial Agents and Chemotherapy,2000, 44(6): 1549-1555.
LIU J, CHEN D, PETERS B M. Staphylococcal chromosomalcassettes mec (SCCmec): A mobile genetic elementin methicillin-resistant Staphylococcus aureus[J].Microbial Pathogenesis, 2016, 101: 56-67.
SZCZEPANIK A, KOZIOL-MONTEWKA M, Al-DOORI Z, et al. Spread of a single multiresistant methicillin-resistant Staphylococcus aureus clone carrying avariant of staphylococcal cassette chromosome mec typeIII isolated in a university hospital[J]. European Journalof Clinical Microbiology & Infectious Diseases, 2007,26(1): 29-35.
BARRANGOU R, FREMAUX C, DEVEAU H, et al.CRISPR provides acquired resistance against viruses inprokaryotes[J]. Science, 2007, 315(5819): 1709-1712.
SOREK R, KUNIN V, HUGENHOLTZ P. CRISPR: Awidespread system that provides acquired resistanceagainst phages in bacteria and archaea[J]. Nature ReviewsMicrobiology, 2008, 6(3): 181-186.
MARRAFFINI L A, SONTHEIMER E J. CRISPR interferencelimits horizontal gene transfer in staphylococciby targeting DNA[J]. Science, 2008, 322(5909): 1843-1845.
張蒙蒙, 畢春霞, 王夢圓, 等. 葡萄球菌CRISPR-Cas 系統的基因結構及其與耐藥基因的關系[J]. 中國病原生物學雜志, 2019, 14(5): 553-559.
ISHINO Y, SHINAGAWA H, MAKINO K, et al. Nucleotidesequence of the iap gene, responsible for alkalinephosphatase isozyme conversion in Escherichia coli, andidentification of the gene product[J]. Journal of Bacteriology,1987, 169(12): 5429-5433.
LUO K, SHAO F, KAMARA K N, et al. Molecular characteristicsof antimicrobial resistance and virulence determinantsof Staphylococcus aureus isolates derivedfrom clinical infection and food[J]. Journal of ClinicalLaboratory Analysis, 2018, 32(7): e22456.
GOPHNA U, KRISTENSEN D M, WOLF Y I, et al. Noevidence of inhibition of horizontal gene transfer by CR-
ISPR-Cas on evolutionary timescales[J]. ISME Journal,2015, 9(9): 2021-2027.
BOLOTIN A, QUINQUIS B, SOROKIN A, et al.Clustered regularly interspaced short palindrome repeats(CRISPRs) have spacers of extrachromosomal origin[J].Microbiology-SGM, 2005, 151(8): 2551-2561.
PALMER K L, GILMORE M S. Multidrug-resistant enterococcilack CRISPR-cas[J]. mBio, 2010, 1(4): e00227-10.
BURSTEIN D, SUN C L, BROWN C T, et al. Majorbacterial lineages are essentially devoid of CRISPR-Casviral defence systems[J]. Nature Communications, 2016,7: 10613. doi: 10.1038/ncomms10613.
JIANG W, MANIV I, ARAIN F, et al. Dealing with theevolutionary downside of CRISPR immunity: Bacteriaand beneficial plasmids[J]. PLoS Genetics, 2013, 9(9):e1003844.
TOUCHON M, CHARPENTIER S, POGNARD D, et al.Antibiotic resistance plasmids spread among natural isolatesof Escherichia coli in spite of CRISPR elements[J].Microbiology, 2012, 158(Pt 12): 2997-3004.
洪麗娟, 張冰, 段廣才, 等. CRISPR/Cas 系統與志賀菌毒力和耐藥的關系及插入序列IS600 對cse2 表達水平的影響[J]. 微生物學報, 2016, 56(12): 1912-1923.
WATSON B N J, STAALS R H J, FINERAN P C. CRISPR-Cas-mediated phage resistance enhances horizontalgene transfer by transduction[J]. mBio, 2018, 9(1):e02406-17.
WIEDENHEFT B, BONDY-DENOMY J. CRISPR controlof virulence in Pseudomonas aeruginosa[J]. Cell Research,2017, 27(2): 163-164.
【責任編輯 李慶玲】

