不同來源葡萄種質(zhì)資源果實(shí)葉酸含量及ISSR比較分析
梁 雎,劉國宏,王保民,何 橋,阿布來克·尼亞孜,郭紅梅,李興婷,,任紅松
(1.新疆農(nóng)業(yè)科學(xué)院吐魯番農(nóng)業(yè)科學(xué)研究所,新疆吐魯番 838000;2.中國農(nóng)業(yè)大學(xué),北京 100083;3.西南大學(xué),重慶 400700)
0 引 言
【研究意義】葉酸是人體生命活動必需的水溶性B族維生素,其分子由蝶啶、對氨基苯甲酸和谷氨酸殘基三部分組成[1-2]。根據(jù)取代基的不同,葉酸分為不同的種類,目前在動植物中已發(fā)現(xiàn)的葉酸種類有50多種[3-4]。葉酸缺乏會引發(fā)巨幼紅細(xì)胞貧血等疾病[5-7]。與水稻、谷子等作物相比,蔬菜、水果中葉酸含量較高[8-14]。由于蔬菜等在烹飪加熱過程會導(dǎo)致葉酸降解[15-17],而葡萄以鮮食為主,能使其含有的葉酸最大限度地保留,且與其他水果比較葡萄還含有天然葡萄糖,可促進(jìn)葉酸在人體的吸收[18]。葡萄是我國重要的大宗水果,面積約為72.51×104hm2,產(chǎn)量達(dá)到1 419.54×104t,其中新疆葡萄面積約為14.393×104hm2,產(chǎn)量達(dá)到270.57×104t[19-20]。利用ELISA檢測和ISSR分子標(biāo)記技術(shù),研究并提出一種從分子水平評價(jià)和篩選高葉酸葡萄種質(zhì)資源的方法,對高葉酸葡萄種質(zhì)資源的充分利用有實(shí)際意義。【前人研究進(jìn)展】較早的葉酸檢測方法為比色法,該方法靈敏度高,但實(shí)驗(yàn)周期長,批次間檢測結(jié)果重復(fù)性差,檢測結(jié)果受樣品中所含抗葉酸藥物或抗生素成分的影響較大。隨后采用高效液相色譜檢測成為葉酸檢測的主流技術(shù),儀器分析方法重復(fù)性好,檢測限低,可進(jìn)行多種物質(zhì)的同時(shí)檢測,但是儀器檢測對樣品前處理要求嚴(yán)格,儀器昂貴,需要專業(yè)的操作分析人員。不論是比色法、微生物分析或是儀器分析,都難以進(jìn)行大量樣品的高通量檢測。而對于葡萄種質(zhì)資源篩選,大量材料的選擇是關(guān)鍵步驟,實(shí)現(xiàn)大量材料的快速篩選,有利于品種篩選的推進(jìn),否則,將會影響品種篩選的效率[21-28]。目前,免疫檢測(酶聯(lián)免疫吸附檢測ELISA)是特異、快速、高通量檢測植物活性物質(zhì)的常用方法之一。該方法已經(jīng)應(yīng)用于植物激素、營養(yǎng)物質(zhì)、生長因子等的檢測。Yue等制備單克隆抗體,建立ELISA方法進(jìn)行玉米中5-甲酰四氫葉酸含量的檢測。對不同玉米品種中的葉酸含量進(jìn)行檢測,可以對大批量品種進(jìn)行有效的葉酸含量初篩[29];對山西谷子資源葉酸含量分析與評價(jià)的研究結(jié)果,解釋了葉酸含量的變異與地理分布的關(guān)系,通過檢查分析篩選出24份高含量葉酸谷子品種[28]。韓娟英等[10]報(bào)道了富含葉酸水稻研究進(jìn)展,收集了塞拉利昂、圭亞那等的水稻種質(zhì)資源。通過轉(zhuǎn)基因技術(shù)培育出高葉酸含量的番茄,對蔬菜中番茄資源葉酸含量進(jìn)行了檢測和評價(jià),對高含量番茄品種已經(jīng)進(jìn)入了實(shí)際利用階段[30];綠葉蔬菜等天然葉酸在人的腸道中被吸收,而合成葉酸是在肝臟內(nèi)被吸收的。肝臟吸收合成葉酸的量有限,未被吸收的過量合成葉酸會進(jìn)入血液[31],葡萄本身就含有一定含量葉酸,且葡萄還含有大量天然葡萄糖[8-24],葡萄是天然葉酸篩選的優(yōu)勢果樹。利用現(xiàn)代先進(jìn)的酶聯(lián)免疫檢測技術(shù)檢測、評價(jià)和篩選出高含量天然葉酸葡萄種質(zhì)資源加以開發(fā)利用;目前用于葡萄種質(zhì)資源鑒定的分子標(biāo)記主要有:RFLP、RAPD、AFLP、SSR等,ISSR(Inter-simple sequence repeat polymor-phic DNA) 分子標(biāo)記是一種基于微衛(wèi)星序列發(fā)展起來的新的分子標(biāo)記[31], 來源于植物基因組中豐富的簡單序列重復(fù) (SSRs),基本原理是用錨定的微衛(wèi)星 DNA 為引物,即在 SSR 序列的 3′端或57′端加上2~4個(gè)隨機(jī)核苷酸,由此組成的單引物進(jìn)行重復(fù)序列間DNA的PCR 擴(kuò)增 。ISSR分子標(biāo)記具有簡單迅速、穩(wěn)定高效、DNA 多態(tài)性高的特點(diǎn),克服了SSR的強(qiáng)特異性,可以在不同物種間通用,同時(shí)又克服了RFLP 技術(shù)的局限性和RAPD的假陽性等優(yōu)點(diǎn)。 【本研究切入點(diǎn)】高含量天然葉酸葡萄種質(zhì)資源評價(jià)、篩選和利用基礎(chǔ)研究尚未見報(bào)道,需應(yīng)用ELISA和ISSR標(biāo)記技術(shù),比較分析22份葡萄種質(zhì)資源果實(shí)進(jìn)行大通量葉酸檢測、遺傳多樣性與親緣關(guān)系。【擬解決的關(guān)鍵問題】建立檢測葡萄種質(zhì)資源果實(shí)的ELISA技術(shù)體系,建立葡萄種質(zhì)資源ISSR 分子標(biāo)記技術(shù)體系,在大量葡萄種質(zhì)資源中評價(jià)和篩選出高含量葉酸葡萄材料。
1 材料與方法
1.1 材 料
1.1.1 ELISA材料
1.1.1.1 葡萄果實(shí)
材料來源于新疆農(nóng)業(yè)科學(xué)院吐魯番農(nóng)業(yè)科學(xué)研究所葡萄種質(zhì)資源圃(新疆吐魯番市高昌區(qū)原種場內(nèi),N 42° 53′24.007 2″,E 89°18′29.084 4″),于2018年8月采集22份葡萄種質(zhì)資源果實(shí),用保鮮袋編號封存后置于冰盒送至中國農(nóng)業(yè)大學(xué)實(shí)驗(yàn)室,樣品至實(shí)驗(yàn)室后液氮速凍后置于-80℃冰箱中保存,以備檢測葉酸含量。其中包括 6份歐美雜種品種,16份歐亞種品種[32-52]。 試驗(yàn)在中國農(nóng)業(yè)大學(xué)實(shí)驗(yàn)室進(jìn)行。表1
1.1.1.2 主要儀器
洗板機(jī)(普朗集團(tuán));酶標(biāo)儀(Thermo Multiskan);紫外可見分光光度計(jì)(Angilent);渦旋攬拌器(北京鼎國);微量移液器(大龍興創(chuàng)實(shí)驗(yàn)儀器公司);磁力攬拌器(大地自動化儀器廠);微量髙速離心機(jī)(Eppendorf);分析天平(Sartourius);pH儀(Mettler toledo)。
1.1.2 ISSR材料
1.1.2.1 葡萄葉片
于上述地點(diǎn)2019年5月采集22份葡萄種質(zhì)資源幼嫩葉片,用保鮮袋編號封存后置于冰盒快遞送至重慶西南大學(xué)實(shí)驗(yàn)室,樣品至實(shí)驗(yàn)室后液氮速凍后置于-80℃冰箱中保存,以備提取DNA。其中包括 6份歐美雜種品種,16份歐亞種品種。試驗(yàn)在重慶西南大學(xué)實(shí)驗(yàn)室進(jìn)行。表1
1.1.2.2 ISSR主要試劑
(1)DNA 提取:PVP(聚乙烯吡咯烷酮),去糖緩沖液(成分終濃度:1 mol/L NaCl,0.4 mol/L 葡萄糖,2%PVP,0.1 mol/L(pH=8)Tris-HCl),蛋白酶(10 mg/mL),β-巰基乙醇,CTAB(成分終濃度:1.4 mol/L NaCl,2%PVP,0.02 mol/L EDTA,0.1 mol/L Tris-HCl,2% CTAB),醋酸鉀,氯仿∶異戊醇(24∶1),無水乙醇,RNA 酶,無菌水,10×loading buffer。

表1 基于 ISSR 分析的22份葡萄種質(zhì)資源
(2)PCR 擴(kuò)增:2.5 mM dNTPs,5U/μL rTaq,15 mM 10×buffer(Mg2+),ddH2O。
(3)樣本檢測:30%丙烯酰胺(29 g Acr,1 gBis 溶于 100 mL 去離子 H2O 中),5×TBE(27.5 g 硼酸,54 g Tris,10 mL 0.5 mol/L EDTA 定容至 1 L),TEMEDA,10%APS(1 g 過硫酸銨溶于 10 mL 去離子水),固定液(1 g AgNO3,100 mL 無水乙醇,5 mL冰醋酸,定容至 1 000 mL),顯色液(14 g NaOH,2.5 mL 甲醛,定容至 1 000 mL),瓊脂糖,溴化乙錠。
1.1.2.3 主要儀器
研缽,微量移液器(Eppendorf),制冰機(jī)(SANYO),臺式離心機(jī)(Eppendorf),恒溫水浴鍋(Shellab),恒溫儀,真空離心干燥儀(Eppendorf),核酸蛋白檢測儀 NANODROP2000(Thermo),凝膠成像系統(tǒng) GelDocTmXR+imagingsystem(BIO-RAD),Veriti PCR 儀(ABI),C1000 Touch PCR 儀(BIO-RAD),垂直板電泳槽(北京六一儀器廠 DYCZ-30C),水平板電泳槽(北京六一儀器廠DYCP-31E),普通電泳系統(tǒng)(BIO-RAD)。
1.2 方 法
1.2.1 ELISA方法
1.2.1.1 ELISA主要試劑
包被抗原葉酸-BSA、葉酸單克隆抗體和HRP-羊抗鼠IgG由中國農(nóng)業(yè)大學(xué)作物化學(xué)控制中心提供,5-甲酰四氫葉酸標(biāo)準(zhǔn)樣品購自美國Sigma公司,其他化學(xué)試劑均購自北京化學(xué)試劑公司。
1.2.1.2 最適工作條件
采用棋盤格法確定包被抗原以及抗體最佳稀釋倍數(shù),以獲得最佳抑制曲線。(1)用包被緩沖液(Na2CO3-NaHCO3緩沖液,0.01 M,pH 9.6)將包被抗原葉酸-BSA(1 mg/mL)稀釋1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000五個(gè)濃度,分別向酶標(biāo)板上每孔加入100 μL,37℃溫育3 h,棄包被液,用洗液(0.01 M 的Na2HPO4- KH2PO4緩沖液,pH 7.5,含0.1% 吐溫-20)洗板3次,甩干。(2)葉酸單抗(1 mg/mL)用樣品稀釋液(0.01 M 的Na2HPO4- KH2PO4緩沖液,pH 7.5,含0.1% 吐溫-20及1 g/L明膠)稀釋成1∶1 000、1∶2 000、1∶4 000、1∶8 000 四個(gè)濃度,分別向上述不同濃度抗原孔中加入50 μL/孔,形成棋盤格。同時(shí),每個(gè)抗原-抗體濃度組合分別加入50 μL的葉酸標(biāo)準(zhǔn)液2 000和0 ng/mL兩個(gè)濃度。37℃溫育30 min,洗液洗板4次。(4)加入0.1 μg/mL 的HRP-羊抗鼠IgG,每孔100 μL,37℃溫育30 min,洗板3次。(5)加OPD底物溶液,每孔100 μL,避光顯色10 min。加2 M H2SO4,每孔50 μL終止顯色反應(yīng)。用酶聯(lián)免疫檢測儀在492 nm測定各孔光密度(OD)值。
1.2.1.3 標(biāo)準(zhǔn)曲線的建立
包被抗原用包被緩沖液稀釋至工作濃度,加入酶標(biāo)板100 μL/孔,37℃溫育3 h,棄包被液,洗液洗板3次。將50 μL不同濃度(0、3.125、6.25、12.5、25、50、100、200 ng/mL) 的葉酸標(biāo)準(zhǔn)液加入酶標(biāo)板,每個(gè)濃度重復(fù)3次,再加入50 μL稀釋至工作濃度的葉酸單抗溶液,37℃溫育30 min,洗板3次。每孔加入100 μL 0.1 μg/mL的HRP-羊抗鼠IgG,37℃溫育30 min,棄液后洗板3次。每孔加入100 μL OPD底物溶液,避光顯色10 min,每孔加50 μL 2 M H2SO4后于492 nm波長下測各孔OD值。將含0 ng/mL 葉酸標(biāo)準(zhǔn)品孔的OD值設(shè)為B0,其余孔OD值為B。標(biāo)準(zhǔn)品濃度的自然對數(shù)為橫坐標(biāo),B/B0值為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線。
1.2.1.4 樣品葉酸提取
采用乙酸乙酯對樣品進(jìn)行提取,稱取0.5 g新鮮植物材料,加2 mL飽和食鹽水,研磨成勻漿,轉(zhuǎn)入10 mL離心管,渦旋30s,再加入5 mL乙酸乙酯提取,充分震蕩后靜置10 min,吸取3 mL上層有機(jī)相,轉(zhuǎn)入新的10 mL離心管中,用氮?dú)獯蹈?用2.5 mL樣品稀釋液定容,再稀釋至合適濃度即為待測液。
1.2.2 ISSR方法
1.2.2.1 基因組 DNA 提取
基因組DNA提取參照改良 CTAB 法, 從葡萄幼葉中提取基因組DNA ,0.8% 瓊脂糖凝膠電泳檢測,使用核酸檢測儀檢測DNA 濃度和純度,并將濃度稀釋至20 ng/mL。
1.2.2.2 DNA 擴(kuò)增和電泳
采用 20 μL 反應(yīng)體系 ,其中包括 2 μL模板DNA ,2.0 μL Buffer, 0.7 μL引物,0.4 μLTap酶,1.6 μL dNTPs , 13.3 μLDDH2O。
用于ISSR-PCR反應(yīng)的dNTP、Taq 酶、標(biāo)準(zhǔn)分子量(Marker) DI2000 購自北京全式金生物技術(shù)有限公司,引物來自加拿大哥倫比亞大學(xué)(UBC)提供的ISSR引物序列[3],由杭州生工公司合成。
PCR 反應(yīng)程序?yàn)?94℃ 預(yù)變性1.5 min ,94℃ 變 性 40 s,53℃ 退火1 min , 72℃ 延伸 1.5 min , 進(jìn)行 40個(gè)循環(huán) , 最后 72℃ 延伸 5 min, 4℃保存。PCR 反應(yīng)在德國Biometra公司生產(chǎn)的Tl型PCR循環(huán)儀上進(jìn)行。擴(kuò)增產(chǎn)物經(jīng)0.8%瓊脂糖凝膠電泳分離,將電泳產(chǎn)物在凝膠成像系統(tǒng)(BIO-RAD molecalar imager cel doc xr +)的紫外燈下觀察、照相并保存圖片。
1.3 數(shù)據(jù)處理
1.3.1 ELISA
依據(jù)葉酸標(biāo)準(zhǔn)曲線將所測OD值帶入計(jì)算所測樣品葉酸含量。
1.3.2 ISSR
根據(jù)各分子標(biāo)記在相同電泳遷移率(相同分子量片段)的有無統(tǒng)計(jì)得到所有位點(diǎn)的二元數(shù)據(jù),有DNA 擴(kuò)增帶記為1,無帶記為0。利用NT-SYSpc2.10e軟件進(jìn)行Jaccard相似性系數(shù)分析,并通過非加權(quán)配對算術(shù)平均法(UPGMA) 進(jìn)行聚類分析,建立親緣關(guān)系圖。
2 結(jié)果與分析
2.1 22份葡萄種質(zhì)資源果實(shí)葉酸含量方差變化
研究表明,葉酸含量均值黑奇無核最高,為46.953 4 ng/g;其與紅巴拉多、炎興無核無顯著差異;其與紅寶石、夏黑、達(dá)米拉、本納格、蜜紅、無核紫、瑞都翠霞、宇選1號、京密、里扎馬特、洛浦早生、粉紅亞都蜜、雜1、美人指、無核白、紅標(biāo)無核、1124、京翠有顯著差異;該批檢測的葡萄種質(zhì)資源中葉酸含量最低的是京翠,為5.039 4 ng/g;歐亞種的葉酸含量平均為17.234 9 ng/g,歐美雜種的為13.236 2 ng/g,歐亞種的葉酸含量較歐美雜種高3.998 7 ng/g。表2,圖1
2.2 ISSR多態(tài)性
研究表明,9 條引物共擴(kuò)增出78條帶,其中多態(tài)性條帶70 條,多態(tài)性百分率 89.7%。單條引物擴(kuò)增的條帶為4~13條,平均 8條。擴(kuò)增產(chǎn)物長度介于250~3 000 bp,以500~2 000 bp的擴(kuò)增片段居多。擴(kuò)增條帶數(shù)最多的引物為BC881,達(dá)13條,多態(tài)性百分率為100%,引物 BC856,BC811擴(kuò)增條帶數(shù)最少,均為4條。其中多態(tài)性百分率最高的還有BC815和 BC834,達(dá)100%,最低的為BC811,為25%。 表3,圖1

表2 22份葡萄種質(zhì)資源果實(shí)葉酸含量的方差變化
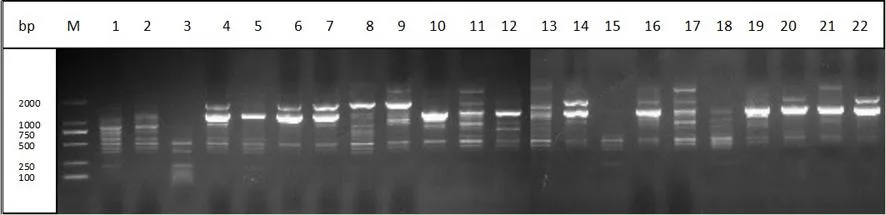
圖1 ISSR 引物 881 對葡萄種質(zhì)資源的擴(kuò)增結(jié)果 Fig.1 Amplification profile of ISSR prime881 with part of samples

表3 不同引物的堿基序列及擴(kuò)增結(jié)果
2.3 22 份葡萄種質(zhì)資源親緣關(guān)系
研究表明, 22 份葡萄材料的遺傳相似系數(shù)為 0.474 4~0.846 2 ,平均遺傳相似系數(shù)為0.654 5,其中無核紫與宇選1號、木納格與力扎馬特的遺傳相似系數(shù)最大,均為 0.846 2 。宇選 l號與木納格的遺傳相似系數(shù)最小,為 0.474 4 。
在遺傳相似系數(shù)為 0.621處,22份葡萄材料明顯分為 2 大類群。第 1 大類包含1個(gè)歐亞種(紅巴拉多),其余為第 2大類。在遺傳相似系數(shù)為 0.622處 ,21份葡萄材料又明顯分為 2 大類群。 第 1 大類包含11個(gè)歐亞種(炎興無核、灰比諾、瑞都翠霞、京蜜、黑奇無核、無核白、1124、京翠、紅寶石、無核紫、達(dá)米娜),6個(gè)歐美雜種 (雜1、夏黑、蜜紅、紅標(biāo)無核、洛浦早生、宇選1號);第2大類包含4個(gè)歐亞種(美人指、粉紅亞都蜜、木納格、里扎馬特)。 圖2
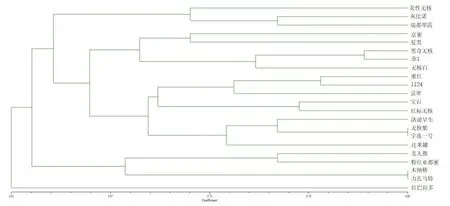
圖2 22 份葡萄種質(zhì)資源親緣關(guān)系樹狀圖Fig.2 UPGMA dendrogram of 22 vitis varieties determined
2.4 22份葡萄種質(zhì)資源聚類后葉酸含量
研究表明,在遺傳相似系數(shù)為 0.621處,22份葡萄材料明顯分為 2 大類群。第 1 大類葉酸含量平均為35.79 ng/g;,其余為第 2大類,葉酸含量平均為15.71 ng/g。在遺傳相似系數(shù)為 0.622處 ,21份葡萄材料又明顯分為 2 大類群。 第 1 大類葉酸含量平均為16.53 ng/g;第2大類葉酸含量平均為12.24 ng/g。 群體1的葉酸含量比群體2的葉酸含量高。圖3

圖3 22份葡萄種質(zhì)資源聚類后葉酸含量Fig.3 Analysis of folic acid content of 22 grape germplasm resources after clustering
3 討 論
3.1目前,建立葉酸酶聯(lián)免疫吸附檢測(ELISA)已有較多報(bào)道,楊霈瑤[21]報(bào)道了葉酸競爭抑制ELISA檢測方法的建立,通過碳二亞胺法,將葉酸和牛血清白蛋白、雞卵清白蛋白分別偶聯(lián)合成了葉酸免疫原(FA-BSA、FA.BSA.ACA)和包被原(FA-OVA),利用FA-BSA免疫家兔制備多克隆抗體,在純化抗體的基礎(chǔ)上建立葉酸間接ELISA檢測方法并制作標(biāo)準(zhǔn)曲線;劉小軍[53]利用酶聯(lián)免疫技術(shù)研制一種快速檢測食品中的葉酸試劑盒,經(jīng)過測試,該試劑盒對牛奶樣本的檢測限為 10.0 μg/L。建立ELISA方法進(jìn)行玉米中5-甲酰四氫葉酸含量的檢測。Yue等[29]制備單克隆抗體,對不同玉米品種中的葉酸含量進(jìn)行檢測,可以對大批量品種進(jìn)行的有效的葉酸含量初篩。李貞[54]建立了牛奶中葉酸檢測的酶聯(lián)免疫反應(yīng)方法,并對其葉酸本底含量測定。用競爭性酶聯(lián)免疫,棋盤法確定最佳抗體包被條件、封閉條件、酶標(biāo)抗原濃度等,并進(jìn)行性能評價(jià)測定,檢測 80 例牛奶樣品中的葉酸本底含量。牛奶樣本葉酸本底含量范圍為12.55~68.72 μg/mL,均值37.93 μg/mL;解鑫[55]用酶聯(lián)免疫法的試劑盒對代表性乳粉樣品進(jìn)行3d3平行檢測,對檢測數(shù)據(jù)做正態(tài)分布分析及不確定度計(jì)算,結(jié)果表明,酶聯(lián)免疫方法不確定度范圍為 9.6%~31.3%。此方法的最低檢測限為2.22 μg/mL;李江[56]建立一種檢測奶粉中葉酸質(zhì)量分?jǐn)?shù)的酶聯(lián)免疫分析方法,結(jié)果表明,當(dāng)加標(biāo)質(zhì)量分?jǐn)?shù)為20,40和80 μg/kg時(shí),空白基質(zhì)奶粉中葉酸的提取回收率為93.5%~118.0%;非空白基質(zhì)樣品中葉酸的加標(biāo)回收率為88%~92%;方法檢出限為4 μg/kg。
3.2王發(fā)明等[57]對廣西桂林的 17 份野生毛葡萄種質(zhì)和 41 份栽培葡萄種質(zhì),使用12條ISSR引物進(jìn)行了遺傳多樣性和親緣關(guān)系檢測。聚類分析表明41份葡萄資源中,京亞、香玉、藤稔等 11 個(gè)品種聚為一類,克倫森、夏黑、紅玫瑰等6個(gè)品種聚為一類,群體遺傳分析表明,ISSR分子標(biāo)記可以產(chǎn)生豐富的遺傳多態(tài)性位點(diǎn),可以有效地應(yīng)用于葡萄種質(zhì)遺傳多樣性研究上。張富民等[58]利用ISSR分子標(biāo)記技術(shù)對福建省各葡萄種植區(qū)收集到的196份葡萄資源進(jìn)行親緣關(guān)系鑒定。聚類分析表明,196份葡萄資源可以分為3大類,即東亞種群、歐美雜種和歐亞種;群體遺傳分析表明,葡萄資源種內(nèi)存在豐富的遺傳多樣性。吳子龍等[59]利用ISSR標(biāo)記對l5份葡萄材料進(jìn)行了基因組多態(tài)性分析,結(jié)果表明山葡萄與歐亞種 、美洲雜種葡萄的親緣關(guān)系較遠(yuǎn),歐亞種與美洲雜種之間親緣關(guān)系較近。張永福等[60]利用 ISSR 分子標(biāo)記技術(shù)對彌勒市8個(gè)主栽葡萄品種進(jìn)行基因組多態(tài)性檢測,聚類分析表明,8 份試材中玫瑰蜜、水晶、紅玫瑰等分為第 1 大類,紅地球、競秀、青提等為第2大類。 唐宇宏等[61]采用ISSR技術(shù)對黑龍江省西部地區(qū)葡萄的9個(gè)品種進(jìn)行親緣關(guān)系的研究,聚類分析結(jié)果可分出歐亞種和美洲種 。 張永輝等[62]利用ISSR 標(biāo)記對81份葡萄資源進(jìn)行分類研究,將供試材料毛葡萄 1 099 確定為桑葉葡萄,對葡萄進(jìn)行重新分類。崔鵬等[63]用ISSR 標(biāo)記研究南方45個(gè)葡萄主要栽培品種的遺傳多樣性和親緣關(guān)系。聚類分析將 45 個(gè)供試品種分為兩個(gè)類群,歐亞種群和歐美雜種群。吳代東等[64]用 ISSR 標(biāo)記研究36份抗病性不同的葡萄種質(zhì),聚類分析將 36 個(gè)供試品種分為兩個(gè)類群,第一類包含9個(gè)品種分別為:雷司令、刺水 14、黑珍珠4號等; 第二類包含27個(gè)品種,包括水源12號、水源4號、金 1等。 陳小宇等[65]用 ISSR 標(biāo)記研究蛇龍珠8個(gè)新株系的親緣關(guān)系和遺傳多樣性,聚類分析表明,蛇龍珠E06與其他7個(gè)株系有差異,另外7個(gè)株系聚為一類。賴呈純等[66]利用 ISSR 分子標(biāo)記技術(shù)對 95 份葡萄品種(系) 資源進(jìn)行遺傳多樣性和親緣關(guān)系分析; 聚類分析結(jié)果表明,95 份葡萄資源劃分為3大類,分別為歐亞種、歐美雜種和東亞種群,這與葡萄傳統(tǒng)分類結(jié)果一致。李琳等[31]利用 ISSR 標(biāo)記對 24 份葡萄材料進(jìn)行了基因組多態(tài)性分析,聚類分析結(jié)果表明,24 份葡萄材料明顯分為2 大類群,第 1 類包含10個(gè)歐美雜種、7個(gè)歐亞種、1個(gè)華歐雜種,第2 類包含3個(gè)美洲雜交種、1個(gè)河岸葡萄 、1個(gè)冬葡萄、1個(gè)東亞葡萄。 美洲雜交種與歐美雜種 、 歐亞種葡萄的親緣關(guān)系較遠(yuǎn),歐美雜種與歐亞種葡萄之間親緣關(guān)系較近。
4 結(jié) 論
在遺傳相似系數(shù)為 0.621處,22份葡萄材料明顯分為 2 大類群。第 1 大類葉酸含量平均為35.79 μg/g;其余為第 2大類,葉酸含量平均為15.71 μg/g。在遺傳相似系數(shù)為 0.622處 ,21份葡萄材料又明顯分為 2 大類群。第1大類葉酸含量平均為16.53 μg/g;第2大類葉酸含量平均為12.24 μg/g。歐亞種的folic acid含量較歐美雜種稍高3.998 7 μg/g;群體1的葉酸含量比群體2的葉酸含量高。歐亞種的葉酸含量較歐美雜種稍高;在遺傳相似系數(shù)為0.621處,22份葡萄材料明顯分為2大類群。第1大類包含1個(gè)歐亞種(紅巴拉多),其余為第2大類。在遺傳相似系數(shù)為 0.622處 ,21份葡萄材料又明顯分為2大類群。第1大類包含11個(gè)歐亞種(炎興無核、灰比諾、瑞都翠霞、京蜜、黑奇無核、無核白、1124、京翠、紅寶石、無核紫、達(dá)米娜),6個(gè)歐美雜種 (雜1、夏黑、蜜紅、紅標(biāo)無核、洛浦早生、宇選1號)。第2大類包含4個(gè)歐亞種(美人指、粉紅亞都蜜、木納格、里扎馬特);ISSR標(biāo)記在葡萄種質(zhì)資源鑒定方面有較高的分辨能力。

