丙烯酸接枝改性氧化石墨烯及其對Ce(Ⅲ)的吸附性能研究*
劉遵義,譚 磊,曲 靜,楊 卉,郝 燕
(內蒙古科技大學 化學與化工學院,內蒙古 包頭 014010)
0 引 言
稀土元素被廣泛應用于陶瓷[1]、農業[2]、醫療[3]、能源[4]、催化[5]等領域,在眾多稀土元素中,鈰(Ce)在醫療、催化、探測器、發光材料等行業都有廣泛應用[6-7]。然而,稀土在開采和生產過程中產生的廢水會影響生態環境,增加生物毒性并抑制光合作用[2,8-10]。以我國內蒙古包頭市白云鄂博礦稀土礦為例,該地區稀土中富含La、Ce、Sm和Eu等輕稀土元素,但是由于大規模的開采和加工稀土,導致包頭市周圍的土壤、粉塵、地下水中包含了很多輕稀土元素[11-12],研究表明在各種稀土元素污染物中Ce的含量位居首位[13]。土壤、粉塵、地下水中含有過量的Ce會危害生物健康,影響農作物生長[14-15],若通過食物鏈或皮膚吸收途徑進入人體,還會造成神經系統損害,誘導組織特異性生物累積,進而引起肝、肺和腦損傷[16-17]。Dahle等[15]通過研究氧化鈰納米粒子對土壤反硝化過程的亞慢性毒性,對比了Ce(Ⅲ)與Ce(Ⅳ)兩種不同價態的Ce對生態系統的毒性大小,結果表明當濃度相同時,可溶性Ce(Ⅲ)的毒性遠大于Ce(Ⅳ)。因此,處理土壤、水體中的稀土污染物Ce(Ⅲ)顯得格外重要。
目前,處理稀土污染物的方法主要有電化學法[18]、生物處理法[19]、膜分離法[20]和吸附法[21]等。上述各種方法中,吸附法由于具有簡單高效、可操作性強、無二次污染等優點[22],近年來被廣泛應用于處理稀土污染物。Babu等[23]利用N-[(3-三甲氧基硅基)丙基]乙二胺三乙酸(TMS-EDTA)對氧化活性炭(AC)進行功能化改性,合成了一種EDTA功能化活性炭(EDTA-AC),該材料用于吸附稀土離子Nd(Ⅲ)時,吸附量為71.42 mg/g,約為純AC吸附量的4倍,而且該方法成本低、易于合成。
用于吸附處理稀土污染物的傳統吸附材料主要以活性炭、沸石、樹脂等材料為主[24],這些材料在使用時具有一定的局限性,比如吸附容量有限、吸附速率低、易造成環境二次污染等[25]。與之相比,氧化石墨烯(GO)作為碳質類高分子材料具有比表面積大、熱穩定性高、在很多溶劑中具有良好的分散性等[26]優點,同時GO分子中含有羥基、羧基、環氧基等含氧基團更有利于吸附。因此,近年來GO被廣泛應用于吸附處理稀土離子污染物。Ashour等[27]利用GO表面的含氧官能團與稀土離子之間的靜電相互作用,將GO用于吸附處理稀土離子Y(Ⅲ)和La(Ш),其吸附量分別為135.7和85.7 mg/g。Li等[28]采用Hummer法制備GO以去除水溶液中的稀土金屬離子,GO對La(Ⅲ)和Nd(Ⅱ)的吸附量分別為105.5 mg/g和99.1 mg/g。但是,單獨利用GO作為吸附劑時,其吸附容量有限,成本也較高。為了達到更好的吸附效果,可通過接枝改性的方法在GO基材上引入功能性單體,在有效提高GO的吸附性能的同時,也能降低生產成本。Ma等[29]在室溫下采用γ-射線輻照技術在GO上接枝甲基丙烯酸二甲氨基乙酯(DMAEMA),制備出含胺基團的吸附劑(GO-g-P),該吸附劑對酸性溶液中的Cr(Ⅵ)有很好的去除效果。當pH為1.1時,GO-g-P對Cr(Ⅵ)的吸附量為82.4 mg/g。Aghdam等[30]通過GO與乙酰乙酸烯丙酯接枝制備吸附劑,該吸附劑對Hg(Ⅱ)的最大吸附容量為282.7 mg/g。Bao等[31]利用具有高密度氨基官能團的PEI與氨基官能化GO納米片接枝,該納米片在從水溶液中捕獲Cr(Ⅵ)污染物時表現出高選擇性,具有1185 mg/g的超高吸附容量和高吸附速率。
考慮到在GO上接枝含有羧基的單體,既能增加GO表面的羧基含量,還會增強GO與稀土離子之間的靜電相互作用[32],從而達到提高吸附材料對稀土離子的吸附量。因此,本文中,以N,N-二甲基甲酰胺(DMF)作為反應溶劑,丙烯酸(AA)作為接枝單體,用于功能化改性GO,以制備對稀土離子具有良好吸附效果的吸附材料(GO-g-PAA),并采用傅里葉變換紅外光譜(FTIR)、掃描電子顯微鏡(SEM)、熱重分析(TGA)等表征接枝前后材料的結構、形貌、熱穩定性等特征。同時選擇Ce(Ⅲ)作為目標污染物離子,系統地研究吸附時間、溶液pH值、吸附劑用量、Ce(Ⅲ)濃度、NaCl濃度等對Ce(Ⅲ)的吸附行為的影響和吸附機理。目前,GO與AA接枝改性并用于吸附處理稀土離子污染物的方法還很少報道。
1 實 驗
1.1 原料與試劑
GO,購于常州第六元素材料科技股份有限公司;DMF,購于津市風船化學試劑科技有限公司;過硫酸銨((NH4)2S2O8),為天津市風船化學試劑科技有限公司;N,N-二甲基雙丙烯酰胺(MBA),購于上海阿拉丁生化科技股份有限公司;AA,為西隴化工有限公司;偶氮胂Ш,購于北京防化學院工廠。實驗所用其他試劑均為分析純。
1.2 GO-g-PAA的制備
將0.08 g GO加入80 mL DMF中,在60 ℃下超聲45 min,再加入0.12 g (NH4)2S2O8繼續超聲20 min,隨后加入0.10 g MBA。在氬氣氣氛中,再勻速緩慢滴加一定量的單體AA,并在60 ℃下持續機械攪拌1 h,再恢復至室溫靜置4 h。反應結束后,將其倒入溶劑過濾器中過濾,并用乙醇洗滌,在60 ℃真空干燥6 h至恒重制得吸附材料GO-g-PAA,合成路線如圖1所示,然后稱重并按公式(1)計算接枝率(GY)。實驗中還通過改變加入單體AA的質量,來研究單體質量對GO-g-PAA接枝率的影響。
(1)
式中:Wg為真空干燥后制得GO-g-PAA的質量(g);W0為接枝前GO的質量(g)。
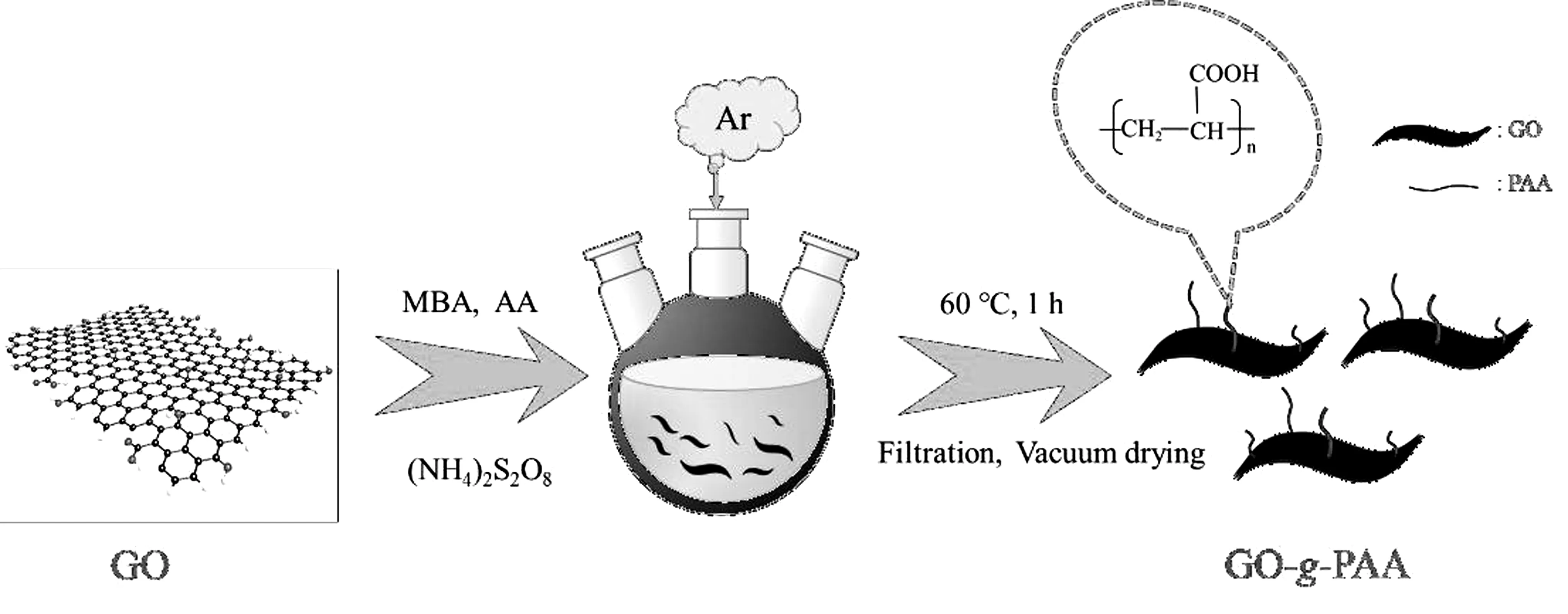
圖1 吸附材料GO-g-PAA的合成路線圖Fig.1 Schematic illustration for the synthesis of adsorbent GO-g-PAA
1.3 GO-g-PAA的表征
使用Spotlight 200傅立葉變換紅外光譜儀測定樣品在4 000~650 cm-1范圍內的顯微紅外譜;TGA測定使用德國Netzsch公司生產的STA449C綜合熱分析儀,氬氣下以10 ℃/min的升溫速率測定樣品從室溫~800 ℃溫度范圍內的熱失重曲線;接枝前后樣品的表面形貌使用TESCAN公司GALA3 XMN 型號SEM進行測試;X射線光電子能譜(XPS)分析使用Kratos Analytical公司的AXIS-Ultra儀器,使用單色Al-Kα輻射(225 W,15 mA,15 kV)和低能電子注入進行電荷補償。為了補償表面電荷效應,電子結合能用碳氫化合物的C1s峰校正(284.8 eV)。
2 GO-g-PAA對Ce(Ⅲ)的吸附性能研究
2.1 吸附動力學
吸附動力學測定過程如下:將 5 mg吸附劑GO-g-PAA置于20 mL,2 mmol/L Ce(NO3)3溶液中,置于25 ℃恒溫培養箱中進行靜置吸附,在不同吸附時間后,依次拿出樣品,去除GO-g-PAA吸附劑后,再加入0.1%的偶氮砷III溶液作為顯色劑,通過UV-Vis測定溶液中Ce(Ⅲ)濃度在655 nm處的吸光度值[33],并根據公式(2)計算吸附量(qe):
(2)
式中:qe(mg/g)表示在吸附平衡時GO-g-PAA對Ce(Ⅲ)的吸附量;c0標識為溶液初始質量濃度(mg/L),ct表示t時間時溶液中剩余的稀土離子質量濃度(mg/L);V表示用于吸附的溶液體積(mL);m表示加入吸附劑的質量(mg)。
2.2 不同條件對GO-g-PAA吸附性能的影響
實驗中系統研究了吸附劑用量、溶液pH值、Ce(Ⅲ)濃度、NaCl濃度等對GO-g-PAA吸附性能的影響。其中吸附劑用量的影響實驗具體步驟如下:稱取不同質量的GO-g-PAA分別置于20 mL,2 mmol/L Ce(NO3)3溶液中,在25 ℃下吸附120 min后去除吸附劑,加入0.1%的偶氮砷III溶液作為顯色劑,測定濾液中的Ce(Ⅲ)濃度并計算吸附量。另外,pH值對吸附性能的影響實驗參照上述實驗步驟。通過加入HNO3(0.1 mol/L)和NaOH(0.1mol/L)調整待測溶液的pH值,以測定pH值對GO-g-PAA的吸附性能的影響。
另外,分別稱取5 mg 的GO-g-PAA置于 20 mL不同濃度Ce(NO3)3溶液,并參照上述測定和計算吸附量的步驟,以確定不同Ce(Ⅲ)離子濃度的對其吸附量的影響。
為了研究NaCl濃度對GO-g-PAA吸附性能的影響,分別稱取5 mg 吸附劑GO-g-PAA 和不同質量 NaCl固體,將其置于20 mL,2 mmol/L Ce(NO3)3溶液中,分別配制不同濃度(0.2,0.4,0.6,0.8,1.0,1.2,1.4 mol/L)的NaCl溶液,在25 ℃下吸附120 min后去除吸附劑,加入0.1%(質量分數)的偶氮砷III溶液作為顯色劑,測定濾液中的Ce(Ⅲ)濃度并計算吸附量。
2.3 脫附實驗
室溫下,將上述實驗中達到吸附平衡后的GO-g-PAA過濾取出,置于1 mol/L NaCl溶液中浸泡12 h,過濾后用蒸餾水清洗3次。然后,放置于60 ℃真空烘箱中烘干24 h后再進行XPS分析。
3 結果與討論
3.1 GO-g-PAA的表征
圖2為GO和GO-g-PAA的紅外光譜圖。如圖2所示,GO對應的紅外譜圖曲線中可以觀察到GO上含有大量的羥基、羧基和環氧基的吸收峰,3 282 cm-1為GO上—OH的伸縮振動峰;1 035和1 720 cm-1處分別對應GO中C—O—C和羧基中C=O鍵的伸縮振動,1 612 cm-1處GO中芳香環中的C=C雙鍵的伸縮振動峰[34-35]。接枝單體AA后,GO-g-PAA的紅外光譜中除了保留了GO原有的特征峰,還出現了一些新的變化,3 290 cm-1處的吸收峰為GO-g-PAA的羥基伸縮振動峰,該峰與未接枝GO相比明顯變寬,這是由于分子間氫鍵耦合導致的[36]。在1 405 cm-1出現的峰由于接枝鏈PAA上的C—O—H面內彎曲振動引起的[37]。另外,有文獻報道基材成功接枝PAA后,吸收峰會向高波長、低波數方向位移[38-39], GO和GO-g-PAA的紅外光譜圖進行對比可以看出,基材GO在接枝PAA后,原來在GO中1 612 cm-1處的吸收峰位移至1 606 cm-1處且有變寬趨勢(如圖2)。上述實驗結果表明PAA已成功接枝到GO上。
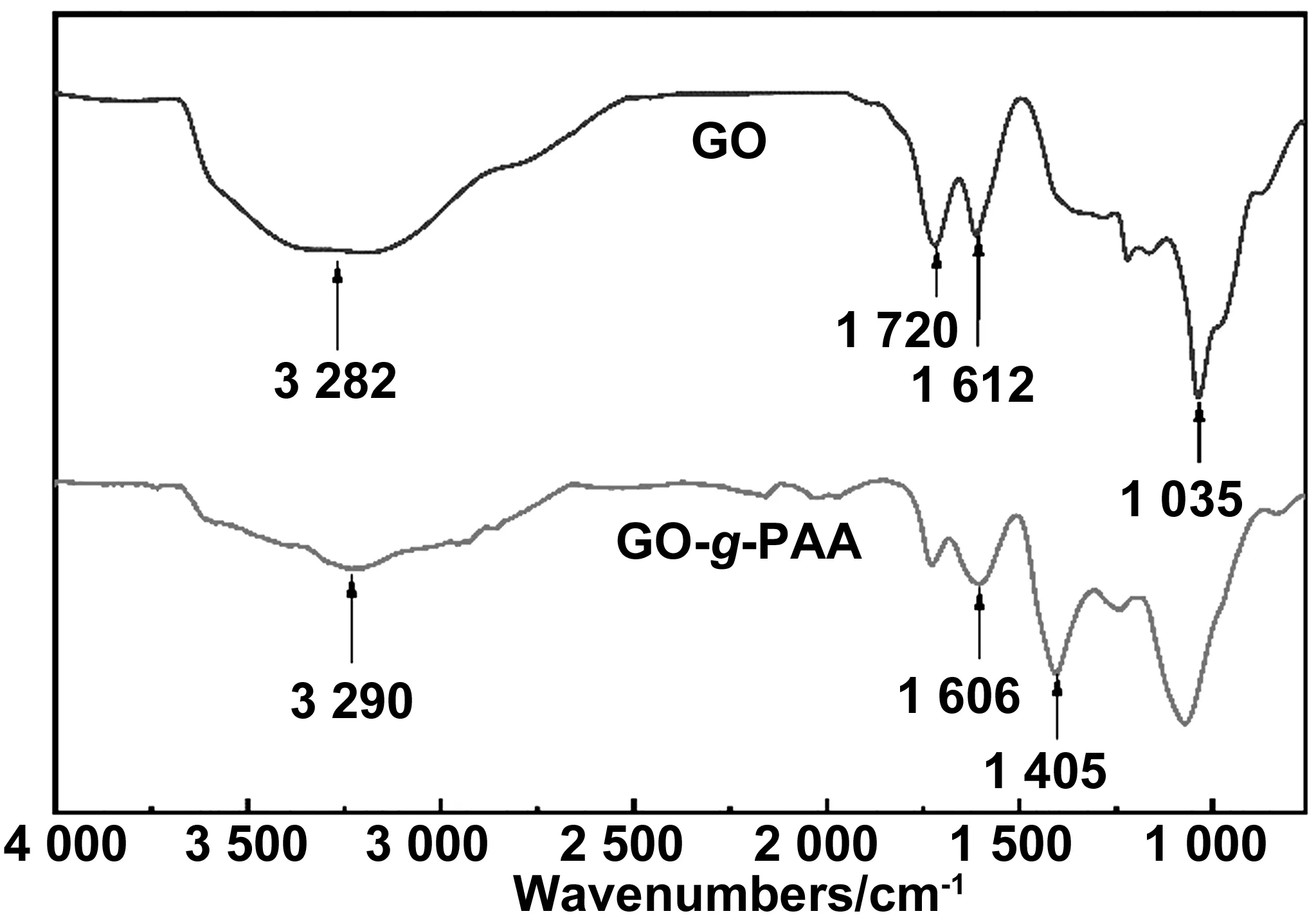
圖2 GO與GO-g-PAA紅外光譜圖Fig.2 FT-IR of GO and GO-g-PAA
GO和GO-g-PAA的SEM如圖3所示。從圖中可以看出,GO呈現層狀結構且有很多薄層層疊在一起,片層之間呈現褶皺和彎曲的微觀形貌(圖3(a))[40],GO層邊緣的褶皺是由于GO中的含氧官能團之間的靜電相互作用引起的,呈現出片層間“貼合式”的褶皺行為[41-42]。與基材GO相比,在接枝后GO-g-PAA雖保持GO的片狀結構(圖3(b),(c)),但表面更加粗糙和不均勻,更有利于吸附[43]。

圖3 GO (a)、GO-g-PAA (b, c)的SEM圖Fig.3 SEM of (a) GO and (b, c) GO-g-PAA
從圖4 (a)的TGA結果來看,GO和GO-g-PAA樣品在100 ℃左右出現約4%的質量損失,這是由于樣品表面吸附水分蒸發引起的[34]。GO在接近210 ℃溫度范圍內出現了約40%的質量損失,這是GO上不穩定的含氧基團的熱降解造成的[44]。從210~800 ℃出現20%左右的質量損失主要是穩定的含氧官能團的熱降解[45]和高溫下GO碳層的碳化降解[46]。GO-g-PAA的熱失重過程共分為3個階段:第一階段是室溫~100 ℃溫度范圍內水分蒸發引起的質量損失;第二階段是100~240 ℃溫度范圍內的熱降解,這主要是由于GO上的不穩定含氧基團和接枝PAA的側鏈降解引起的[38,47];第三階段是高于240 ℃溫度范圍內由于GO上穩定的含氧基團和接枝PAA的聚合物主鏈的熱降解引起的質量損失[48, 49]。如果將DTG曲線中的峰值溫度定義為Tmax,GO和GO-g-PAA的Tmax溫度分別為266.4 ℃和345 ℃ (如圖4 (b)所示),這說明接枝上PAA后可以提高GO的熱穩定性。
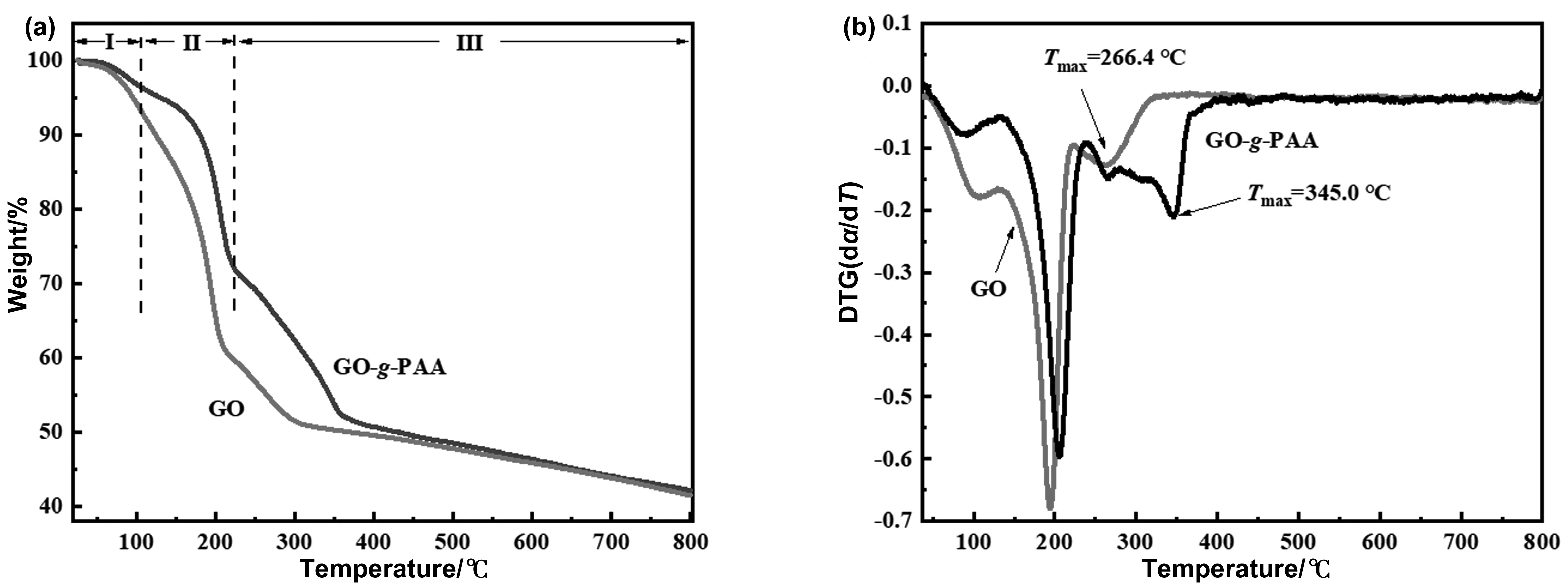
圖4 GO和GO-g-PAA的熱失重曲線 (a)和DTG曲線 (b)Fig.4 (a) TGA curves and (b) DTG curve of GO and GO-g-PAA
3.2 AA用量對GO-g-PAA接枝率的影響
單體用量是對接枝率有顯著影響的實驗因素,因此,在保持其他實驗條件不變的情況下研究了單體用量對GO-g-PAA接枝率的影響[50]。由圖5可知,隨著AA用量的增加,接枝率呈現出先增后降的趨勢。這是由于在加入交聯劑和引發劑后,基材GO表面出現新的自由基位點,隨著單體用量的增加,越來越多的單體接枝到新出現的自由基位點上,進而提高了接枝率[51]。隨著單體用量的進一步增加,單體之間會發生聚合形成均聚物PAA,導致反應體系的粘度增加,阻礙了單體分子向基材GO的擴散,從而導致接枝率降低[52-53]。因此,接枝實驗中將單體AA的用量確定為1.6 g。
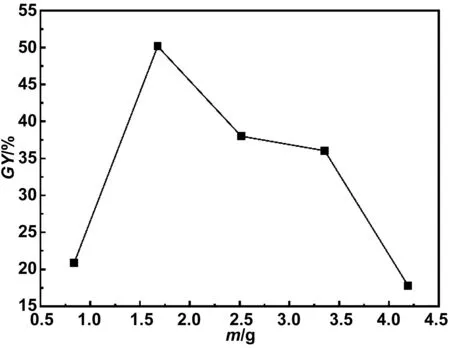
圖5 單體AA用量對接枝率的影響Fig.5 The effect of the amount of monomer AA on the grafting yield
3.3 GO-g-PAA對Ce(Ⅲ)的吸附性能測定
3.3.1 吸附動力學
為了保證吸附過程達到吸附平衡,吸附性能實驗中需首先測定了吸附劑的吸附動力學。如圖6 (a)所示,在吸附的初期,GO-g-PAA對Ce(Ⅲ)的吸附量隨著吸附時間的增加而快速增大,這主要是由于在吸附初期吸附劑表面具有大量的活性位點可用于吸附Ce(Ⅲ)[54];隨著吸附的進行,吸附劑表面的活性位點逐漸趨于飽和,離子必須進一步擴散到吸附劑更深位置的活性位點,在這個過程中就得克服更大的阻力和離子之間的相互作用力,因此,導致后期的吸附速率趨于緩慢,在100 min時達到吸附平衡。為了保證吸附劑在不同條件下都能達到吸附平衡,后面實驗中都將GO-g-PAA吸附Ce(Ⅲ)的吸附時間定為120 min。
吸附動力學數據可以采用準一級(式3)和準二級(式4)兩種動力學模型來進行分析,這兩種模型對應的公式如下[55]:
準一級動力學方程:
ln(qe-qt)=lnqe-k1t
(3)
準二級動力學方程:
(4)
qt(mg/g)表示在t(min)時刻GO-g-PAA對Ce(Ⅲ)的吸附量;k1(min-1)是準一級動力學常數;k2(g/(mg·min))是準二級動力學常數。根據上述公式進行擬合,得出的結果如表1所示。從表中可以看出采用準二級動力學模型擬合后的線性相關系數明顯高于準一級動力學模型的線性相關系數,說明GO-g-PAA對Ce(Ⅲ)的吸附是屬于化學吸附過程[56]。

表1 吸附劑GO-g-PAA吸附Ce(Ⅲ) 時準一級和準二級動力學模型的各個參數
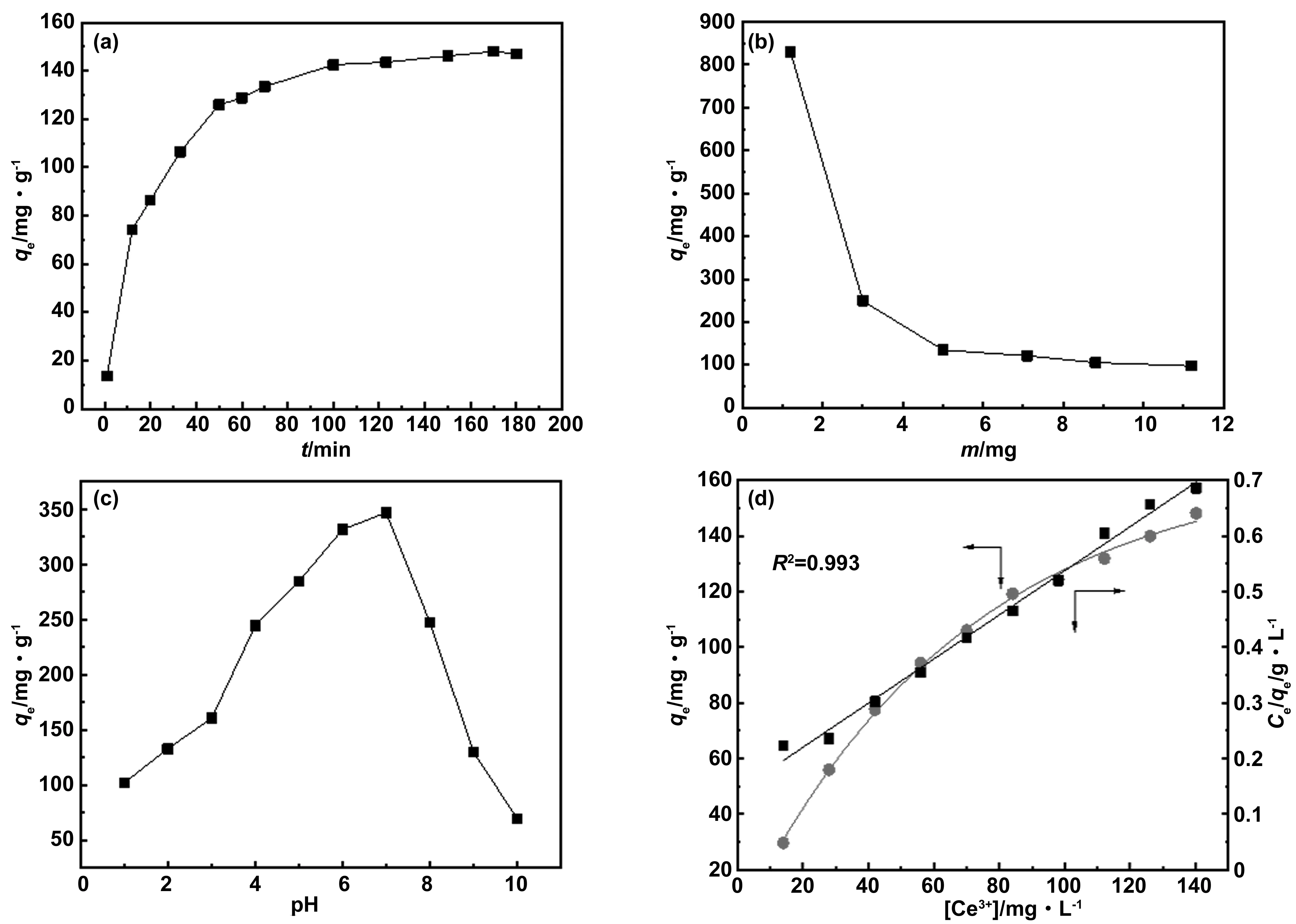
圖6 吸附動力學曲線(溫度:25 ℃,吸附劑用量:5 mg)(a);吸附劑用量(溫度:25 ℃,吸附時間為120 min)(b)和溶液pH值(溫度:25 ℃,吸附時間為120 min,吸附劑用量:5 mg)(c)對Ce(Ⅲ)吸附量的影響及Langmuir吸附模型曲線(溫度:25 ℃;吸附時間為120 min,吸附劑用量:5 mg)(d)Fig.6 (a) The adsorption kinetics curve (temperature: 25 ℃, adsorbent dosage: 5 mg); (b) effects of adsorbent dosage (temperature: 25 ℃, adsorption time: 120 min) and pH value of solution (temperature: (c) 25 ℃, adsorption time: 120 min, dosage: 5 mg) on Ce (Ⅲ) adsorption capacity and (d) Langmuir adsorption model curve (temperature: 25 ℃, adsorption time: 120 min, dosage: 5 mg)
3.3.2 吸附劑用量和pH值對吸附量的影響
圖6 (b)為吸附劑GO-g-PAA對Ce(Ⅲ)的吸附量與吸附劑用量之間的關系,從圖中可以看出當吸附劑用量增加時,吸附量呈現降低的趨勢,這主要是因為當吸附劑的用量較小時,每個吸附位點上可以接觸的Ce(Ⅲ)的數量會相對較多,從而增加了吸附劑的吸附量;當吸附劑用量增加的時候,在吸附劑上的每個吸附位點就會有更少的機會去接觸Ce(Ⅲ),從而導致單位質量的吸附量減少[57]。上述實驗結果表明在Ce(Ⅲ)濃度不變的情況下,吸附劑的用量越小,吸附劑的利用效率就越高。
溶液的pH值會影響Ce(Ⅲ)在水溶液中的存在形式,是決定離子吸附過程的主要因素,因此,實驗中研究了pH值對GO-g-PAA吸附Ce(Ⅲ)的影響。如圖6 (c)所示,GO-g-PAA對Ce(Ⅲ)的吸附量隨著pH值的增加呈現先增加后降低的趨勢。主要原因是當pH在1-7范圍內,其中在強酸環境下,溶液中會存在較多的H+并與Ce(Ⅲ)進行吸附競爭,吸附的位點更容易被H+占據,羧基主要以-COOH形式存在,減少了與Ce(Ⅲ)結合位點的數量[58-59],從而導致GO-g-PAA對Ce(Ⅲ)的吸附量較少;隨著pH增大,羧基與Ce(Ⅲ)之間的靜電相互作用增強,導致GO-g-PAA對Ce(Ⅲ)的吸附量增加[59];當pH值大于7時,Ce(Ⅲ)會發生水解,產生Ce3(OH)54+[60],并且會生成Ce(OH)3沉淀[61],從而導致GO-g-PAA對Ce(Ⅲ)的吸附量降低。此外,從圖中可以看出,當pH=1時,GO-g-PAA對Ce(Ⅲ)仍可達到101.9 mg/g,明顯高于很多文獻中報道的吸附Ce(Ⅲ)的吸附量[62-63],說明GO-g-PAA可在強酸性的極端條件下使用。
3.3.3 等溫吸附模型
為了進一步研究吸附劑GO-g-PAA對Ce(Ⅲ)的吸附過程,采用 Langmuir等溫吸附模型(公式(5))來擬合吸附數據,通過吸附模型來計算吸附劑的理論最大吸附量(qm)來評價和對比吸附劑的吸附性能[64]:
(5)
式中:Ce為Ce(Ⅲ)離子的平衡濃度(mg/L);qe為平衡狀態的吸附量(mg/g);qm為吸附劑的理論最大吸附量(mg/g);KL為Langmuir常數(L/mg)。
根據對吸附數據進行擬合(如圖6(d)所示),得到的擬合結果列于表2。從表2可以看出,吸附劑GO-g-PAA用于吸附Ce(Ⅲ)時,經過線性擬合后的線性相關系數(R2)為0.993,表明該吸附劑對Ce(Ⅲ)的吸附符合Langmuir等溫吸附模型,屬于單分子層吸附[65]。按照公式(5)計算得到吸附劑GO-g-PAA對Ce(Ⅲ)的理論最大吸附量為251.9 mg/g,實驗結果表明GO-g-PAA用于吸附處理Ce(Ⅲ)時表現出優異的吸附性能。GO-g-PAA對Ce(Ⅲ)的吸附容量明顯高于文獻報道的其他吸附劑(如表3)。
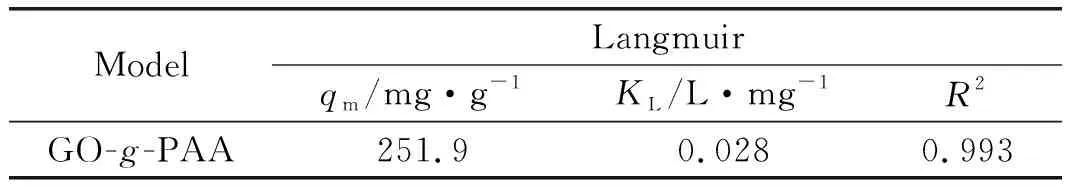
表2 GO-g-PAA用于吸附Ce(Ⅲ)時采用Langmuir等溫吸附模型擬合的各參數及相關系數
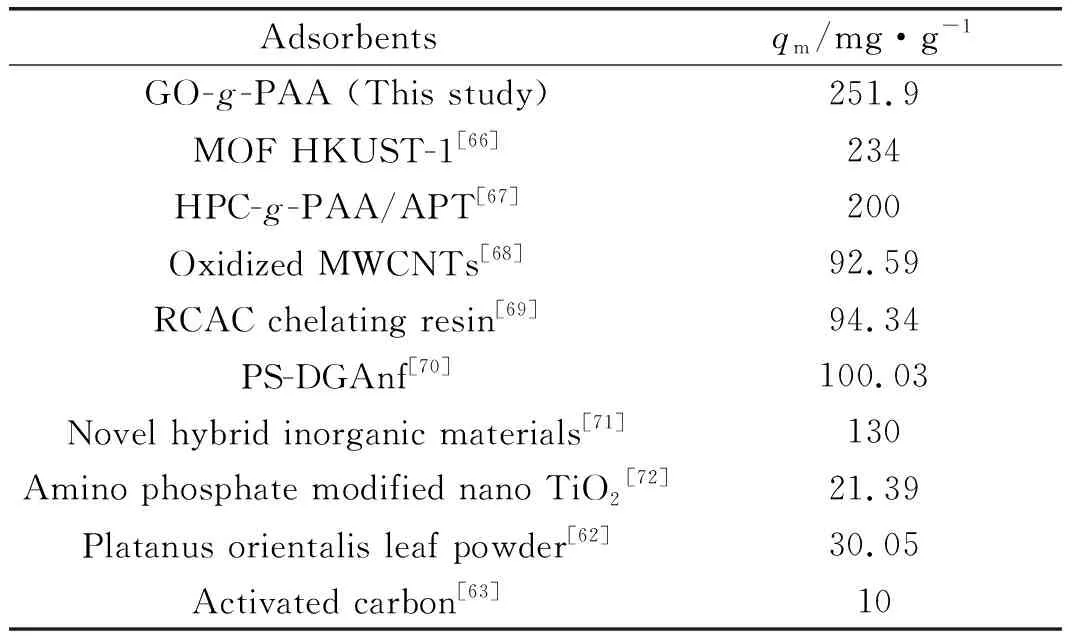
表3 各種吸附劑用于吸附Ce(Ⅲ)的吸附量比較
3.3.4 NaCl濃度對吸附的影響及吸附機理研究
實驗中研究了NaCl溶液的濃度對GO-g-PAA吸附量的影響。如圖7 (a)所示,隨著NaCl濃度增加,GO-g-PAA對Ce (Ⅲ)的吸附能力明顯減弱,導致這種現象的主要原因是當加入NaCl溶液后,溶液中的Na+與Ce3+離子之間相互競爭,吸附劑GO-g-PAA表面的吸附位點中的一部分會被溶液中的Na+所占據,進而造成了GO-g-PAA對Ce(Ⅲ)吸附量的減少[73]。NaCl溶液的濃度越高,Na+離子的數量越多,與Ce3+離子之間的競爭就會越激烈。因此,隨著NaCl溶液濃度的升高,GO-g-PAA對Ce(Ⅲ)的吸附量呈現下降趨勢。
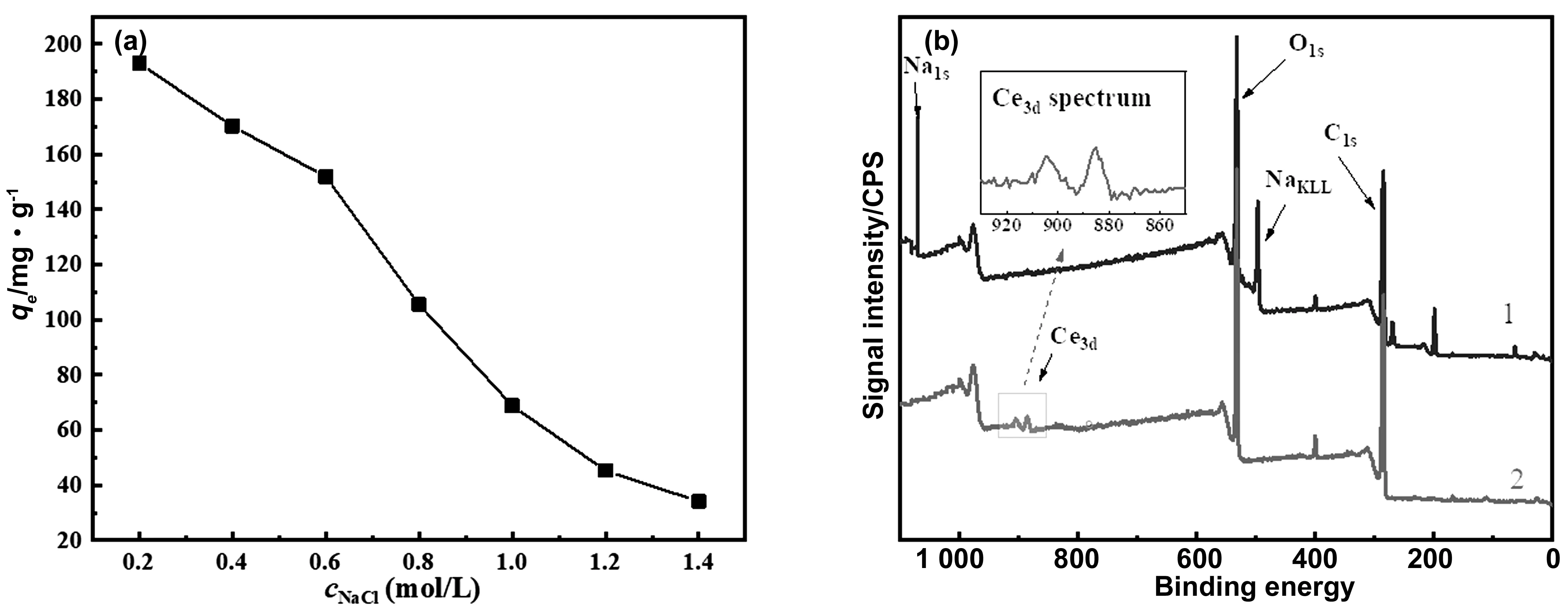
圖7 NaCl濃度對吸附劑GO-g-PAA吸附Ce(Ⅲ)的影響(a);吸附平衡后和1 mol/L NaCl脫附后吸附劑GO-g-PAA的XPS譜圖(1: 吸附Ce(Ⅲ)后;2:NaCl脫附后)(溫度:25 ℃,吸附時間為120 min,吸附劑用量:5 mg)(b)Fig.7 (a) Effect of NaCl concentration on adsorption of Ce (Ⅲ) by adsorbent GO-g-PAA; (b) XPS spectra of GO-g-PAA after adsorption equilibrium and desorption of 1 mol/L NaCl: 1. after adsorption of Ce (Ⅲ); 2. after desorption of NaCl) (temperature: 25 ℃; adsorption time: 120 min; adsorbent dosage: 5 mg)
為了進一步研究吸附劑GO-g-PAA對Ce(Ⅲ)的吸附機理,將上述實驗中達到吸附平衡后的吸附劑GO-g-PAA置于1 mol/L NaCl溶液中進行脫附實驗,并采用XPS光譜來表征吸附平衡后和脫附后的吸附劑。如圖7(b)中的曲線1所示,當GO-g-PAA吸附Ce(Ⅲ)達到吸附平衡后,XPS譜圖中分別在885.3和903.9 eV兩處出現了屬于Ce3d的吸收峰[37, 74],證明了Ce(Ⅲ)吸附在GO-g-PAA上。當把達到吸附平衡的吸附劑浸泡在NaCl溶液中進行脫附實驗后,如圖7(b)中曲線2所示,GO-g-PAA的XPS譜圖中Ce3d峰消失,而在1071.8 eV處出現了屬于Na1s的吸收峰,這說明在脫附過程中吸附劑表面上的Ce(Ⅲ)被Na+取代。結合上述NaCl濃度對GO-g-PAA吸附量影響的實驗結果和XPS譜圖結果分析,GO-g-PAA對Ce(Ⅲ))的吸附屬于離子交換吸附機理。
4 結 論
采用DMF作為溶劑體系在GO基材上,通過化學引發法將單體AA接枝在GO上,制備出可高效、高速吸附去除稀土離子污染物的吸附材料GO-g-PAA。實驗中采用FTIR、SEM和TGA表征了GO-g-PAA的結構、形貌、熱穩定性等特征,證實了單體AA成功接枝到基材GO上,并且接枝PAA有利于提高GO的熱穩定性。通過研究單體用量對GO-g-PAA接枝率的影響發現當單體AA的用量為1.6 g時具有最佳接枝率。GO-g-PAA用于吸附Ce(Ⅲ)時,在100 min達到吸附平衡,吸附過程符合準二級吸附動力學模型和Langmuir吸附等溫模型,屬于化學吸附過程和單分子層吸附,GO-g-PAA對Ce(Ⅲ)的理論最大吸附量分別為251.9 mg/g。吸附劑GO-g-PAA在較寬pH值范圍(4~8)對Ce(Ⅲ)都表現出較高的吸附量,尤其是當pH=1時GO-g-PAA對Ce(Ⅲ)的吸附量仍可達到101.9 mg/g,說明該吸附劑可在強酸性的極端條件下。通過分析NaCl濃度對GO-g-PAA吸附量影響以及分析吸附后和脫附后的XPS譜圖可以證實GO-g-PAA對Ce(Ⅲ)的吸附是離子交換機理。上述研究結果表明,吸附劑GO-g-PAA用于吸附處理稀土離子如Ce(Ⅲ)時具有高酸度下吸附能力強、吸附容量高等優點,在處理廢水中的稀土離子方面具有一定的應用前景。

