通脈養心丸減輕阿霉素致小鼠急性心臟毒性的作用研究
呂清波,王彩君,舒樂新,王玉晶,徐津鵬,王怡
(1.天津中醫藥大學,天津 301617;2.津藥達仁堂集團股份有限公司樂仁堂制藥廠,天津 300112)
心臟毒性是指治療期間或治療結束后出現直接損傷心血管系統或加速心血管疾病發展的毒性現象[1]。阿霉素(DOX)是一種廣譜的蒽環類抗腫瘤藥物[2],臨床上常用于治療乳腺癌、胃癌、肺癌、卵巢癌、膀胱癌、淋巴瘤等多種實體瘤以及造血系統惡性腫瘤白血病[3-4]。DOX可誘導嚴重的心臟毒性,表現為心肌細胞損傷、細胞凋亡、壞死細胞死亡,以及出現危及生命的左心室功能障礙、心律失常以及心力衰竭等[5]。DOX誘導的心臟毒性分為急性、慢性和遲發性[6],以急性和慢性心臟毒性為主[7]。急性心臟毒性多在給藥期間或給藥2~3 d內發生,通過適當的藥物治療是可逆的[8]。慢性心臟毒性呈進展性且不可逆,通常在用藥后1年左右發生[9]。目前,DOX誘導心臟毒性的確切機制仍不明確,較為公認的機制包括氧化應激、線粒體損傷、DNA損傷、鈣超載、細胞自噬和凋亡等[10-13]。
中醫雖然沒有心臟毒性相對應病名,但根據其臨床表現出的心悸、乏力、面色淡白、氣短等主要癥狀,可將其歸為中醫的“心悸”“胸痹”范疇。其病位在心,病性虛實夾雜,以虛為主[14]。證候學研究結果顯示,雖然心臟毒性辨證分型眾多,但以氣陰兩虛證為主,占比高達43%[15]。因此,治法當以益氣養陰為主。通脈養心丸作為臨床治療心血管疾病常用藥物,具有益氣養陰,通脈止痛之功。臨床研究證實,通脈養心丸能夠改善DOX化療患者的心肌酶(CK)異常,緩解患者心悸、氣短、胸悶、胸痛等心臟損傷癥狀,表明通脈養心丸可有效改善DOX誘導的心臟損傷,提高患者生活質量[16]。此外,課題組前期動物研究發現,通脈養心丸能夠減輕DOX誘導的慢性心臟毒性[17]。急性心臟毒性發生較早,且通過適當的藥物治療可逆,因此,本研究將通過對小鼠單次腹腔注射20 mg/kg DOX,建立DOX致小鼠急性心臟毒性模型,探究通脈養心丸是否具有減輕DOX誘導急性心臟毒性的作用。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物 139只SPF級健康雄性C57BL/6J小鼠(年齡:8~9周,體質量:21~23 g)購于北京斯貝福生物技術有限公司,合格證號:SCXK(京)2019-0010。小鼠購入后飼養于天津中醫藥大學實驗動物中心,分籠飼養,每籠4只,普通飲食,自由飲水,環境溫度為(23±2)℃,環境濕度為 35%±5%,24 h晝夜更替。適應性飼養一周后進行分組。
1.1.2 主要藥品及試劑 DOX(北京索萊寶科技有限公司,貨號:D8740)、通脈養心丸(津藥達仁堂集團股份有限公司樂仁堂制藥廠,貨號:1070353)、羧甲基纖維素鈉(北京索萊寶科技有限公司,貨號:C8621)、0.9%生理鹽水(石家莊四藥有限公司,貨號:2201071905)、總超氧化物歧化酶(SOD)測定試劑盒(南京建成生物工程研究所,貨號:A001-3-2)、小鼠心肌肌鈣蛋白(cTn-I)酶聯免疫吸附劑測定(ELISA)試劑盒(武漢華美生物工程有限公司,貨號:CSB-E08421m)、小鼠 N端前腦鈉素(NT-proBNP)ELISA試劑盒(武漢華美生物工程有限公司,貨號:CSB-E05153m)等。
1.1.3 主要儀器 電子天平(上海衡平科學儀器有限公司,型號 JA1003)、離心機(Thermo Scientific公司,型號Legend Micro 17)、小動物超聲實時影像系統(VisualSonics公司,型號:Vevo2100)、全自動生化儀(荷蘭威圖公司,型號:Microlab300)、多功能酶標儀(PERKinElmer公司,型號:Enpire)、組織切片機(上海徠卡儀器有限公司,型號:RM2016)、病理切片掃描儀(匈牙利3D HIES TECH公司,型號:Pannoramic MIDI)。
1.2 實驗方法
1.2.1 動物模型的建立、分組及給藥 動物分組:將139只C57BL/6J小鼠隨機分為5組,分別為空白對照組、DOX組、DOX+通脈養心丸低劑量組(0.5 g/kg)、DOX+通脈養心丸中劑量組(1.0 g/kg)、DOX+通脈養心丸高劑量組(2.0 g/kg),其中空白對照組15只,其余4組均31只。所有小鼠均適應性飼養1周后進行實驗。藥物配制:使用粉藥器將通脈養心丸充分粉碎,再用濃度為0.5%羧甲基纖維素鈉(CMC-Na)配制通脈養心丸低、中、高劑量灌胃水溶液。使用0.9%生理鹽水配制DOX注射液。灌胃劑量為0.01 mL/g,腹腔注射劑量為0.01 mL/g。模型建立及給藥:首先,通脈養心丸各劑量組小鼠進行通脈養心丸預給藥5 d,空白對照組及DOX組灌胃同等劑量0.5%CMC-Na 5 d。預給藥結束后轉天,除空白對照組外,其余各組給予DOX單次腹腔注射20 mg/kg,建立DOX致急性心臟毒性模型,空白對照組腹腔注射同等劑量0.9%生理鹽水。腹腔注射DOX或0.9%生理鹽水1 h后,通脈養心丸各劑量組立即給予灌胃通脈養心丸溶液,空白對照組及DOX組灌胃同等劑量的0.5%CMC-Na,持續給予12 d,并于第3天和第12天進行各項指標檢測。
1.2.2 一般狀況觀察 DOX給藥后每日稱量所有小鼠體質量,記錄體質量變化,并觀察小鼠的精神狀態、毛色變化、飲食飲水量以及死亡情況。
1.2.3 超聲心動圖 DOX給藥后第3天、第12天對所有小鼠進行超聲檢測。小鼠麻醉異氟烷誘導,麻醉后平臥,胸前區備皮。選用高頻矩陣探頭MS400,探頭垂直于左胸壁,并與胸骨成10~30°夾角,顯示心臟沿二尖瓣口至心尖方向的左室長軸像。在左室長軸像引導下,左室內徑最大處(即乳頭肌水平)顯示M型圖像,測量左室內徑及室壁厚度,進行左室功能分析。所有參數至少測量3次。測量指標包括左室射血分數(EF)及左室短軸縮短率(FS)。
1.2.4 蘇木精-伊紅(HE)染色 DOX給藥后第3天將部分小鼠進行處死,第12天將全部小鼠處死采用磷酸鹽緩沖溶液(PBS)進行心臟灌注,沖洗量大于40 mL,以確保心臟完全灌注,隨后取下心臟置于福爾馬林溶液中進行組織固定,3 d后進行組織包埋及HE染色。
1.2.5 血清CK、LDH檢測 DOX給藥后第3天對所有小鼠進行目內眥取血,第12天進行摘眼球取血,靜置0.5 h后,于3 500 r/min離心機離心15 min,離心半徑8.3 cm,吸取上清,分裝于1.5 μL離心管中,取血后4 h內于全自動生化分析儀檢測CK、LDH。
1.2.6 血清cTn-I檢測 DOX給藥后第3天對所有小鼠進行目內眥取血,第12天進行摘眼球取血,靜置0.5 h后,于3 500 r/min離心機離心15 min,離心半徑8.3 cm,吸取上清,分裝于1.5 μL離心管中。根據試劑盒說明書進行cTn-I檢測。
1.2.7 血清SOD檢測 DOX給藥后第3天對所有小鼠進行目內眥取血,第12天進行摘眼球取血,靜置0.5 h后,于3 500 r/min離心機離心15 min,離心半徑8.3 cm,吸取上清,分裝于1.5 μL離心管中。根據試劑盒說明書進行SOD檢測。
1.3 統計學方法 采用SPSS 23.0統計軟件包進行資料分析,實驗結果采用均數±標準差(±s)表示,多組比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗,P<0.05 為差異有統計學意義。
2 實驗結果
2.1 通脈養心丸對DOX致急性心臟毒性小鼠死亡率和體質量變化的影響 空白對照組小鼠狀況良好,無死亡。與空白對照組小鼠相比,DOX組小鼠普遍精神狀況較差,出現體質量下降,精神萎靡、食欲不振、活動強度減弱,喜聚居喜蜷縮,毛色粗糙無光澤等現象,DOX組小鼠死亡率較高。與DOX組小鼠相比,通脈養心丸低、中、高劑量組小鼠的體質量增加,一般情況均明顯改善,死亡率較DOX組下降且死亡時間延后。見圖1、圖2。

圖1 通脈養心丸減輕DOX致急性心臟毒性小鼠的死亡率(±s)Fig.1 Death rate of acute cardiotoxicity mice induced by DOX reduced by Tongmai Yangxin Pills(±s)

圖2 通脈養心丸減輕DOX致急性心臟毒性小鼠的體質量變化率(±s)Fig.2 Rate of weight change of acute cardiotoxicity mice induced by DOX reduced by Tongmai Yangxin Pills(±s)
2.2 通脈養心丸對DOX致急性心臟毒性小鼠心臟功能的影響 與空白對照組相比,DOX組小鼠EF、FS值顯著降低,差異有統計學意義(P<0.01);與DOX模型組比較,通脈養心丸低劑量組小鼠EF、FS值升高,差異有統計學意義(P<0.05),通脈養心丸中、高劑量組小鼠EF、FS值顯著升高,差異有統計學意義(P<0.01)。見圖3。與DOX干預后第3天相比,DOX干預后第12天通脈養心丸中、高劑量組小鼠 EF、FS 值均升高,差異有統計學意義(P<0.05),通脈養心丸低劑量組小鼠EF、FS值呈升高趨勢,差異無統計學意義(P>0.05)。見圖4。
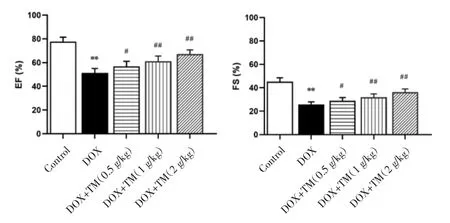
圖3 DOX干預后第3天小鼠EF、FS比較(±s)Fig.3 Comparison of the EF and FS of mice on the third day after DOX intervention(±s)
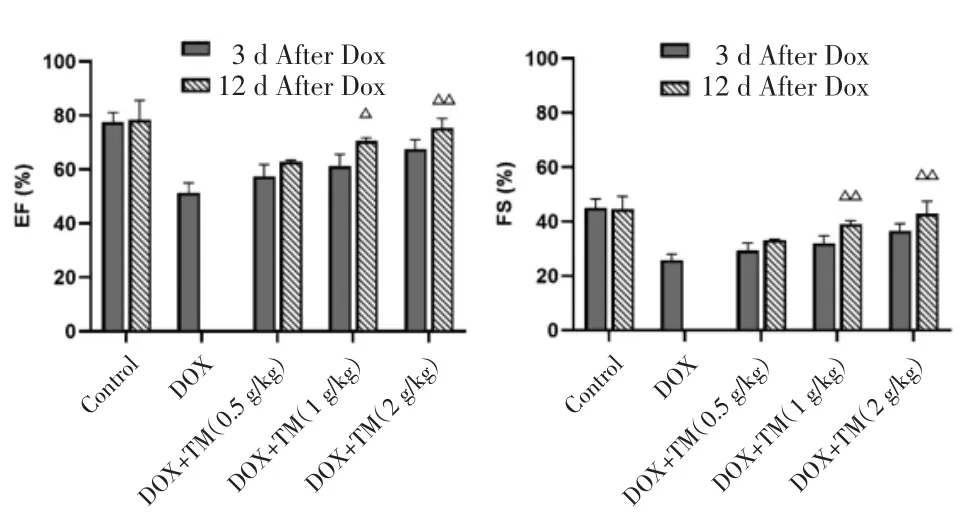
圖4 DOX干預后第12天小鼠EF、FS比較(±s)Fig.4 Comparison of the EF and FS of mice on the twelfth day after DOX intervention(±s)
2.3 通脈養心丸對DOX致急性心臟毒性小鼠心肌病理損傷的影響 DOX干預后第3天,空白對照組小鼠心肌細胞排列整齊、緊密、縱橫交錯,結構清晰,細胞核、細胞漿完整等。與空白對照組相比,DOX組小鼠心肌細胞排列紊亂,肌原纖維丟失,核周空泡化和細胞質空泡化。與DOX組相比,通脈養心丸低、中、高劑量組心肌細胞較為完整,心肌損傷程度減輕,心肌組織明顯改善,這表明通脈養心丸能夠減輕DOX誘導的急性心臟毒性。見圖5。

圖5 DOX干預后第3天小鼠心肌組織病理變化(HE,×400)Fig.5 Pathological changes of myocardial tissue of mice on the third day after DOX intervention(HE,×400)
與DOX干預后第3天相比,DOX干預后第12天通脈養心丸各劑量組小鼠的心肌細胞均排列整齊、結構清晰,細胞核、細胞漿完整。這表明通脈養心丸能夠逆轉DOX誘導的急性心臟毒性,促進受損的心肌組織恢復。見圖6。

圖6 DOX干預后第12天小鼠心肌組織病理變化(HE,×400)Fig.6 Pathological changes of myocardial tissue of mice on the twelfth day after DOX(HE,×400)
2.4 通脈養心丸對DOX致急性心臟毒性小鼠心臟損傷的影響 與空白對照組相比,DOX組小鼠CK、LDH值和血清cTn-I含量均顯著升高,差異有統計學意義(P<0.01);與 DOX 模型組比較,通脈養心丸低、中、高劑量組小鼠CK、LDH值和血清cTn-I含量顯著降低,差異有統計學意義(P<0.01)。見圖7。與DOX干預后第3天相比,DOX干預后第12天通脈養心丸低、中、高劑量組小鼠CK值均呈下降趨勢,其中通脈養心丸低、中劑量組差異有統計學意義(P<0.05)。LDH 均和血清 cTn-I含量均顯著降低,差異均有統計學意義(P<0.01)。見圖8。

圖7 DOX干預后第3天小鼠CK、LDH、cTn-I的含量比較(±s)Fig.7 Comparison of the CK、LDH and cTn-I in mice on the third day after DOX intervention(±s)
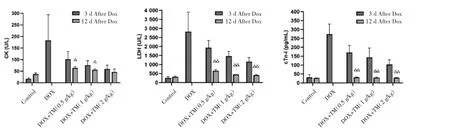
圖8 DOX干預后第12天小鼠CK、LDH、cTn-I的含量比較(±s)Fig.8 Comparison of the CK、LDH and cTn-I in mice on the twelfth day after DOX intervention(±s)
2.5 通脈養心丸對DOX致急性心臟毒性小鼠氧化損傷的影響 與空白對照組相比,DOX組小鼠血清SOD 含量顯著降低(P<0.01),差異有統計學意義;與DOX模型組相比,通脈養心低、中、高劑量組血清SOD含量均顯著升高,差異有統計學意義(P<0.01)。見圖9。與DOX干預后第3天相比,DOX干預后第12天通脈養心丸低劑量組小鼠SOD含量顯著升高,差異有統計學意義(P<0.01),通脈養心丸中劑量組小鼠SOD含量呈升高趨勢。見圖10。

圖9 DOX干預后第3天小鼠SOD的含量比較(±s)Fig.9 Comparison of SOD in mice on the third day after DOX intervention(±s)

圖10 DOX干預后第12天小鼠SOD的含量比較(±s)Fig.10 Comparison of SOD in mice on the twelfth day after DOX intervention(±s)
3 討論
3.1 DOX致急性心臟毒性動物模型及評價指標 模擬人類心臟毒性損傷的實驗動物模型是開發其治療方法的重要要素。研究表明,小鼠和大鼠兩種鼠種在DOX心臟毒性模型中的病理變化沒有差異,并且雌性和雄性兩種性別亦沒有差異[18-19]。通過文獻調研,筆者發現小鼠單次累積30 mg/kg DOX是絕對致死的,而單次累積20 mg/kg DOX是可能致死的[20-21]。結合前期預實驗結果[22],采用DOX單次腹腔注射20 mg/kg,建立DOX致小鼠急性心臟毒性模型進行研究。DOX干預后第3天結果表明,DOX對小鼠造成嚴重的心肌損傷,并且DOX組小鼠均在5 d內死亡,表明接受單次腹腔注射DOX 20 mg/kg的實驗造模方法成功。DOX組小鼠全部死亡后,通過對其他4組繼續灌胃通脈養心丸1周發現,通脈養心丸能夠減輕甚至逆轉DOX造成的心肌損傷,其中以通脈養心丸高劑量為優。
蒽環類藥物誘導的心臟毒性可使左心室EF值出現明顯下降,并且較基線降低至少5%~10%[1,23]。這與本實驗研究結果一致,DOX第3天時,與空白對照組相比,DOX組小鼠均出現EF、FS值降低,差
異有統計學意義。給予通脈養心丸干預后,各組小鼠EF、FS值較DOX組均升高。DOX第12天時,與DOX第3天相比,通脈養心丸各組小鼠均明顯恢復。這表明通脈養心丸能夠減輕DOX誘導的急性心臟毒性,改善心臟功能。血清CK、LDH在臨床上常用于診斷和監控急性心肌損傷。心肌損傷發生時,CK會從受損細胞中釋放入血,使血清CK水平迅速提高。筆者研究結果表明,DOX可使血清中的CK、LDH水平升高,這表明DOX能夠造成心肌損傷,而通脈養心丸能夠降低血清CK、LDH水平,減輕DOX誘導的心肌損傷。cTn-I從心肌細胞中釋放,并且與心臟組織損傷程度成正比。cTn-I是蒽環類化療藥物誘發左心室功能障礙最敏感和最常用的生物標志物[24]。與空白對照組相比,DOX組小鼠、大鼠血清cTn-I含量均呈上升趨勢,這表明DOX對心臟組織造成了廣泛損傷,然而通脈養心丸各劑量組cTn-I值均呈下降趨勢,這表明通脈養心丸具有減輕DOX引起的心肌細胞損傷的能力。但cTn-I并不是確診DOX致心臟毒性的唯一指標,因為其缺乏臨界值、停藥時間、隨訪持續時間和心臟終點的定義[25]。
3.2 通脈養心丸保護心臟的臨床及藥理研究 目前,通脈養心丸保護心臟功能的作用機制已得到證實。本課題組既往藥理實驗研究結果發現,通脈養心丸水提物可減輕缺氧/復氧條件下的H9c2細胞凋亡;降低H9c2細胞內鈣離子(Ca2+)濃度;抑制線粒體膜電位降低及線粒體通透性轉換孔(mPTP)開放等。現代藥理研究發現,通脈養心丸具有較好的氧自由基清除能力,可減輕氧化應激造成的心肌細胞損傷,可通過抑制炎癥因子表達發揮抗炎作用,可通過抑制鈣超載來減少心肌細胞凋亡,保護心臟功能。
同時,臨床研究證實,通脈養心丸能夠改善DOX化療后患者的CK異常,緩解患者心悸、氣短、胸悶、胸痛等心臟損傷癥狀,表明通脈養心丸可有效改善DOX誘導的心臟損傷,提高患者生活質量[16]。基于通脈養心丸的臨床和現代藥理研究結果,以及其減輕DOX致心臟毒性的作用機制尚不明確,筆者從動物層面對其減輕DOX心臟毒性進行藥效及機制研究,為通脈養心丸的臨床應用提供科學依據。
3.3 DOX致心臟毒性的作用機制研究 DOX誘導心臟毒性的確切機制仍不明確,較為公認的作用機制包括氧化應激、線粒體損傷、DNA損傷、鈣超載、細胞自噬和凋亡等。中國蒽環類藥物心臟毒性防治指南(2013年版)指出:蒽環類藥物引起心臟毒性的主要機制是鐵介導的活性氧物質(ROS)產生及促進心肌的氧化應激發生;蒽環類藥物螯合鐵離子后觸發氧自由基生成,導致心肌細胞膜脂質過氧化和心肌線粒體DNA的損傷等[23]。生理情況下,機體的氧自由基與清除氧自由基系統維持動態平衡狀態,當心肌發生損傷時,心肌組織ROS過量生成、堆積,使細胞內的重要抗氧化酶,如超氧化物歧化酶SOD活性降低,清除氧自由基能力下降,導致脂質過氧化物代謝產物生成增多,進一步破壞以脂質為主要成分的生物膜的結構與功能,損傷血管內皮細胞及心肌細胞[1,26-27]。SOD酶活性和能反映體內氧自由基代謝水平,同時也可作為評價心功能及心肌受損程度的指標,本研究顯示,單純給予DOX會導致小鼠SOD含量升高,造成氧化損傷,相比之下,給予通脈養心丸后小鼠SOD含量降低,這表明通脈養心丸能夠改善DOX誘導的氧化損傷,減輕急性心臟毒性。
總之,筆者發現通脈養心丸可通過降低DOX致急性心臟毒性小鼠的死亡率,延長其生存時間,降低CK、LDH值和cTn-I含量,升高EF、FS值及SOD含量,改善DOX造成的核周空泡化和細胞質空泡化,減輕DOX誘導的心臟損傷,改善心臟功能,且其減輕急性心臟毒性可能與氧化損傷有關,后續筆者將針對通脈養心丸減輕DOX致急性、慢性心臟毒性的作用機制進行研究,為通脈養心丸的臨床應用提供科學依據。