基于胰腺PI3K/AKT/BMAL1通路探討針刺對2型糖尿病大鼠血糖晝夜節律的影響*
王栩,張月,劉漢東,李潔,趙文清,周瓊陽,張智龍
(1.天津市中醫藥研究院附屬醫院針灸科,天津 300120;2.天津市紅橋醫院中醫科,天津 300131;3.天津中醫藥大學研究生院,天津 301617)
糖尿病嚴重威脅著人類的健康,根據2019年國際糖尿病聯盟發布的數據顯示,至2045年將有1.472億人患有糖尿病[1]。在2020年美國糖尿病學會頒布糖尿病醫學診療標準中,新增了對2型糖尿病(T2DM)患者應用動態血糖譜報告評估血糖管理的推薦[2],由此說明血糖晝夜節律的調節對T2DM的治療具有重要意義。血糖晝夜節律受胰島生物鐘節律的影響。目前,改善血糖晝夜節律的西藥主要包括胰高血糖素樣肽-1受體激動劑、磺脲類等,但上述藥物存在諸多不良反應,如低血糖、胃腸道反應、皮疹等,影響藥物的長期應用。血糖晝夜節律失衡而引起的持續高血糖可引起多種急慢性并發癥,嚴重影響了患者的生活質量。
研究認為,腦和肌肉芳香烴受體核轉位蛋白1(BMAL1)可調節胰島生物鐘的節律性,維持血糖晝夜節律[3]。其上游受磷脂酰肌醇3激酶(PI3K)通路的調控,PI3K可磷酸化下游絲氨酸/蘇氨酸蛋白激酶(AKT)的蘇氨酸 308位點(pAkt T308)而激活AKT[4]。而AKT又可進一步激活BMAL1,從而調節血糖晝夜節律[5]。同時,針灸對T2DM具有治療作用,1項系統評價表明單純針刺和針刺配合降糖藥均可降低T2DM患者空腹及餐后2 h血糖、糖化血紅蛋白,且療效優于假針刺及單純使用降糖藥[6]。筆者前期的臨床及機制研究顯示,調理脾胃針法可有效降低血糖;改善PI3K通路上下游關鍵蛋白表達及胰島結構[7-9],但對PI3K/AKT/BMAL1介導針刺調節血糖晝夜節律的作用尚不明確。故本研究以高脂高糖結合小劑量腹腔注射鏈脲佐菌素(STZ)的T2DM大鼠為針刺效應平臺,重點研究調理脾胃針法調節血糖晝夜節律失衡的作用機制。
1 材料與方法
1.1 實驗動物 選擇SPF級雄性Sprague-Dawley大鼠36只,體質量(120±20)g,5周齡。購自斯貝福(北京)生物技術有限公司,動物許可證編號:SCXK(京)2019-0010。動物飼養于天津市中國醫學科學院放射醫學研究所,研究方案獲研究所倫理委員會批準(No.IRM-DWLL-2020132),實驗動物的處置符合2006年發布的《關于善待實驗動物的指導性意見》。
1.2 主要試劑及儀器 STZ(S0130,Sigma公司),大鼠胰島素(INS)酶聯免疫吸附法(ELISA)Kit(CSB-E05070r,武漢華美生物公司),PI3K、AKT、p-AKT、BMAL1 抗 體(ab183957,ab233755,ab38449,ab273648,英國Abcam公司),二抗(北京博奧森生物技術有限公司),ECLplus超敏發光液(PE0010,北京索萊寶公司),TUNEL試劑盒(Roche公司);中研太和針灸針(0.3 mm×13 mm),血糖儀及試紙(越佳型至新,雅培公司),酶標儀(美國Bio-Tek公司),凝膠成像系統(美國Bio-Rad公司),脫水機及包埋機(武漢俊杰電子有限公司),病理切片機(上海徠卡儀器有限公司),熒光顯微鏡(OLYMPUS公司)。
1.3 模型建立 將大鼠適應性喂養1周后,采用高脂高糖飼料喂養2個月(高脂高糖飼料配方:蔗糖20%、豬油10%、蛋黃粉5%、膽固醇1%、豬膽汁酸鈉0.1%、普通飼料63.9%)。后將造模大鼠禁食12 h,并按體質量一次性快速腹腔注射STZ溶液(以 0.1 mol枸櫞酸鹽緩沖液配制,pH=4.6),并按注射體積10 mL/kg,注射劑量25 mg/kg,STZ濃度2.5 mg/mL注射,30 min內使用完。于注射完成72 h后采用尾靜脈取血方式,使用血糖儀測量血糖,以連續5 d隨機血糖>16.7 mmol/L為T2DM造模成功[10]。動物成模后均予以普通飼料喂養。
1.4 動物分組及干預方法 采用隨機數字表法將36只大鼠隨機分為空白組10只與造模組26只,造模組按照上述造模方法造模,最終死亡6只,并將剩余的20只大鼠隨機分為針刺組10只,模型組10只。針刺組取穴為:曲池、合谷、血海、足三里、豐隆、陰陵泉、地機、三陰交、太沖(以上穴位均取雙側),中脘,具體穴位定位參照李忠仁主編的《實驗針灸學》[11]。具體操作:首先將大鼠置于自制大鼠針刺服中[8],以減少躁動。身著大鼠針刺服后,大鼠躁動基本消失,可同時多針刺、久留針,并可多只同時針刺操作,具有針刺可行性。而后穴位與針具常規消毒,選用中研太和0.3 mm×13 mm針灸針進行針刺,并于 23:30、05:30、11:30、17:30 進行針刺,每次留針30 min,每日治療1次,每周治療5次,共治療4周。空白組及模型組不予干預。
1.5 檢測指標
1.5.1 一般情況 對造模前后大鼠的精神狀態、毛色、進食量、飲水量、尿量、便質進行觀察。
1.5.2 4時相即時血糖檢測 于干預前及針刺4周后,將各組大鼠禁食12 h,自由飲水。分別于0、6、12、18時采用尾靜脈取血法,用血糖儀測量即時血糖。
1.5.3 平均血糖的標準差(SDBG)和最大血糖波動幅度(LAGE)檢測 SDBG:先計算4時相血糖平均值,再將4時相血糖值與平均值之差的平方和除以6,最后將值開方。LAGE:最高血糖值與最低血糖值之差。
1.5.4 空腹血清胰島素(Fins)含量 于干預前及針刺4周后,將各組大鼠禁食12 h,自由飲水。于18時血糖檢測完畢后,采用眼眶靜脈取血法,取3 mL血液,然后將血液低溫離心,取上清液,采用ELISA檢測Fins。
1.5.5 胰腺熒光TUNEL染色 于針刺4周后,眼眶靜脈取血完畢后,將各組大鼠處死,分離胰腺并于冰生理鹽水中洗去血液至液體澄清。固定后將石蠟切片脫蠟,滴加破膜工作液覆蓋組織,孵育漂洗后,滴加配制好的TUNEL混合液覆蓋組織,37℃恒溫箱孵育2 h,而后進行DAPI復染細胞核,再用抗熒光淬滅封片劑封片,最后于熒光顯微鏡下觀察并采集圖像。采用凋亡細胞數/胰島總細胞核數×100%,計算凋亡指數(AI),取平均值。
1.5.6 蛋白質印跡法(Western blot)檢測PI3K、AKT、p-AKT、BMAL1蛋白表達 取胰腺組織加入裂解液研磨,離心后取上清液,采用BCA法測定蛋白質濃度,根據預實驗結果調整各個蛋白的上樣量,上樣后進行電泳、轉膜,并將膜置于封閉液中封閉2 h,后配置合適比例的一抗封閉液(PI3K、AKT、BMAL1稀釋比例 1∶1 000;p-AKT 稀釋比例 1∶800),于 4 ℃孵育過夜后再加二抗封閉液室溫孵育,滴入ECL plus超敏發光液,并采用凝膠成像系統分析灰度值。
1.6 統計學方法 選取SPSS 24軟件進行統計學分析。實驗數據采用均數±標準差(±s)表示,多組間計量資料比較采用單因素方差分析,組間兩兩比較采用LSD法,組內前后比較采用配對t檢驗。重復測量資料比較采用重復測量方差分析,P<0.05為差異具有統計學意義。
2 結果
2.1 一般情況 造模前大鼠精神狀態反應敏捷,行動迅速,毛發光澤,便質成型;造模后精神萎靡,反應遲鈍,瞇眼少動,縮肩拱背,體型消瘦,毛發蓬松,毛色暗黃,食量倍增,頻繁飲水,尿量增加,大便溏稀。干預結束后,針刺組大鼠精神狀態良好,反應敏捷,體質量增加明顯,毛發順澤,食飲水及尿量如常,便質基本成形。
2.2 4 時相血糖值 如表1所示,干預前與空白組比較,模型組與針刺組各時相即時血糖顯著升高(P<0.01),但針刺組與模型組相比無統計學意義(P>0.05)。干預后,針刺組較模型組各時相即時血糖顯著下降(P<0.01),但兩組各時相即時血糖均顯著高于空白組(P<0.01)。模型組血糖與干預前相比無顯著變化(P>0.05),而針刺組血糖顯著下降(P<0.01)。
表1 各組大鼠干預前后0、6、12、18時即時血糖比較(±s)Tab.1 Comparison of 0,6,12,18 hours of glucose levels in rats of each group before and after intervention(±s)mmol/L

表1 各組大鼠干預前后0、6、12、18時即時血糖比較(±s)Tab.1 Comparison of 0,6,12,18 hours of glucose levels in rats of each group before and after intervention(±s)mmol/L
注:同一時相與空白組比較,**P<0.01;同一時相與模型組比較,##P<0.01;同一組別與干預前比較,▲▲P<0.01。
組別 動物數 0時血糖 6時血糖 12時血糖 18時血糖干預前 干預后 干預前 干預后 干預前 干預后 干預前 干預后空白組 10 6.1±0.72 6.1±0.84 6.2±0.65 6.1±0.73 5.5±0.71 5.5±0.63 5.3±0.66 5.1±0.74模型組 10 22.5±0.92** 22.4±1.14** 20.3±1.36** 21.2±1.43** 18.5±1.52** 19.1±1.62** 21.3±1.21**22.0±1.32**針刺組 10 22.6±1.23** 9.0±0.93**##▲▲ 19.5±1.52** 9.4±0.75**##▲▲ 18.8±1.08** 8.5±0.54**##▲▲ 21.5±2.76** 7.7±0.62**##▲▲
2.3 SDBG與LAGE值 如表2所示,干預前與空白組比較,模型組與針刺組SDBG與LAGE顯著升高(P<0.01),但針刺組與模型組相比無統計學意義(P>0.05)。干預后,針刺組較模型組SDBG與LAGE顯著下降(P<0.01),但兩組 SDBG 與 LAGE 均顯著高于空白組(P<0.01)。模型組 SDBG 與 LAGE 與干預前相比無顯著變化(P>0.05),而針刺組 SDBG 與LAGE 顯著下降(P<0.01)。
表2 各組大鼠干預前后SDBG與LAGE值比較(±s)Tab.2 Comparison of SDBG and LAGE levels in rats of each group before and after intervention(±s)mmol/L
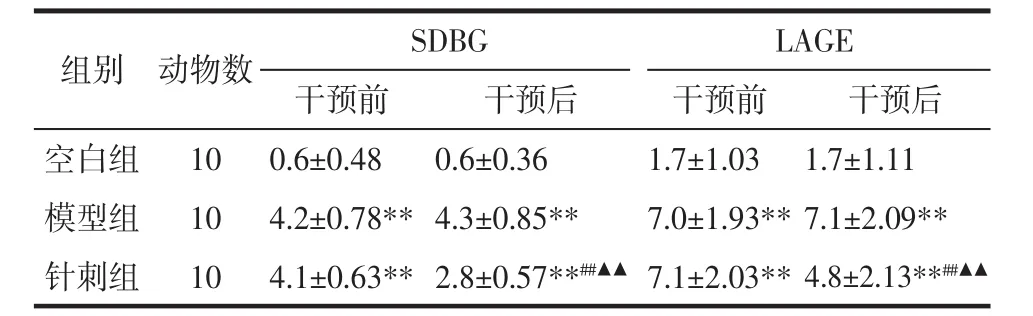
表2 各組大鼠干預前后SDBG與LAGE值比較(±s)Tab.2 Comparison of SDBG and LAGE levels in rats of each group before and after intervention(±s)mmol/L
注:與空白組比較,**P<0.01;與模型組比較,##P<0.01;與干預前比較,▲▲P<0.01。
組別 動物數 SDBG LAGE干預前 干預后 干預前 干預后空白組 10 0.6±0.48 0.6±0.36 1.7±1.03 1.7±1.11模型組 10 4.2±0.78**4.3±0.85** 7.0±1.93**7.1±2.09**針刺組 10 4.1±0.63**2.8±0.57**##▲▲ 7.1±2.03**4.8±2.13**##▲▲
2.4 Fins含量 由表3可知,干預前與空白組比較,模型組與針刺組 Fins含量顯著降低(P<0.01),但針刺組與模型組相比無統計學意義(P>0.05)。干預后針刺組較模型組Fins含量顯著升高(P<0.01),但兩組Fins含量均顯著低于空白組(P<0.01)。模型組 Fins含量與干預前相比無顯著變化(P>0.05),而針刺組 Fins含量顯著升高(P<0.01)。
表3 各組大鼠干預前后Fins的比較(±s)Tab.3 Comparison of Fins levels in rats of each group before and after intervention(±s) μU/L

表3 各組大鼠干預前后Fins的比較(±s)Tab.3 Comparison of Fins levels in rats of each group before and after intervention(±s) μU/L
注:與空白組比較,**P<0.01;與模型組比較,##P<0.01;與干預前比較,▲▲P<0.01。
組別 動物數 Fins干預前 干預后空白組 10 72.91±7.62 69.51±3.36模型組 10 36.45±1.58** 37.43±1.65**針刺組 10 35.25±4.76** 54.91±2.38**##▲▲
2.5 胰腺熒光TUNEL染色及AI值 由圖1、表4可知,鏡下空白組胰島未見明顯凋亡,僅有極少量散在綠色著色的凋亡細胞。而模型組可見大量凋亡細胞,AI值則明顯高于空白組(P<0.01)。經針刺后,針刺組凋亡情況明顯改善,可見夾雜少量凋亡細胞,AI值較模型組明顯下降(P<0.01)。
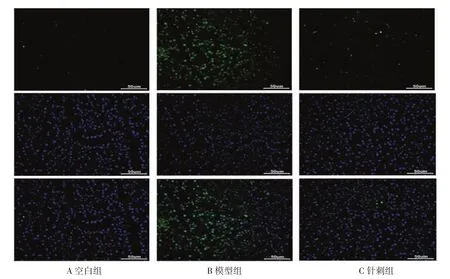
圖1 各組胰腺熒光TUNEL染色(×200)Fig.1 Fluorescence TUNEL staining of pancreas of each group(×200)
表4 干預后各組大鼠胰腺細胞凋亡率的比較(±s)Tab.4 Comparison of lslet cell apoptosis rate in rats of each group of after intervention(±s)%
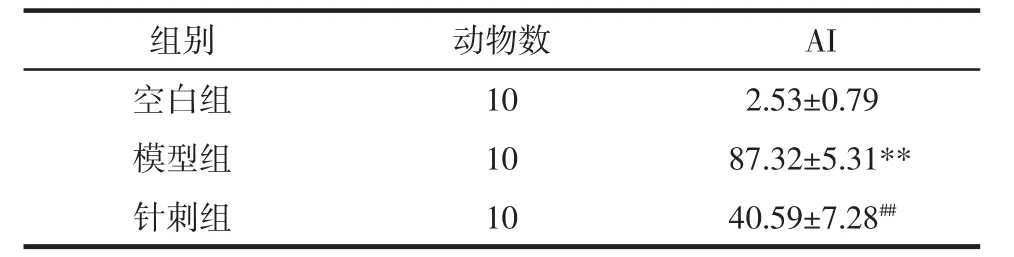
表4 干預后各組大鼠胰腺細胞凋亡率的比較(±s)Tab.4 Comparison of lslet cell apoptosis rate in rats of each group of after intervention(±s)%
注:與空白組比較,**P<0.01;與模型組比較,##P<0.01。
組別 動物數 AI空白組 10 2.53±0.79模型組 10 87.32±5.31**針刺組 10 40.59±7.28##
2.6 各組大鼠 PI3K、AKT、p-AKT、BMAL1 蛋白檢測 由表5、圖2可知,干預后針刺組各蛋白表達較模型組顯著升高(P<0.01),但均顯著低于空白組(P<0.01)。
表5 干預后各組大鼠PI3K、AKT、p-AKT、BMAL1蛋白相對表達量(±s)Tab.5Comparison of PI3K,AKT,p-AKT,BMAL1 levels in rats of each group of after intervention(±s)
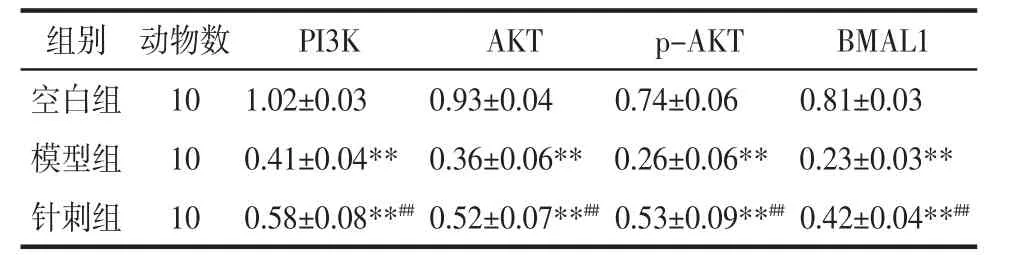
表5 干預后各組大鼠PI3K、AKT、p-AKT、BMAL1蛋白相對表達量(±s)Tab.5Comparison of PI3K,AKT,p-AKT,BMAL1 levels in rats of each group of after intervention(±s)
注:與空白組比較,**P<0.01;與模型組比較,##P<0.01。
組別 動物數 PI3K AKT p-AKT BMAL1空白組 10 1.02±0.03 0.93±0.04 0.74±0.06 0.81±0.03模型組 10 0.41±0.04** 0.36±0.06** 0.26±0.06** 0.23±0.03**針刺組 10 0.58±0.08**##0.52±0.07**##0.53±0.09**##0.42±0.04**##
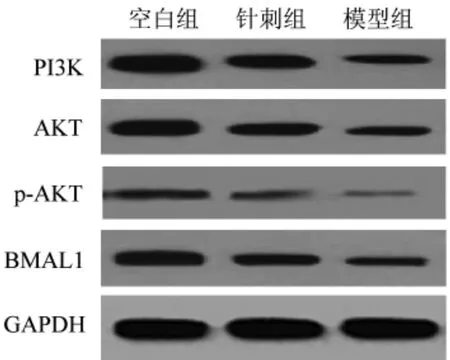
圖2 干預后各組大鼠PI3K、AKT、p-AKT、BMAL1的蛋白表達Fig.2 Protein expression of PI3K,AKT,p-AKT and BMAL1 in rats of each group after intervention
3 討論
人體的生理、代謝方面存在晝夜節律性,這種節律性受體內生物鐘控制。人體生物鐘主要由位于視交叉上核的中央生物鐘和外周生物鐘(如胰島、肝臟、肌肉等)組成。中央生物鐘通過神經、體液調控外周生物鐘,但葡萄糖信號可使外周生物鐘(如胰島)擺脫中央生物鐘控制,而具有相對自主的生物節律,其中胰島的自主生物節律性主要體現在胰島素分泌方面[12]。胰島功能的完整性是胰島素分泌的前提。有資料顯示,T2DM患者胰島分泌的正常節律消失,胰島素脈沖式的分泌模式紊亂,血糖晝夜節律失衡[13]。故恢復胰島功能及正常的“生物鐘效應”對維持T2DM血糖晝夜節律至關重要。
晝夜節律產生和維持的分子機制是由BMAL1與生物鐘循環輸出蛋白(CLOCK)形成異二聚體作為節律性震蕩的起始,隨后與其他時鐘基因結合,形成以約24 h為周期的節律性表達振蕩。PI3K/AKT通路是BMAL1的上游通路,有別于生物鐘基因(CLOCK),BMAL1的缺乏會出現高血糖和葡萄糖刺激下的胰島素分泌紊亂等現象[14]。BMAL1蛋白可與胰島素基因啟動子E-box結合,調控胰島素的表達,并可促進胰島素分泌囊泡的胞吐。敲除BMAL1可影響胰島節律性胞吐[15]。故PI3K/AKT/BMAL1通路與T2DM血糖晝夜節律失衡關系密切。
同時,人體五臟六腑與自然界生物節律亦有聯系,如《靈樞·經別》云:“余聞人之合于天道也,內有五臟,以應五音、五色、五時、五味、五位也;外有六腑,以應六律,六律建陰陽諸經,而合之十二月、十二辰、十二節、十二經水、十二時、十二經脈者,此五臟六腑之所以應天道。”而脾病亦會導致生物節律性的失常,如《素問·藏氣法時論》曰:“脾病者,日昳慧,日出甚,下晡靜。”其中“日出甚”即言明脾病患者在黎明之時病情嚴重,而T2DM的“黎明現象”正是發于此時,這也為生物鐘紊亂從脾論治提供理論依據。同時,血糖是由水谷精微化生而成,源于脾胃的升降運化,故血糖異常亦應從脾論治。《素問·遺篇》曰:“脾者,諫議之官,知周出焉。”筆者認為脾諫議是監督防衛之功的體現。血糖晝夜節律失衡正是由于脾胃受損,脾虛失運,運化失節,諫議失司而引起。因此,提出血糖晝夜節律失衡應從脾論治,調理脾胃升降運化,復其諫議之職,使運化有節。
本研究結果顯示,造模成功后,大鼠顯示出了脾胃升降運化失常所引起的一系列癥狀,如精神萎靡,體型消瘦,毛色暗黃,大便溏稀等。在針刺后上述癥狀較前改善。此外,在正常情況下大鼠血糖分別于6、18時為一晝夜血糖變化的波峰及波谷,并于0、24時回落至基本水平[16],而T2DM大鼠的血糖則無晝夜波動的節律性,而呈現出異常高水平[17],故采用4時相即時血糖以評價血糖波動的節律性,但波動的節律性亦不可過度離散,故進一步結合SDBG與LAGE以評價其離散程度。研究表明,干預前由于胰腺的破壞,故胰島素分泌不足,TUNEL染色亦證明胰島細胞存在大量凋亡。因此,干預前針刺、模型組Fins含量較空白組下降,各時相即時血糖、SDBG、LAGE及AI值較空白組升高,血糖晝夜節律失衡。隨著針刺的干預,AI值降低,提示胰島修復,而胰島功能的完整性又是胰島素分泌的前提,隨著胰島修復,胰島素節律性分泌得到改善,針刺組各時相血糖、SDBG、LAGE趨于正常,且針刺結束后Fins含量亦接近空白組,血糖晝夜節律失衡得到糾正。同時,治療前模型組大鼠PI3K/AKT通路各蛋白表達量降低,信號下傳障礙,BMAL1表達量減少,是血糖晝夜節律失衡的機制。但隨著針刺的介入,針刺對PI3K/AKT/BMAL1通路具有良性調節作用,可提高 PI3K、AKT、p-AKT、BMAL1 蛋白的表達量,促進針刺信號的下傳,隨著BMAL1的表達增加,其可促進胰島素生成,改善血糖分泌的節律性,故使各時相血糖下降,血糖晝夜節律得到改善。
調理脾胃針法正是用于治療脾胃升降運化失常的1種針刺方法,中脘可助運化,功善升清降濁;足三里可益脾胃,補臟腑之虛損;陰陵泉可化濕滯,開通水道,上述3個穴位相配健脾祛濕,調中焦之升降運化。三陰交、地機、血海可化血中之濁瘀,祛瘀生新,調和氣血。豐隆可化濕祛痰,和胃降逆。曲池、合谷通降胃腸,蕩滌邪穢。太沖平肝調肝,防肝木橫克脾土。諸穴合用,使升降有序,健運有常,精微得布,臟腑得養,諫議之職可復[18]。