血管免疫母細胞性T細胞淋巴瘤的預后分析
蔡倩倩,戴輝,萬斌,舒文秀,宋燕萍,諶登兵,樂靜
血管免疫母細胞性T細胞淋巴瘤(AITL)占外周T細胞淋巴瘤的15%~30%,以強烈炎癥和免疫反應為特征。該病發病機制未明,可能與藥物,特別是抗生素及感染因素,如結核、隱球菌及EB病毒等相關[1-3]。AITL好發于老年人,起病時多伴B癥狀和淋巴結腫大,約70%患者發病時已有骨髓侵犯,45%有皮膚累及,其他結外器官較少累及[4-5]。AITL發病時常合并自身免疫性疾病[1],目前無標準治療方案,5年疾病無進展生存(PFS)和總生存(OS)為18%~25%和33%~48%[6]。本研究分析了31例初治AITL患者臨床特征、療效及預后,現將結果報道如下。
1 資料與方法
1.1 一般資料 選擇寧波市醫療中心李惠利醫院2015年9月至2021年12月期間收治的31例初治AITL患者為研究對象,均符合AITL診斷標準[7]。收集所有患者臨床資料、實驗室檢查及影像學資料。其中消瘦定義為體質量6個月內下降10%。
1.2 治療方案 4例患者(12.9%)因拒絕化療或化療不耐受行姑息治療。23例患者(74.2%)給予一線CHOP(環磷酰胺+表柔比星+長春瑞濱+地塞米松)方案化療,其中5例(16.1%)同時聯合西達本胺治療,7例(22.6%)在療程結束后給予西達本胺維持治療。其余4例(12.9%)治療方案分別為DICE(地塞米松+異環磷酰胺+奧沙利鉑+依托泊苷)、依托泊苷聯合地塞米松、苯丁酸氮芥聯合西達本胺、單藥潑尼松。復發或進展的AITL采用二線方案行挽救化療,僅1例(3.2%)進行了自體干細胞移植鞏固治療。
1.3 療效評價及隨訪 參照2014年惡性淋巴瘤Lugano療效評價標準進行療效評估,完全緩解(CR)為所有臨床、影像學上可檢測的病灶消失,無新增病灶;部分緩解(PR)為6個最大淋巴結或腫塊最大垂直徑乘積之和縮小≥50%,其他的淋巴結、肝脾無增大;疾病進展(PD)為任何新發病灶或病灶較最低水平增長≥50%;疾病穩定(SD)為未達到CR、PR及PD者[8]。通過電話、查閱病例方式進行隨訪,中位隨訪時間為15.1(0.2~55.6)個月。
1.4 統計方法 用SPSS 22.0統計軟件進行數據分析,療效分析采用Fisher檢驗或Mann-Whitney U檢驗;生存曲線繪制采用Kaplan-Meier法,Log-rank檢驗;生存分析采用Cox比例風險回歸模型。P<0.05表示差異有統計學意義。
2 結果
2.1 臨床特征 31例AITL患者中男16例,女15例;中位發病年齡71(42~87)歲,發病時60歲以上27例(87.1%);中位發病至確診時間為1.3(0.4~3.5)個月;大多以淋巴結腫大(58.1%)、咳嗽(35.5%)、皮疹(19.4%)等為主訴就診。起病時伴B癥狀24例(77.4%),其中消瘦17例(54.8%)[消瘦組與無消瘦組間臨床基線數據差異均無統計學意義(均P>0.05),見表1]。16例(51.6%)伴脾腫大,3例(9.7%)合并多漿膜腔積液,7例(22.6%)患者有骨髓累及。Ann Arbor分期III~IV期30例(96.8%);國際預后評分(IPI)3~5分26例(83.9%),中位IPI 3(1~4)分。
實驗室檢查方面,血紅蛋白(HGB)<110 g/L14例(45.2%),中位HGB 113(60~151)g/L[HGB<110g/L組與HGB≥110 g/L組臨床基線數據差異均無統計學意義(均P>0.05),見表1。7例(22.6%)合并血小板減少,中位血小板177×109/L[(33~446)×109/L]。17例(54.8%)合并低蛋白血癥,中位白蛋白水平34(19.9~45.2)g/L。中位C反應蛋白(CRP)為18.7(0.6~91.4)mg/L,乳酸脫氫酶(LDH)284(111~648)U/L,肌酐65.4(39.9~240)mol/L,鐵蛋白317.7(78.1~1269)g/L,2微球蛋白5(1.85~16.7)mg/L,Ki-67表達為60%(30%~90%)。

表1 31例AITL患者臨床基線數據 例(%)
2.2 療效及生存分析 27例患者(87.1%)接受聯合化療,4例患者(12.9%)行姑息治療。獲得CR 10例(32.2%),PR 11例(35.5%),在緩解后接受西達本胺維持治療7例(22.6%)。SD和PD分別為3例(9.7%)和7例(22.6%),總有效率(ORR)為67.7%。20例(64.5%)出現疾病復發或進展,17例(54.8%)死亡。中位PFS和OS分別為11.0個月和27.5個月,3年PFS和OS分別為28.9%和44.5%,見封三彩圖1。

圖1 31例AITL患者PFS和OS
2.3 白蛋白水平及治療方案 治療有效(CR+PR)組白蛋白水平高于無效(SD+PD)組(t=2.509,P<0.05),見封三彩圖2。CHOP樣方案化療組及非CHOP樣方案化療組ORR率分別為82.6%和50.0%,兩組療效差異無統計學意義(2=2.096,P>0.05)。

圖2 治療有效組(CR+PR)和治療無效組(SD+PD)之間白蛋白水平
2.4 預后因素單因素分析 CRP水平升高、HGB<110 g/L和低白蛋白血癥是影響PFS的不良預后因素(均P<0.05);HGB<110g/L和消瘦是OS不良預后因素(均P<0.05),血小板減少在AITL預后不良組更常見,但差異無統計學意義(P>0.05),見表2。Cox多因素回歸分析結果顯示HGB<110 g/L是AITL患者PFS的獨立不良預后因素(P<0.05),消瘦是OS的獨立不良預后因素(P<0.05),見表3。CHOP樣方案治療組較非CHOP樣方案組有更長的PFS和OS(Log-rank2=5.669、4.947,均P<0.05)。聯合西達本胺組較未聯合西達本胺組有更長的PFS和OS(Log-rank2=4.869、6.405,均P<0.05),見封三彩圖3~4。

表2 影響AITL患者PFS和OS的單因素分析 個月
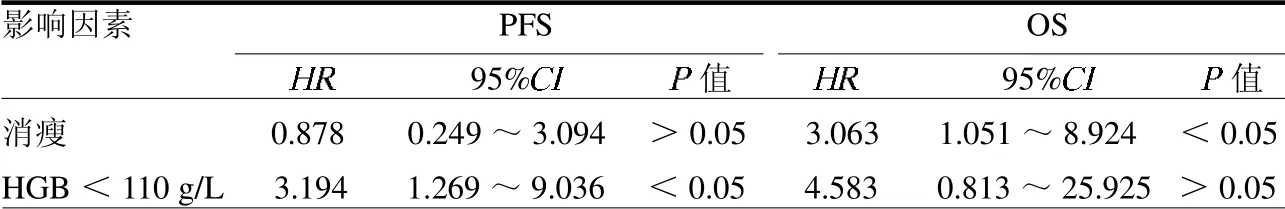
表3 影響AITL患者PFS和OS的Cox多因素分析
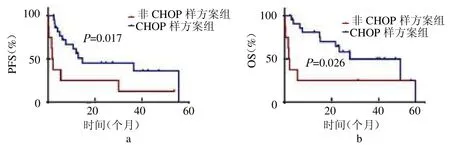
圖3 CHOP樣方案組與非CHOP樣方案組AITL患者的PFS(a)和OS(b)比較
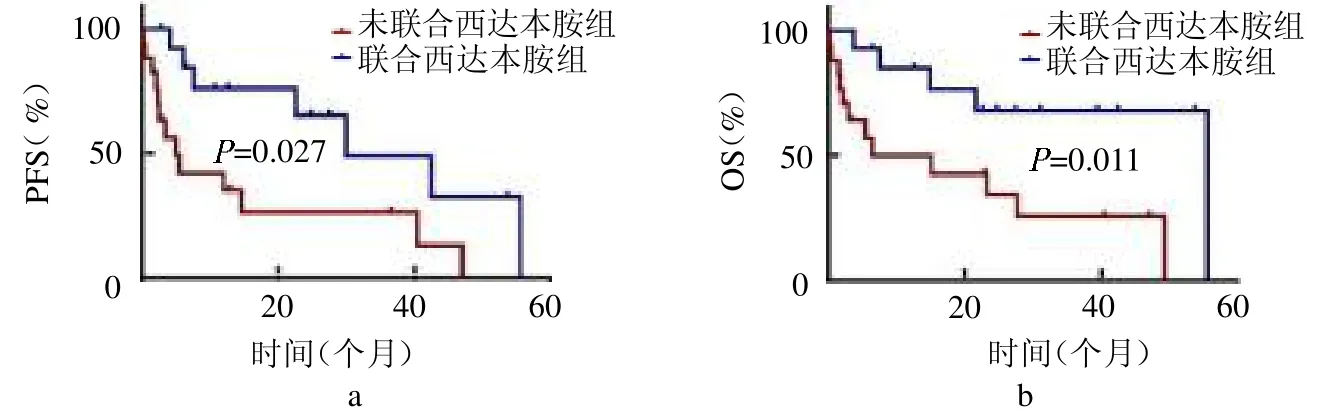
圖4 聯合西達本胺組與未聯合西達本胺組的PFS(a)和OS(b)比較
3 討論
AITL疾病侵襲性高、臨床進展快、疾病預后差,發病時多處于進展期,部分可合并自身免疫病[9]。本研究多以淋巴結腫大(58.1%)、咳嗽(35.5%)、皮疹(19.4%)起病,71.0%的患者可檢測到2微球蛋白水平升高。
AITL的發病可能與EB病毒感染有關[10]。AITL最常見的細胞遺傳學異常 包 括5q+(55%)、21+(41%)、3q+(36%),5號及21號染色體三體(41%)和6q-(23%)[11]。
目前國際上仍沒有統一的標準一線治療方案。基于CHOP方案的聯合化療仍是當前治療首選,總有效率約為70%~79%,CR率為39%[12]。文獻報道,在CHOP方案基礎上聯合依托泊苷作為誘導治療方案能有效提高療效[13]。ECHELON-2研究發現,維布妥昔單抗聯合CH P(環磷酰胺、多柔比星、潑尼松)方案的療效及預后均優于傳統的CHOP方案[14]。
近年來通過基因表達譜分析發現了多種與AITL發病相關的突變,包括ras家族(RHOA)(50%~70%),表觀遺傳學調控因子,如DNMT3A(20%~30%)、IDH2(20%~45%)、TET2(47%~83%)等,為AITL治療提供了更多的靶點[15]。文獻報道,CHOP樣方案聯合西達本胺治療ORR率為65.9%,CR率為41.5%,中位PFS為9.6個月[16]。本研究ORR率為67.7%,其中CR率為32.2%,與既往文獻報道基本一致。CHOP樣方案組較非CHOP樣方案組具有更長的PFS和OS(均P<0.05),由此看來CHOP樣方案仍是目前治療AITL的基石。本研究還發現,治療有效組白蛋白水平高于無效組(P<0.05),提示白蛋白可能成為AITL療效預測的指標之一,但仍需更大樣本的研究進一步證實。
目前關于影響AITL的預后因素仍有爭議,Zhang等[17]認為大于5個淋巴結區域受累、年齡和2微球蛋白水平是影響OS的因素。國際T細胞工作組最近提出了AITL預后積分系統(包含年齡、ECOG評分、2微球蛋白、CRP共4個危險因子),依據危險因子個數將患者分為低、中、高危組,其5年OS分別為65%、54%和21%[18]。本研究中位PFS和OS分別為11.0個月和27.5個月,3年PFS和OS分別為28.9%和44.5%,通過單因素和多因素分析發現HGB<110 g/L和消瘦是AITL不良預后的影響因素。
綜上所述,AITL好發于中老年,臨床侵襲性強、預后差,HGB水平和消瘦可能是影響AITL患者預后的重要指標。本研究樣本小,有待更大樣本的研究證實。下一步研究方向應致力于結合二代測序等檢測技術,探索基因導向的靶向治療新方案,尋找可靠的預后評價指標,從而提高AITL患者的療效及生存。

