miR-141對股骨頭壞死骨髓間質干細胞活性及VEGF/TGF-β2蛋白的影響
田楠楠, 馮蜜亞
(1.河北省衡水市人民醫院, 河北 衡 水 0530002.河北醫科大學第三醫院, 河北 石家莊 050000)
股骨頭壞死 ( osteonecrosis of femoral head,ON- FH) 為臨床骨科常見疾病,是股骨頭血供不足導致骨細胞死亡,股骨頭微結構改變礙的疾病[1]。ON- FH具有致殘性,多發于中青年,發病原因與創傷骨折、激素性及酒精性相關[2]。人骨髓間充質干細胞 ( human bone marrow mesenchymal stem cells, hMSCs) 是具有分化潛力的干細胞 可分化成多種細胞,例如成骨細胞及軟骨細胞等[3]。相關研究證實,在激素性股骨頭壞死中存在hMSCs活性異常,主要為股骨中出現hMSCs活性降低[4]。血管內皮生長因子(vascular endothelial growth factor,VEGF)是具有促血管生成的作用,已經應用于血管化組織工程的研究中已經取得了較好效果,但是與股骨頭壞死關聯還需要進一步研究[5]。轉化生長因子-β2(Transforming growth factor,TGF-β2)屬于成骨細胞趨化因子,當出現TGF-β2缺失后會出現嚴重骨缺失。現有研究通過慢病毒將TGF-β2過表達轉染至干細胞內能夠有效改善骨缺損[6]。微小RNA(microRNA,miRNA)是長度約22nt的非編碼RNA,可發揮基因調控、細胞生物學行為具有重要調節作用。微小RNA-141(miR-141)屬于其中成員之一,在骨組織修復及成骨細胞活性中存在關聯,并經文獻證實在激素性股骨頭壞死中表達升高[7]。本文通過探討miR-141對股骨頭壞死骨髓間質干細胞活性及VEGF/TGF-β2蛋白的影響,為股骨頭壞死的臨床治療提供方向。
1 材料與方法
1.1標本采集及細胞提取:選取2020年4月至2021年4月期間進行全髖關節置換術的18例激素性股骨頭壞死患者及10例股骨頸骨折患者,均自愿參與并簽署知情同意書及經我院倫理委員會批準。股骨頭壞死患者術前符合賓夕法尼亞大學分期IV~VI分期,所有患者均無感染病史,激素性股骨頭壞死患者均采用糖皮質激素治療超過4周,于無菌條件下進行全髖關節置換手術過程中,提前用肝素處理注射器,手術過程中均抽取骨髓約5mL,放入抗凝的離心觀眾制成細胞懸液。細胞培養:將細胞懸液加入等體積的淋巴細胞分離液共放入離心管中,3000r/min(離心半徑10cm)下分離10min,將離心管底部白膜層的單個核細胞放置另一個離心管中,棄上清液,用含15%的胎牛血清的DMEM完全培養基重懸細胞,細胞濃度為1×106/mL接種于培養瓶中在飽和濕度,5%的CO2及37℃中培養。
1.2主要試劑與儀器:試劑:DMEM高糖培養基購自中國上海微科生物有限公司;胎牛血清、0.25%胰蛋白酶均購自中國上海素爾生物科技有限公司;噻唑藍MTT試劑、二甲基亞砜(DMSO)試劑均購自北京索萊寶科技有限公司;干細胞表面抗原CD44、CD45、CD13、CD14抗原均購自北京匯智泰康醫藥技術有限公司;鼠抗人GAPDH單克隆抗體、鼠抗人VEGF單克隆抗體、兔抗人TGF-β2單克隆抗體均購自中國上海圻明生物科技有限公司;山羊抗兔IgG購自中國武漢純度生物科技有限公司;儀器:電子天平購自中國上海眾淵實業有限公司;TDZ4-WS低速臺式離心機購自中國湖南湘瑞生物有限公司;倒置顯微鏡購自中國上海豫光儀器;凝膠成像系統及Western blot電泳系統均購自中國北京賽百奧科技有限公司;BriCyte E6流式細胞儀購自中國邁瑞醫療有限公司。
1.3原代細胞抗原檢測及細胞培養:細胞傳代取第3代MSCs,采用0.25%胰蛋白酶消化后采用倒置顯微鏡觀察細胞完全懸浮后采用PBS沖洗,在加入相關抗體CD44、CD45、CD13、CD14,4℃下避光孵育30min,PBS沖洗后采用流式細胞儀進行檢測。顯微鏡下觀察原代細胞生長至80%~90%時進行傳代,75%乙醇消毒,棄去舊的培養基,PBS洗滌三次,加入0.25%胰蛋白酶消化,生長至90%時終止消化反應,脫壁后,放入15mL的離心管中1000r/min,5min后,棄去上清液放入培養基中2~3d傳代。
1.4MSCs細胞干預及分組:PBS緩沖液將MSCs細胞株洗凈,重復3次,胰蛋白酶消化2min,離心15mL后,將數目為5×103細胞平鋪到6孔板中,融合率達到70%,采用無血清培養基按照3μL稀釋,在37℃下孵育20min,轉染按照Lipofectamine 2000說明書操作,分別將miR-141siRNA、miR-141-siRNA-NC轉染到細胞株中,37.5℃,5%CO2繼續培養。12h后將無血清培養基更換為完全培養基,繼續培養24h后,提取細胞RNA,采用qRT-PCR法驗證轉染效率。分組:將MSCs細胞分為A組(股骨頸骨折患者hMSCs細胞)、B組(激素性股骨頭壞死患者hMSCs細胞)、C組(B組+hMSCs細胞+miR-141-siRNA-NC)、D組(B組++miR-141-siRNA)。
1.5MTT檢測各組hMSCs細胞存活率:各組hMSCs細胞接種在96孔板中,消化后,每個濃度6個復孔,細胞濃度0.6×104個/mL,均加入5mg/mL的MTT溶液20μL,培養24h、48h及72h后,然后吸棄培養液,再在每個孔中加入50μL DMSO,搖勻后放入490nm波長下檢測(OD值),取3次平均值。
1.6流式細胞儀檢測各組hMSCs細胞凋亡:取2×105個/mL的hMSCs細胞懸液,PBS溶液予以洗滌,離心5min,運用100μL結合緩沖液,對細胞進行重懸,用5μL標記FITC的AnnexinⅤ與5μL PI染色混勻,避光條件下,孵育15min后注入400μL結合緩沖液混勻,予以洗滌,次數3次,流式細胞儀檢測細胞凋亡率。
1.7免疫印跡檢測hMSCs細胞VEGF、TGF-β2蛋白表達:hMSCs移入孔6板中,細胞濃度為2.5×104個/mL,PBS沖洗,加入150μL RIPA的裂解液,12000r/min離心15min后,放入樣孔中,進行電泳實驗。PVDF膜TBS浸泡10min,反復PBS沖洗,5min/次,加入VEGF(1∶500)及TGF-β2(1∶1000)1抗和內參GAPDH抗體(1∶1000),TBS沖洗3此后,加入辣根過氧化酶標記的山羊抗兔(1∶5000),雜交沖洗。后將膜浸入ECL工作液,隨后進行檢測,獲取圖象。
1.8QRC-PCR檢測hMSCs細胞miR-141、VEGF、TGF-β2相對表達量:hMSCs細胞濃度為2.5×104個/mL,提取細胞中RNA進行反轉錄得到總cDNA,分離后采用Trizol法提取總RNA,無核酸酶溶解。將提取的RNA進行轉錄為cDNA,獲得反體系,條件為:42℃作用60min,72℃作用5min,4℃終點。每個細胞設置6個復孔,以β-actin為內參,反應條件為95℃預作用3min,95℃作用5s,58℃退火,40個循環。見表1。

表1 引物序列
1.9雙熒光素酶報告基因:從人類基因組DNA產生全長VEGF-3′UTR,TGF-β2-3′UTR并通過退火合成的信號寡核苷酸產生突變體,DNA片段克隆到ph-TK載體,VEGF-3′UTR WT/TGF-β2-3′UTR WT為野生型,VEGF-3′UTR MUT/TGF-β2-3′UTR MUT為突變型,均轉染到細胞內,同時使用pGL-3.0(熒光素酶)作為內參照。檢測細胞中VEGF、TGF-β2的熒光活性相對值。使用 Lipofectamine 2000 TM檢測轉染效率在孢菌素酶活性的基礎上正常化。按照說明書,使用雙熒光素酶報告系統試劑盒測量miR-141對VEGF、TGF-β2的表達活性的調控能力。
2 結 果
2.1流式細胞儀檢測hMSCs細胞表面抗原:hMSCs細胞表表面抗原CD44(86.33±3.02)%,CD13(90.25±2.55)%呈現高表達,CD14(0.89±0.15)%、CD45(0.33±0.05)%呈現低表達。
2.2hMSCs細胞形態比較:A為股骨骨折患者分離培養24h的hMSCs細胞出現少量貼壁生長,細胞呈現紡錘狀生長,融合速度較快,呈現旋渦狀生長;B為激素性股骨頭壞死患者離培養24h的hMSCs細胞數量較少,多數呈現呈梭形分布,見圖1。
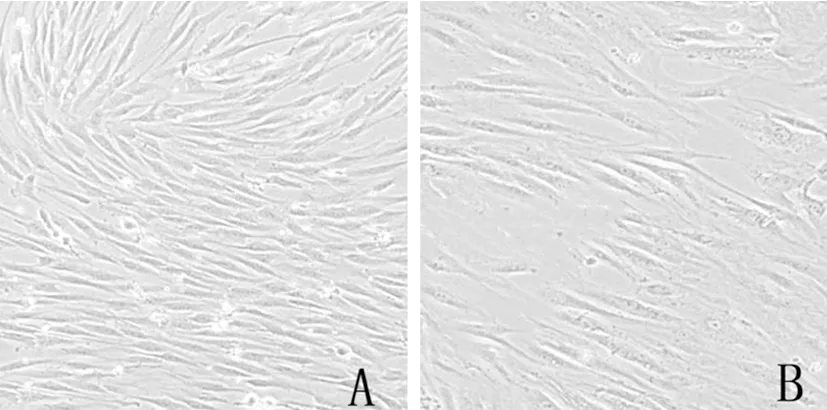
圖1 股骨骨折和激素性股骨頭壞死hMSCs細胞形態
2.3RT-PCR檢測各組hMSCs中miR-141 mRNA表達:與A組相比,B組細胞miR-141 mRNA升高,差異具有統計學意義(P<0.05),B組和C組miR-141 mRNA比較差異無統計學意義(P>0.05),與C組相比,D組miR-141 mRNA降低,差異具有統計學意義(P<0.05),見圖2。
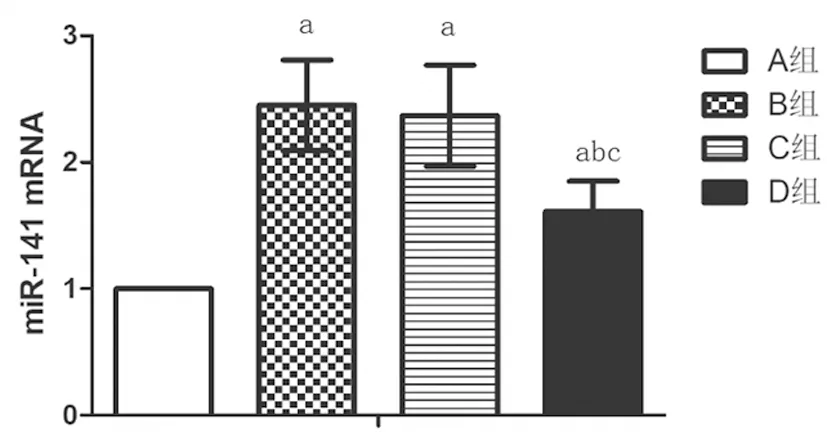
圖2 各組hMSCs中miR-141 mRNA表達注:與A組相比,aP<0.05;與B組相比,bP<0.05;與C組相比,cP<0.05
2.4MTT檢測各組hMSCs細胞存活:與A組相比,B組hMSCs細胞活性降低,差異具有統計學意義(P<0.05),B組和C組24h、48h及72h hMSCs細胞活性差異無統計學意義(P>0.05),與C組相比,D組MSCs細胞24h、48h及72h 活性升高,差異具有統計學意義(P<0.05),見表2、圖3。

表2 各組hMSCs細胞存活OD值(490nm)

圖3 各組hMSCs細胞存活OD值比較注:與A組相比,aP<0.05;與B組相比,bP<0.05;與C組相比,cP<0.05
2.5流式細胞儀檢測各組hMSCs細胞凋亡率:A組、B組、C組及D組hMSCs細胞凋亡率分別為(4.23±0.33)、(20.73±1.20)、(19.43±1.16)及(14.76±0.80),各組間比較差異具有統計學意義(F=381.00,P<0.001);與A組相比,B組hMSCs細胞凋亡率升高,差異具有統計學意義(P<0.05),B組和C組hMSCs細胞凋亡率比較差異無統計學意義(P>0.05),與C組相比,D組hMSCs細胞凋亡率降低,差異具有統計學意義(P<0.05),見圖4。

圖4 各組hMSCs細胞凋亡率比較(n=6)
2.6各組hMSCs細胞VEGF、TGF-β2蛋白水平比較:與A組相比,B組VEGF、TGF-β2蛋白水平降低,差異具有統計學意義(P<0.05),B組和C組VEGF、TGF-β2蛋白水平差異無統計學意義(P>0.05),與C組相比,D組VEGF、TGF-β2蛋白升高,差異具有統計學意義(P<0.05),見表3、圖5。

表3 各組hMSCs細胞VEGF TGF-β2蛋白水平比較
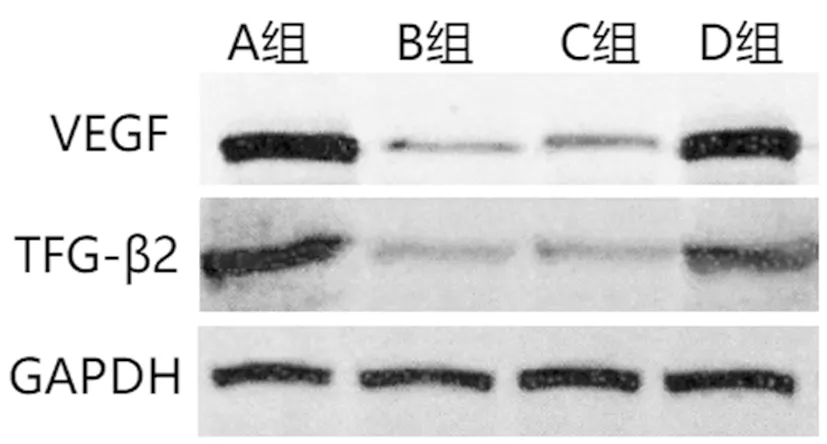
圖5 各組細胞VEGF、TGF-β2蛋白水平比較
2.7各組hMSCs細胞VEGF、TGF-β2mRNA比較:與A組相比,B組hMSCs細胞VEGF、TGF-β2mRNA降低,差異具有統計學意義(P<0.05),B組和C組VEGF、TGF-β2mRNA比較差異無統計學意義(P>0.05),與C組相比,D組hMSCs細胞VEGF、TGF-β2mRNA升高,差異具有統計學意義(P<0.05),見表4。

表4 各組細胞VEGF TGF-β2 mRNA比較
2.8miR-141對VEGF、TGF-β2調控作用:為了明確miR-141相關VEGF、TGF-β2情況,使用生物信息學發現miR-141與VEGF、TGF-β2由相互結合的序列,證明之間存在調控關系。為了驗證miR-141相關VEGF、TGF-β2的3′UTR結合,我們將miR-141轉染到細胞中,通過抑制miR-141觀察對VEGF、TGF-β2的熒光活性變化,證實:miR-141-siRNA能夠上調VEGF、TGF-β2活性,miR-141-siRNA能與VEGF、TGF-β2的3′UTR特異性結合,見表5。

表5 miR-141對VEGF TGF-β2調控作用
3 討 論
hMSCs細胞屬于自我更新及分化較強的細胞,hMSCs可分化為成骨細胞及骨髓結締組織等對于改善骨損傷及加強軟骨修復具有重要作用[8]。hMSCs表明抗原CD44、CD13呈現陽性,CD14及CD45呈現陰性,利用流式細胞儀證實了股骨髖骨骨折及激素性股骨頭壞死中提取的hMSCs滿足實驗需要。股骨頭壞死的誘發原因之一為長期使用激素可導致機體過氧化物酶體增殖物活化受體γ(PPAPγ)升高可導致脂肪細胞在骨髓中沉淀增加成脂分化紊亂進一步抑制成骨細胞活性而降低骨修復[9]。因此,通過增加hMSCs活性抑制成脂分化及增加成骨細胞活性對于減少股骨頭壞死具有重要意義。
近些年隨著生物分子靶向技術的發展,經研究證實miRNAs與多種疾病發生發展存在關聯。miRNAs廣泛存在于各種生物體內,其家族成員之間存在高度同源序列,可通過對靶向基因進行完全和非完全的配對進而發揮抑制翻譯、轉錄等作用[10]。早在2008年Kobayashi發現miRNAs與骨存在關系,并敲除了小鼠體內內切核酸酶Dicer后發現小鼠hMSCs細胞成骨分化能力消失,導致骨生成減少及骨密度降低,而Dicer屬于miRNA合成必需的一類酶類,說明miRNA在骨發育有重要作用[11]。miR-141是miRNAs家族成員之一,在骨質疏松中miR-141-3p表達升高能夠充當hMSCs活性的負性調節因子,沉默后可改善低骨量疾病[12]。目前,miR-141在股骨頭壞死中的研究暫無,但張文明等[13]等研究證實了miR-141在骨形成中也發揮調節作用,并進行hMSCs細胞實驗證實了抑制miR-141表達可增加成骨細胞增殖及分化,認為主要是通過調節Wnt靶基因而發揮作用。本文研究證實,轉染miR-141-siRNA能夠提高hMSCs細胞存活,降低凋亡。沉默miR-141對hMSCs細胞的調節作用,主要是對成骨基因進行調節而間接增加骨形成而降低對hMSCs細胞活性抑制作用。張志恒等[14]研究表明,miR-141的內源性降低后可減少對同源轉錄因子5(DLX5)的靶向抑制表達升高可激活上調因子Runt相關轉錄因子2(Runx2)而促進成骨形成。張楚天等[15]研究表示,抑制miR-141可增加BMSCs成骨分化作用主要在于激活調控Dlx5/Runx2信號進而發揮預防和治療絕經后骨質疏松的目的。本文認為抑制miR-141后可減少對VEGF及TGF-β2的抑制而增加hMSCs細胞進而改善股骨頭壞死。
VEGF被稱為最有力的血管生長因子,能夠增加血管內皮細胞分化而增加血管新生。從骨形成細胞水平,VEGF可增加hMSCs細胞聚集及分化而增加成骨細胞活性,可全身性及局部性調節骨形成。TGF-β2可影響血管生成而增加hMSCs細胞活性。在骨生長及修復過程中TGF-β2及VEGF可相互影響而增加骨組織血管新生,并可直接作用與hMSCs細胞可增加其活性,提高分化功能而改善骨組織缺血。本文研究發現,在hMSCs細胞中抑制miR-141可增加TGF-β2及VEGF表達。據此我們推測抑制miR-141在hMSCs細胞調節可能是通過激活TGF-β2及VEGF實現的。為了進一步驗證這種預測,我們將含有TGF-β2及VEGF的3'-UTR序列的熒光素酶報告基因與miR-141siRBA共轉染于hMSCs細胞中來證明其靶基因關系。驗證miR-141對目的基因TGF-β2及VEGF的靶向作用。Choi S K[16]研究表示,miR-141的靶標主要為MAPK1、VEGF-A、EGFR、YAP1、STAT4,分別來自Star Base和Target Scan,通過靶向上述指標miR-141可促進血管疾病發生發展。但是在股骨頭壞死hMSCs細胞的抑制miR-141對TGF-β2及VEGF作用機制還需要進一步研究證實。
本文存在一定局限性,miR-141對于TGF-β2及VEGF研究機制還需要進一步實驗,實驗結果存在單一性,今后應豐富實驗內容,加強與其他單位合作,完善其作用機理,為股骨頭壞死臨床研究提供實踐基礎。綜上沉默miR-141能夠通過提高股骨頭壞死骨髓間質干細胞活性,抑制凋亡發揮髓間質干細胞保護作用,研究機制可能與激活VEGF、TGF-β2活性相關。

