原發性肝癌發生KRAS基因突變患者的超聲特征及KRAS基因突變與淋巴結轉移的相關性
黃詩雯 曾美惠
作者單位:363000 福建漳州 聯勤保障部隊第九〇九醫院(廈門大學附屬東南醫院)超聲科
HCC起病隱匿,早期臨床表征并不顯著,中晚期會伴有肝區疼痛、黃疸、發熱、乏力、納差、進行性消瘦及自發性低血糖和紅細胞增多等表現[1-2]。與多數癌癥相似,其發病機制尚未完全明確,但可以明確的是惡性腫瘤的發生發展過程均離不開基因和蛋白的調控作用[3]。隨著醫療科技的發展,個體化藥物和靶向藥物治療已逐漸成為治療腫瘤患者的新方向。目前有與結腸癌相關的研究顯示,KRAS基因突變可致使其自身磷酸化,并長期處于激活狀態,導致KRAS基因突變患者對于抗表皮生長因子(epidermal growth factor receptor,EGFR)藥物應答不佳,且BRAF V600E突變的患者可能無法從EGFR藥物治療中取得較好的臨床效果[4-6]。美國國家綜合癌癥網絡(NCCN)明確提出,KRAS基因狀態對EGFR單抗靶向藥物的臨床療效預測價值較高,建議行常規檢測。索拉非尼是可有效延長肝癌患者生存時間的小分子多靶點藥物,可直接作用于CRAF和BRAF,延緩腫瘤進展,但其總體治療有效率仍不十分理想[7]。
資料與方法
一、一般資料
納入2018年3月至2021年3月聯勤保障部隊第909醫院收治的原發性肝癌患者168例,根據淋巴結轉移情況將其分為肝癌伴肝外轉移患者組(n=63)和無肝外轉移組(n=105)。肝癌伴肝外轉移組年齡38~74歲,無肝外轉移組患者年齡35~73歲。兩組患者年齡、性別、AFP水平及有無手術和介入治療等資料差異無統計學意義(P>0.05),見表1。所有患者及其法定代理人均知曉該研究方案且簽署同意書,該方案通過醫院倫理委員會的批準。
二、納排標準
納入標準:①原發性肝癌診斷參照《原發性肝癌的分層篩查與監測指南(2020版)》[8]相關標準;②入院前未接受過任何抗腫瘤治療;③均經病理學明確診斷為原發性肝癌;④未合并其他惡性腫瘤。
排除標準:①繼發性肝癌;②合并其他惡性腫瘤;③合并重要臟器嚴重疾病者;④臨床資料不全者。
三、方法
KRAS基因突變檢測:分別采集兩組患者的外周血各10 mL,通過TAKARA基因提取試劑盒提取血液中的DNA,測量基因組DNA在260 nm波長時的A值。雙鏈DNA濃度=A260×樣品稀釋倍數×(50/1000)。應用人類KRAS/NRAS基因突變聯合檢測試劑盒對KRAS基因突變情況進行檢測。免疫組化檢測KRAS蛋白表達:將切片置于65℃烤箱中烘烤3 h,脫蠟、水化;PBS沖洗3次,3 min/次。抗原修復:加入氧化酶阻斷溶液(試劑A),于室溫下孵育10 min;除去PBS,加入正常非免疫動物血清(試劑B),在室溫下孵育10min后,去除血清,滴加一抗,4℃過夜或室溫下孵育60 min。PBS沖洗3次,3 min/次;將PBS除去后,滴加二抗,室溫孵育10 min;PBS沖洗3次,每次3 min;將PBS除去后,滴加鏈霉菌抗生物素、過氧化酶溶液(試劑D),孵育10 min,PBS沖洗3次,每次3 min;加入新鮮配制的DAB溶液,顯微鏡下觀察3~10 min;經自來水沖洗后,蘇木素復染10 min,PBS沖洗反藍20 min;梯度酒精脫水干燥,以中性樹膠封固,并分析結果。肝臟的彩色多普勒成像:使用彩超儀3.5 M探頭對整個肝臟及其周圍臟器的回聲進行探測,記錄肝臟腫瘤直徑、結節個數,并進行血流分級。Ⅰ級:瘤體及周邊可見血流信號,血流信號呈稀疏星點狀;Ⅱ級:腫瘤體內及其周邊線狀血流信號≥3條;Ⅲ級:瘤體內及其周邊可見秘技彩色血流信號。并記錄肝臟血管內侵襲情況和彩色血流特點,測定體內血流阻力指數(RI)。
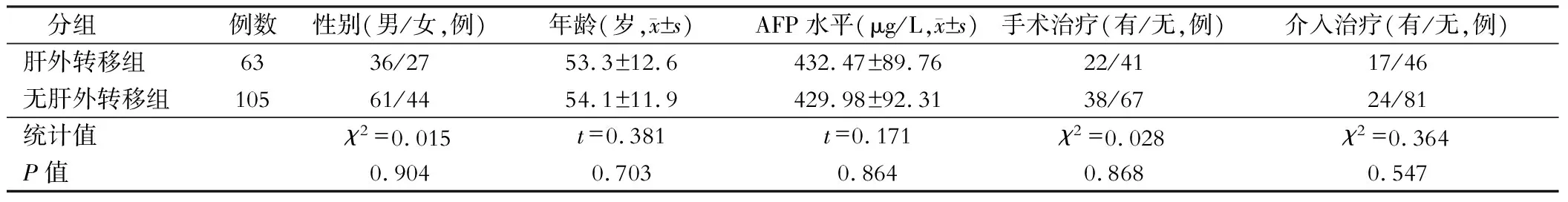
表1 兩組患者的一般資料對比
四、統計學方法
結 果
一、兩組患者的KRAS突變情況
168例肝癌患者中,36例患者發生KRAS基因突變,均為肝外轉移組患者,基因突變率為57.14%(36/63),無肝外轉移組患者KRAS基因突變率為0,差異有統計學意義(χ2=76.364,P<0.05)。
二、KRAS蛋白高表達與低表達患者的超聲特征比較
將36例KRAS基因突變的原發性肝癌患者根據KRAS蛋白表達水平再次分組,結果顯示,KRAS高表達組與KRAS低表達組對比,除腫瘤大小差異無統計學意義(P>0.05)外,腫瘤結節個數、腫瘤包膜、血流分級Ⅲ級及血管侵襲等,差異均有統計學意義(均P<0.05)。見表2。
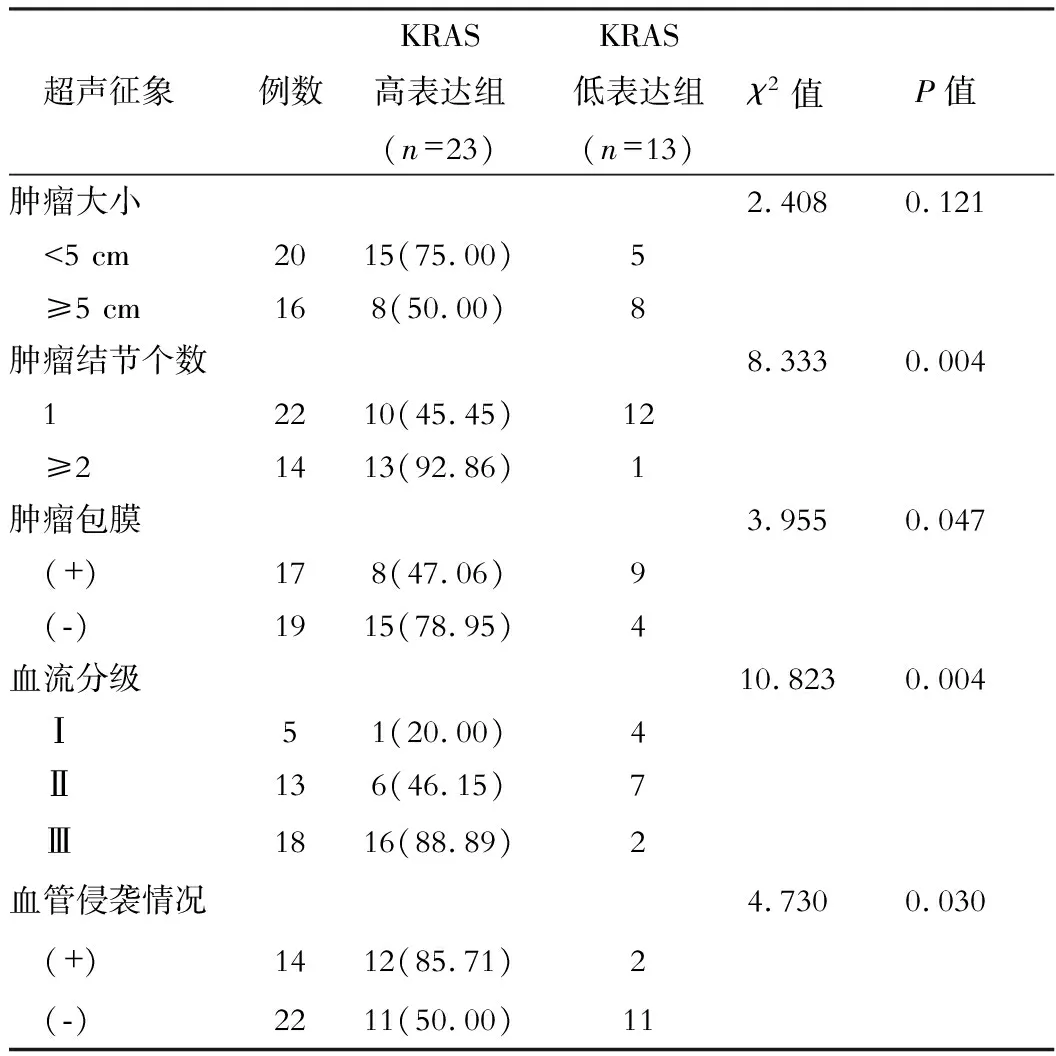
表2 KRAS高表達與低表達組超聲特征比較[例(%)]
三、KRAS蛋白表達和腫瘤結節數與RI的關系
KRAS蛋白高表達組RI為1.36±0.14,高于KRAS蛋白低表達組的0.58±0.07,腫瘤結節數≥2的14例患者RI為1.08±0.09,腫瘤結節數為1個患者的RI為0.57±0.05,差異有統計學意義(t=18.725、21.897,P<0.05)。
四、 超聲特征參數與肝癌組織中KRAS蛋白表達水平的相關性分析
logstic二元回歸分析結果顯示,肝癌組織中KRAS蛋白的表達水平與腫瘤結節個數、腫瘤包膜、血流分級、血管侵襲情況及RI等超聲參數均顯著相關。KRAS蛋白的表達水平越高,腫瘤的包膜形成減少,腫瘤結節個數越多,血管侵襲情況越嚴重,血流分級和RI值越高。見表3。
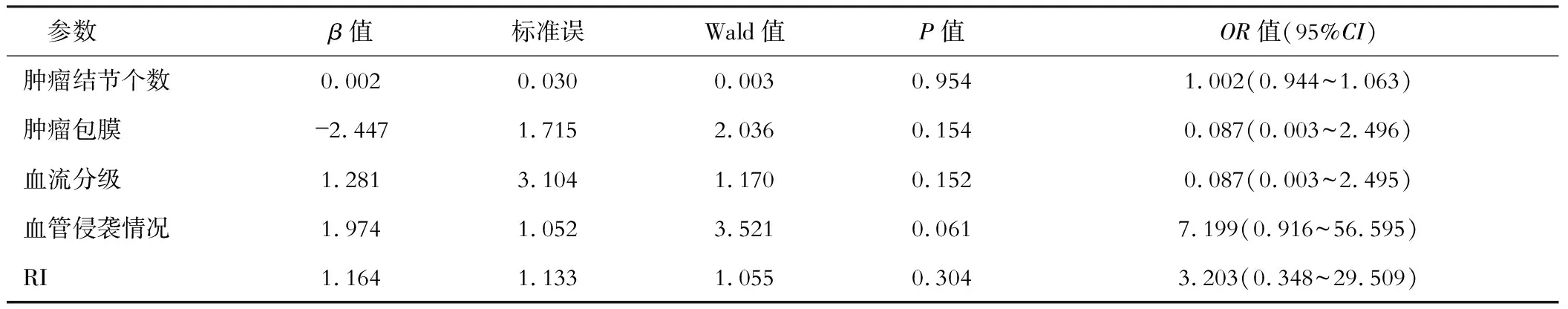
表3 超聲特征參數與肝癌組織中KRAS蛋白的表達水平的相關性分析
討 論
RAS基因是一種細胞內信號傳導蛋白類原癌基因,其表達蛋白位于細胞膜內側,是一種GTP/GDP結合蛋白,在EGFR信號通路中具有重要的調控作用[9-11]。RAS蛋白可作為分子開關調控信號傳遞至細胞內。目前已知與人類腫瘤相關的特征性RAS基因包含HRAS、NRAS和KRAS 3種。一旦基因發生突變,RAS會相應的出現異常活化,繼而對細胞生長和生化過程起到促進作用,引發腫瘤[12]。突變的RAS癌基因種類與腫瘤類型存在一定的聯系,如HRAS基因突變多見于泌尿系統腫瘤,NRAS基因突變在造血系統腫瘤中更為常見,KRAS基因突變則在結直腸癌、肺癌、胰腺癌及呼吸道腫瘤中更為常見。KRAS的肝臟特異性突變可直接引發肝細胞癌和肝內膽管癌[13, 14]。且NCCN也明確指出,KRAS基因狀態可作為預測EGFR單抗靶向藥療效的良好指標。KRAS基因突變雖可使抗EGFR藥物治療失去效果,但KRAS基因突變患者卻仍有從索拉非尼治療中取得臨床獲益的可能,因此,評估肝癌患者KRAS基因突變情況具有重要的意義。本研究168例肝癌患者中共檢出36例患者KRAS基因突變,伴肝外轉移組患者KRAS基因突變率高于無肝外轉移組患者,表明KRAS基因突變與肝癌伴肝外轉移顯著相關,與尹小蘭等[15]研究結論基本一致。
本研究還發現,KRAS蛋白在腫瘤結節數≥2個、腫瘤包膜(-)、血流分級Ⅲ級及血管侵襲情況(+)的患者中表達水平較腫瘤結節數1個、腫瘤包膜(+)、血管侵襲情況(-)及血流分級Ⅰ、Ⅱ級的患者明顯偏高。有研究顯示,瘤體的超聲血流系數可能與腫瘤的部分基本生物學特征存在相關性[16]。研究發現肝癌組織中KRAS蛋白的表達水平與腫瘤結節數、腫瘤包膜、血流分級、血管侵襲情況均顯著相關。KRAS蛋白的表達水平越高,腫瘤的包膜形成減少,腫瘤結節數越多,血管侵襲情況越嚴重。表明KRAS基因可能參與了肝癌瘤體血管形成過程。
RI可用于評價動脈血流阻力,不會受到測量方位及測量角度的影響,因此,其測量值可有效反映真實情況。本研究結果提示,肝腫瘤結節數量越多,RI值也越高。分析其原因在于腫瘤的肝內轉移增加,導致血供需求增加,進而使得肝動脈的血管直徑和最大流速也隨之升高,血管分支數量增加,走向異常,動脈血流收縮和波動性增強。由于腫瘤瘤體內的供應血管管壁無平滑肌,且彈性不佳,再加上腫瘤假包膜的破壞、門靜脈癌栓及動靜脈瘺生成,導致腫瘤內血管形成竇腔,舒張末期血流速度減慢,致使RI升高。本研究還發現RI值與KRAS基因表達顯著相關,KRAS基因表達水平隨RI值升高而增加。
綜上所述,發生KRAS基因突變的肝癌患者KRAS基因表達與其淋巴結轉移和多普勒超聲影像特征顯著相關,分析肝癌患者的KRAS基因突變情況聯合術前超聲多普勒超聲可有效提高臨床對肝癌的診斷效率,指導臨床選擇更為合理的治療方案。本研究仍存在一定的不足之處,如納入的患者樣本量較小,未在肝癌疾病治療前檢測KRAS基因突變情況,對其靶向治療的臨床價值加以明確,今后仍需進一步擴大化的中心試驗深入探索。
利益沖突聲明:所有作者均聲明不存在利益沖突。

