利用生物信息學設計基于抗原表位的非洲豬瘟疫苗的總效果
何娜 譯自,2020,9
范美紅 校 李 紅 審 張 濤 制圖
非洲豬瘟(African swine fever,ASF)病毒是引發ASF 的病原體,是全球家豬和野豬最致命的病原體之一。20 世紀20 年代,在肯尼亞引進歐洲家豬后,該病首次被發現。在20 世紀上半葉,該病的暴發主要局限在撒哈拉以南的非洲東部和南部的豬群中。之后,ASF 病毒蔓延到全球各地,不僅在其他非洲國家,而且在歐洲、南美洲、大洋洲和亞洲的豬群中流行。最近一次從非洲傳入歐洲的ASF 病毒引發了有史以來最大規模的ASF 疫情,成為當今全球養豬業的頭號威脅。由于其潛在的破壞性影響,ASF 被列為必須向世界動物衛生組織強制通報的疾病。
在非洲,ASF 病毒的主要宿主是非洲野豬,如感染后無臨床癥的疣豬(Phacochoerus africanus)和布什豬(Potamochoerus larvatus)。在這些地區,ASF 病毒感染離不開鈍緣蜱(Ornithodoros)屬的蜱蟲這類蟲媒載體,它們負責向家豬傳播ASF 病毒。如今,直接接觸受感染的材料已經成為ASF 病毒在歐洲和亞洲的豬群中傳播的主要風險因素,如病死豬的尸體或豬肉制品,以及接觸感染豬的人。歐亞大陸的野豬也容易感染ASF 病毒,感染后表現出與家豬相似的臨床癥狀和死亡率,影響了歐亞大陸防控ASF 的效果。ASF 病毒可引起感染豬出現急性出血熱,這種病毒的毒力很強,死亡率幾乎100%。目前,對ASF 的防控還沒有疫苗或治療藥物,控制病毒傳播的唯一有效方法是撲殺受影響地區的所有豬,即受感染的豬和可能與之接觸過的豬。需要安全地處理病死豬的尸體和其他被污染的材料,這包括實施最大限度的控制措施和生物安全措施,以及限制豬及其衍生產品的流動。
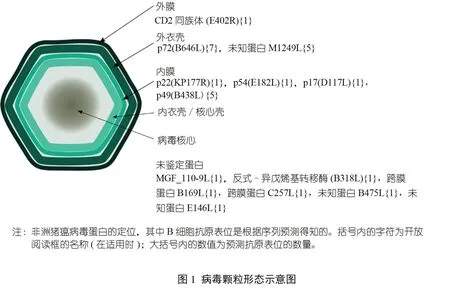
ASF病毒是非洲豬瘟病毒科(Asfarviridae) 的唯一成員,是屬于核質大型DNA 病毒(nucleocytoplasmic large DNA viruses,NCLDVs)組的一種巨型病毒(約200 nm)。該病毒有一個復雜的多層結構,由多個脂質和蛋白層組成(圖1),基因組被第一層蛋白層包裹著,該蛋白層由核心殼內衣殼組成,而核心殼內衣殼又被內脂雙層膜覆蓋,該膜包含在一個二十面體蛋白質衣殼中。細胞外顆粒通過質膜排出時獲得脂質外膜。ASF 病毒的主要靶細胞是巨噬細胞,也感染樹突狀細胞和其他單核細胞。病毒基因組由一個長度為170~193 kb 的雙鏈DNA 分子組成,可編碼150 多個開放閱讀框(open reading frames,ORFs),包括其自身的復制機制、基因調控、宿主防御逃避因子以及其整套結構蛋白。病毒在基因組長度和ORFs 數量上的差異主要歸因于位于基因組兩端可變區域的多基因家族(multigene family,MGF) 基因數量的不同,而在中央保守區域的基因中可以發現更細微的差異。值得注意的是,許多病毒蛋白的功能仍未知。
來自不同國家、不同發病地、具有不同毒力水平的多種ASF 病毒分離株已得到了確認。ASF 病毒的第一個完整的基因組序列來自20 世紀70 年代初在巴達霍斯(西班牙)獲得的分離株,該分離株適合在Vero 細胞(Ba71V)中生長。此后,許多其他基因組也已完成,截至2020 年8 月,在通用蛋白質數據庫(universal protein resource,UniProt)中獲得了來自不同病毒突變體或分離株的46個蛋白質組。根據主要的衣殼蛋白p72 基因(B646L)3’端序列的分析,可將其分為22 種不同的基因型。從地理位置上看,在非洲,ASF 病毒的基因型變異最大,而在歐洲、美洲和亞洲,僅發現了基因Ⅰ型和基因Ⅱ型的分離株。到目前為止,還沒有證據表明ASF 病毒的基因型與其毒力有關。
感染后存活的豬會產生免疫力,接種減毒病毒會誘發動物機體產生免疫反應和變異株特異性保護作用。因此,盡管安全問題限制了減毒活疫苗的田間應用,但仍可以推行疫苗接種策略來進行一定程度的預防。其他免疫方法,如蛋白質亞單位或DNA 構建體,雖然其中一些能誘發特異性免疫反應,但無法達到減毒活病毒所能達到的保護水平。盡管使用減毒活疫苗和亞單位疫苗獲得的體內保護數據很少,但可以確定分子和免疫學機制參與了這種保護。一方面,盡管引發保護性反應的特異性T 細胞決定因素在很大程度上仍然未知,但已廣泛證實特異性T 細胞起著關鍵作用。另一方面,已經發現了幾種ASF 病毒血清學決定因素,但它們的保護作用尚不清楚。然而,據報道,ASF 病毒特異性抗體的被動轉移可提供免疫保護,證明其在控制感染上能發揮一定的作用。此外,新的證據表明,微生物群可能在防御病毒方面起著重要的作用,因為將疣豬的糞便移植到家豬身上,可以實現對ASF 病毒的部分免疫保護。
另一種針對多種抗原的疫苗設計策略,能夠在不影響安全性的情況下誘發動物機體產生保護性免疫反應,這可能是解決病毒生物學復雜性的一種方法。在這方面,反向疫苗學(reverse vaccinology,RV) 的應用,對篩選越來越多的ASF 病毒序列以尋找最佳靶抗原表位非常有幫助。為開發難以分離和培養的病原體的疫苗,反向疫苗學是基于對病原體基因組和/或蛋白質組數據的計算分析,以確定對假設的疫苗最感興趣的蛋白質。使用計算機模擬方法(in-silico approach)還可以考慮病毒的變異性,特別是確定不變區域,有助于設計出具有廣泛保護性疫苗(pan-protecting vaccines)。同樣,它可以避免誘導保護性免疫反應所不需要的序列或可能會導致疾病惡化的序列。令人鼓舞的是,已經有一種利用反向疫苗學生產的針對腦膜炎奈瑟菌血清B 群的疫苗于2013 年獲得許可。
1 結果
1.1 ASF 病毒蛋白空間分析
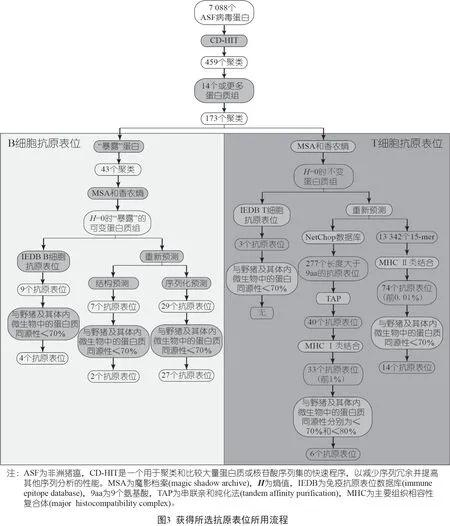
從UniProt 中46 個可用的病毒蛋白質組中下載了7 088 條ASF 病毒蛋白質序列。總的來說,由于蛋白質數量異常,有7 個蛋白質組被去掉:Kyev 2016(UP000321214)、波蘭2016o23(UP000274966)、波蘭2016o9(UP000268777)、波蘭2017C220(UP000282187)、波蘭2016o10(UP000278405)、撒丁島 Sassari 2008(UP000266411)和南非1985/SPEC 57(UP000423628)。
用CD-HIT*CD-HIT是一個用于聚類和比較大量蛋白質或核苷酸序列集的快速程序,以減少序列冗余并提高其他序列分析的性能。進行蛋白質聚類產生了459 個聚類。為了考慮每個聚類中ASF 病毒的變異性,我們去掉了序列源自少于14 個不同蛋白質組的聚類。選擇該閾值是因為這是來自ASF病毒基因Ⅱ型(格魯吉Georgia 2007/1 分離株)的可用ASF 病毒蛋白質組的數量,目的是保留所有可能的ORFs 屬于該基因型。因此,我們考慮進一步分析173 個包含14 個或更多不同ASF 病毒蛋白質組的蛋白質簇。值得注意的是,為量化位置的變異性而計算香農熵(Shannon entropy) 值顯示,在集群的多序列排列(multiple sequence alignments,MSAs)中,82.5%的氨基酸位置是完全不變的,即熵值H=0。因此,為了盡可能的嚴格,所有后續分析都是用指定香農熵閾值為H=0 的不變的共識蛋白質組(consensus proteome)來完成的。
1.2 鑒定ASF 病毒假定暴露的蛋白質(putative-exposed proteins)
到目前為止,在ASF 病毒的表面只確定了一種蛋白質:CD2 同系物(ORF:E402R)。為了鑒定病毒蛋白,我們付出了更多的努力,這些蛋白可能存在于受感染細胞膜的外表面和/或細胞外病毒粒子,因此容易被抗體中和。為了確定假定的暴露蛋白質,我們用亞細胞定位預測工具預測ASF 病毒格魯吉2007/1 分離株蛋白質組(UP000141072),根據注釋規范(criteria of annotation)和預測的信號肽序列和/或至少一個跨膜結構域,共選擇了49 個假定的暴露蛋白質。假定暴露的蛋白質包括那些被預測為暴露的蛋白質,以及那些以前被描述為形成一部分外衣殼的蛋白質,在無包膜的感染性顆粒的情況下是抗體的潛在靶位點。所有這些都被標記為“暴露”,并與ASF病毒蛋白質組的其他部分聚類,以找到所有ASF 病毒“暴露”蛋白質的同系物。在包括14個或更多ASF 病毒蛋白質組的173 個聚類中,只有43 個具有“暴露”蛋白質,并選中用于進一步探索B 細胞抗原表位的存在。
1.3 B 細胞抗原表位的選擇
我們在免疫抗原表位數據庫(immune epitope database,IEDB) 中發現了該病毒102 個經實驗驗證的、獨特的抗原表位,其中76 個是B 細胞抗原表位。我們保留了那些來源于假定的暴露蛋白的序列,然后對照ASF 病毒不變的“暴露”蛋白質組解析了它們的全序列。結果發現了9 個保守的B 細胞抗原表位。為了進一步組織和管理這一選擇,我們使用BLASTP 將這些序列與野豬蛋白質組和其微生物群的蛋白質組進行了比對。我們放棄了那些與野豬的蛋白質或其微生物群的蛋白質同源性大于70%的序列,將名單減少到來自3 個不同蛋白的4 個保守的B 細胞抗原表位:兩個來自主要的衣殼蛋白p72(B646L),兩個來自內衣殼蛋白p22(KP177R) 和p54(E183L)。結果發現,抗原表位VCKVDKDCGSGEHCV(p22 蛋白)和FPENSHNIQTAGKQD(p72 蛋白) 與基于序列預測的抗原表位具有相同的殘基;后者也與結構化預測抗原表位共享殘基。
1.4 重新(de novo)預測的B 細胞抗原表位
除了免疫抗原表位數據庫(IEDB) 中傳統的B 細胞抗原表位外,我們還采用了兩種方法來預測新的抗原表位:基于序列的方法和基于結構的方法。按照基于序列的方法,我們檢索到42 個在ASF 病毒中保守的潛在B 細胞抗原表位。對于那些我們預測的跨膜結構域的蛋白抗原表位,我們繪制了它們的圖譜,以評估它們在“外部”的定位。任何映射到跨膜蛋白內測或跨膜位置內的表位都被丟棄。此外,我們用PyMOL 軟件*PyMOL 軟件一款功能強大的分子可視化軟件,適用于創作高品質的小分子或生物大分子(特別是蛋白質)的三維結構圖像;以Py+MOL 命名指,“Py”表示它是由一種計算機語言Python 所衍生出來的,“MOL”表示它是用于顯示分子(英文為molecule)結構的軟件。對主要的衣殼蛋白p72(PDB ID:6L2T)的潛在抗原表位進行了觀察,并丟棄了那些沒有暴露的抗原表位,即面向病毒粒子外衣殼抗原表位。通過這種方法,我們將列表中的抗原表位減少到29 個,并取消了另外兩個抗原表位,因為它們與野豬或其糞便中微生物群的蛋白質序列的同源性大于70%。所選擇的27 個預測的B 細胞抗原表位來自于13 種不同的蛋白。其中一些抗原表位與在IEDB 中驗證的序列具有相同的殘基。這是由于IEDB 中的抗原表位是根據共識蛋白質組進行整體解析的,這導致放棄了具有可變位置的長序列和/ 或與豬體內蛋白質的同源性大于70%的序列。
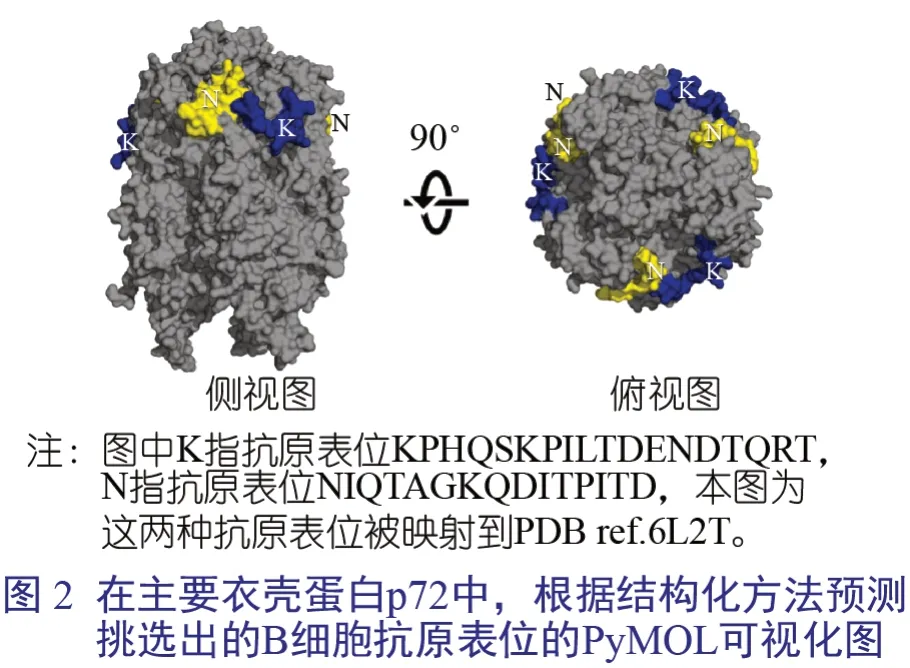
對于基于結構的方法,我們對蛋白質數據庫(protein data bank,PDB)中提供的ASF病毒主要衣殼蛋白p72 兩種結構上的殘基的靈活性和殘基相對可溶性(relative solvent accessibility,RSA) 施加了特定的限制:6KU9 和6L2T。我們確定了13 個潛在的抗原表位,這些抗原表位在“暴露”的不變蛋白質組中也是保守的。在丟棄非獨特的肽后,由于p72 同源三聚體組裝成殼體,并融合了重疊的抗原表位,我們最終得到了8 個獨特結構預測的B 細胞抗原表位,其中僅有3 個與野豬及其微生物群的蛋白質的同源性不超過70%,均來自PDB 結構6L2T。在PyMOL 軟件觀察它們的易接近性時,我們去掉了位于該蛋白質底部的一個抗原表位,因此是非暴露的。其余兩個潛在的抗原表位顯示在圖2 中。這兩個抗原表位是基于序列的方法預測的。
1.5 CD4+T 細胞抗原表位的選擇
在免疫抗原表位數據庫的102 個經實驗驗證的抗原表位中,26 個是T 細胞抗原表位。這些抗原表位缺乏有關與主要組織相容性復合體(major histocompatibility complex,MHC)結合的信息,但考慮到它們的長度(≥15個氨基酸),我們認為它們是CD4+T 細胞抗原表位。只有三個是保守的,都來自同一個蛋白質CD2 同系物。然而,利用BLASTP 與豬及其微生物群的蛋白質進行比對時,這些蛋白質的同源性都不超過70%,所以去掉了它們。
1.6 預測新的CD4+T 細胞抗原表位
我們沒有在IEDB 中找到符合選擇標準的ASF 病毒CD4+T 細胞抗原表位,所以我們預測了新的CD4+T 細胞抗原表位,以確定它們是否可能會被納入疫苗集合(ensemble)中。在不變的蛋白質組上應用 IEDB MHC Ⅱ類結合預測工具,共產生了13 342 個潛在的15-mer 抗原表位,我們繼續研究前0.1%結合者中的273 個序列,其中大部分是較大肽的15-mer 片段。重疊序列的融合產生了74 個獨特的肽序列。我們去掉了任何被預測為只與一個等位基因結合的抗原表位,因此,我們保留了16 個序列。利用BLASTP 對野豬及其微生物群的蛋白質進行對比后,我們從13 個不同的蛋白質中選擇了14 個潛在的抗原表位,這些抗原表位與這些蛋白質的同源性不超過70%。
1.7 CD8+T 細胞抗原表位的選擇
在免疫抗原表位數據庫中沒有經實驗驗證的CD8+T 細胞抗原表位,而文獻檢索也沒有發現任何存在于不變蛋白質組中的抗原表位。因此,我們使用模仿這些抗原表位在細胞內自然處理途徑的步驟序列來預測新的CD8+T 細胞抗原表位。
蛋白酶體加工不變的蛋白質組產生了277個最小長度為9 個氨基酸的保守肽,任何短于9 個氨基酸的片段都被去掉。我們從那些大于9 個氨基酸長度的蛋白酶體反應衍生的片段中創建了所有可能重疊9-mer 的多肽組合,產生了669 個潛在的抗原表位。我們采用log(IC50) 值為1 作為串聯親和純化法(tandem affinity purification,TAP) 的閾值,將潛在的抗原表位列表限制在40 個肽的序列。IEDB MHC Ⅰ類結合工具預測了其中33 個在前1%內,其中22 個與野豬蛋白質的同源性不超過70%。然而,考慮到與微生物群的蛋白質的潛在交叉反應性,我們提高到了≤80%的同源性閾值。選定的潛在CD8+T細胞抗原表位的最終清單僅包含來自6 個不同蛋白質的6 條肽。
2 討論
自2018 年以來,非洲、歐洲、亞洲和大洋洲的幾十個國家都暴發了ASF,中國首次報道于2018 年,根據官方的消息,亞洲生豬總損失估計超過600 萬頭。
由于目前尚無有效的治療方法,針對ASF病毒的防控顯然迫切需要有效的方法,但還沒有成功開發出安全且有效的疫苗。目前,大多數后期的免疫力都是利用自然發生或在實驗室產生的減毒活病毒進行的。例如,用低毒力的NHV/1968 變異體進行免疫接種,可對密切相關但高毒力的ASF 病毒L60 分離株產生免疫力。因此,對異源性分離株的挑戰只能達到部分免疫,并且對接種豬產生了有害的副作用。另一個有希望的疫苗接種策略是使用缺失CD2 同源蛋白的ASF 病毒Ba71 分離株。這種毒力減弱的病毒可提供對母體病毒的免疫力,也可提供對異源變體ASF 病毒E75 分離株和ASF 病毒格魯吉2007/1 分離株的免疫,而不會產生明顯的副作用。令人震驚的是,同樣的原則在使用CD2 同源缺乏的Georgia 2007/1 分離株時未能產生免疫保護,突出了ASF 病毒的表型多樣性。一個合理的解釋可能是存在冗余的ORFs,可以覆蓋CD2 同系物的基本功能。事實上,ASF 病毒格魯吉2007/1 分離株與Ba71 分離株相比顯示出更大的復雜性,與后者相比前者有更多的ORFs。這進一步加強了我們對ASF 病毒格魯吉2007/1 分離株的關注,因為我們想盡可能地解決這種復雜性。
也有人嘗試用轉基因病毒進行免疫接種,但在誘發的免疫水平、獲得對異源分離株的保護或出現有害的副作用方面結果各異。人們也在追求用ASF 病毒亞單位的特定病毒蛋白進行免疫。這類疫苗比上述方法更加安全,有各種基于亞單位免疫的許可產品的例子。然而,對于ASF 病毒來說,這種策略只能提供部分保護或根本不提供保護。
在本研究中,我們使用計算機輔助方法來確定一組ASF 病毒抗原表位,這可能對設計基于抗原表位的ASF 疫苗很有意義(圖3)。為了激發廣泛而強大的免疫反應,以抵御異源性分離株的挑戰,我們優先選擇了在不同ASF 病毒分離株中嚴格保守的潛在抗原表位序列。選擇保守的抗原表位也有一個好處,就是對ASF病毒而言這些高度保守區域在生物學上可能是必需的,因此可用于制作疫苗的理想靶區。然而,任何選擇的抗原表位必須能夠誘導動物機體產生真正的保護性反應,因為即使存在中和抗體,涉及非中和(non-neutralized)ASF 病毒的慢性感染已被大量地報道。
在選擇B 細胞、CD4+T 細胞和CD8+T 細胞的抗原表位時,我們采取了多種策略,包括查詢免疫抗原表位數據庫的傳統實驗方法,以及通過成熟的免疫信息學工具對抗原表位進行重新預測。對序列進行優先排序的依據是其與野豬及其微生物群的蛋白質的同源性不超過70%這一閾值。這樣做的理由是:首先,任何具有與宿主中蛋白質序列不同的序列在傳遞時將有更大的機會獲得免疫原性,這是未來疫苗的一個理想特征。其次,出于安全考慮,與宿主的蛋白質序列不同的序列應避免交叉反應。此外,由于微生物群最近被證實在動物抵抗ASF 上扮演一個有重大意義的角色,任何最佳的疫苗都應能夠誘導機體產生全身性免疫和黏膜免疫,能夠阻斷病原體,同時避免針對不受宿主微生物群歡迎的疫苗誘導反應。在對CD8+T 細胞抗原表位進行優先排序時,利用BLASTP 比對微生物群的蛋白質序列時使用了≤80%的閾值,這一事實與這些抗原表位固有的短長度(9-mers)有關,否則在更嚴格的閾值下會被去掉。必須強調的是,由于在物種水平上缺乏豬的微生物群的數據,BLASTP是針對報告存在于豬體內的每個微生物屬中所有微生物物種進行的,這可能包括未真正存在于豬體內的微生物物種。因此,我們決定將≤80%的閾值作為低分辨性和BLASTP 命中之間的良好權衡。
抗體在ASF 病毒免疫中具有重大的意義,因為從存活的豬上轉移的抗ASF 病毒免疫球蛋白G(IgG)可以防止感染。我們遵循三種不同的方法來選擇可能感興趣的B 細胞抗原表位:一種是傳統的實驗方法,在IEDB 中搜索保守和經實驗驗證的抗原表位,還有兩種重新預測的方法,一種是基于BepiPred-2.0 的序列方法,另一種是基于結構的方法,使用蛋白質數據庫(PDB)的三維結構,只適用于p72 的情況。
ASF 病毒是一種包膜病毒,包膜隱藏在脂質雙分子層之下(圖1)。迄今為止,已知嵌入脂質外膜的唯一蛋白是CD2 同源蛋白(E402R),我們根據序列方法預測了它的抗原表位。該蛋白是不同ASF 病毒中差異最大的蛋白之一,因此在不同ASF 病毒分離株之間發現一個保守的抗原表位是有意義的。雖然這是一種包膜病毒,但據報道,細胞外和細胞內的“裸體”顆粒都具有感染性。ASF 病毒感染可導致細胞裂解,而釋放的細胞內顆粒可能已經具有感染性。這些“裸”病毒的抗原表面主要由重要的衣殼蛋白p72 蛋白(B646L)的拷貝組成,它構成了外衣殼的大部分。此外,已經報道存在針對這種蛋白的中和抗體,證明了從p72 蛋白中優先選擇B 細胞抗原表位的理由。我們從IEDB 中搜索并找到了兩個保守的序列,此外還有2 個基于結構的方法預測的抗原表位和7個基于序列的方法預測的抗原表位。值得注意的是,從p72 三維結構分析中發現的兩個抗原表位(圖2) 都含有與基于序列方法預測的序列和IEDB 的實驗驗證序列相匹配的殘基,其中一個還在保守序列FPENSHNIQTAGKQD 中發現。除了p72 蛋白,我們預測的另一個蛋白是M1249L 蛋白,Wang 等將其確定為帽狀體骨架的一個重要部分,因此在“裸”病毒粒子的情況下可能被抗體鎖定。
其他選定的潛在B 細胞抗原表位來自于該外衣殼下面的蛋白質,嵌入到內脂層中。p54 蛋 白(E183L) 和p22 蛋 白(KP177R) 的 抗原表位都是通過IEDB 傳統實驗搜索(legacy experimentation search)和基于序列方法發現的,在p22 蛋白的特殊情況下,根據序列預測的抗原表位與經實驗驗證的抗原表位共享一半以上的序列。此外,我們在p17 蛋白(D117L)中預測了一個抗原表位,在p49 蛋白(B438L)中預測了五個抗原表位,后者有一個抗原表位與在IEDB 驗證的序列中發現的殘基相同。如上所述,所有這些蛋白都位于病毒粒子的內層,有關它們的抗體的保護作用可能并不明確。盡管如此,有研究報道了由針對內層粒子蛋白p22 蛋白、p54 蛋白和p30 蛋白(CP204L) 的抗體介導的中和作用,表明存在一種機制,這些蛋白通過這種機制可以與抗體相接觸。可以假設,病毒粒子層是動態結構,而不是靜態結構,因此,存在于其中的蛋白質可能容易被中和。此外,還預測了來自B169L 蛋白、C257L蛋白、B475L 蛋白、E146L 蛋白、反式異戊烯基轉移酶B318L 和MGF 110-9L 的抗原表位,但通過文獻無法證實它們在病毒顆粒中的位置。我們選擇這些蛋白質是為了鑒定可能暴露的病毒蛋白質。
綜上所述,必須強調的是,以前的疫苗接種研究已經確定這些抗原中的一些會加重疾病,可能通過抗體依賴性增強感染,就像p30 蛋白、p54 蛋白、p17 蛋白、p72 蛋白甚至CD2 同系物的情況那樣,在對它們進行實驗驗證時應格外謹慎。此外,預測方法的一個局限性是,用所遵循的方法我們無法預測B 細胞構象性抗原表位(conformational B-cell epitopes)。非蛋白質抗原表位如基于糖的抗原表位也沒有被檢索到。
以前用減毒活疫苗和DNA 疫苗進行的實驗表明,CD8+T 細胞在產生對ASF 病毒的免疫力上發揮了主要作用,但我們沒有發現任何經實驗驗證的CD8+T 細胞保守抗原表位。我們只能依靠計算方法來預測它們。最終選擇的6 個抗原表位經預測可以與預測工具中45 個豬淋巴細胞抗原(swine lymphocyte antigens,SLA)I類等位基因中的38個結合。與該種類的SLA 等位基因的結合將確保能夠覆蓋廣泛的種群。事實上,僅用抗原表位MAMQKLFTY 和KRHENIWML 就可以達到最大的覆蓋率。值得注意的是,所有選定的CD8+T 細胞潛在抗原表位都來自于病毒的復制和轉錄機制。假定的DNA 定向RNA 聚合酶亞單位5 同源物(D205R)、非特征蛋白D339L(在別處稱為RNA 聚合酶亞單位)、DNA 定向RNA 聚合酶亞單位β(EP1242L)、核糖核苷-二磷酸還原酶(F334L)、DNA 拓撲異構酶2(P1192R) 和非特征蛋白G1340L(在別處描述為可能的早期轉錄因子)。一系列的CD4+T 細胞抗原表位也被選中。初始T 輔助細胞(naive Th cells)通常由抗原呈遞細胞(antigen-presenting cells,APCs) 激活,而這些細胞恰好是ASF病毒的主要靶點(巨噬細胞、單核細胞和樹突狀細胞)。這種現象可能會妨礙APCs 呈遞抗原的能力,而這是形成有效的適應性免疫反應的關鍵步驟。CD4+T 細胞在平衡和維持細胞毒性和體液反應方面發揮著重要的作用,因此任何疫苗研究都應考慮這些細胞的作用。在本研究中,我們沒有發現任何經實驗驗證的CD4+T 細胞在IEDB 中的保守抗原表位,所以我們被迫對其進行預測。我們的新方法發現了14 個潛在的CD4+T 細胞抗原表位。值得注意的是,CD2 同系物和p72 蛋白,即B 細胞介導反應的驅動因子,各提供一個CD4+T 細胞的潛在抗原表位。必須指出的是,大多數免疫信息學工具都是根據人類免疫學背景下的數據設計和校準的,這可能會對ASF 病毒CD4+T 細胞抗原表位的預測產生影響。
最終,我們確定了6 個CD8+T 細胞抗原表位、14 個CD4+T 細胞抗原表位和29 個B細胞抗原表位的優先順序,這些抗原表位是獨特且保守的。考慮到迄今為止所介紹的所有ASF 病毒分離株之間的變異性,這一清單為根據ASF 病毒抗原表位設計疫苗提供了廣泛的可能性。下一步將包括通過預測方法對這些抗原表位進行實驗驗證,并全面評估它們的個體和/或群體誘發免疫反應的能力,以抵抗病毒攻擊。在闡明這一點后,它們很可能有助于設計一個安全且有效的基于抗原表位的非洲豬瘟疫苗組合。
3 結論
我們確定了49 個抗原表位,包括B 細胞和T 細胞(CD4+和CD8+) 的抗原表位,它們有可能被用作基于抗原表位的非洲豬瘟疫苗的一部分。它們在ASF 病毒中都是嚴格保守的,并且與野豬及其微生物群的蛋白質顯示出較低的一致性。然而,其中只有4 個抗原表位有實驗性證據表明它們被豬的免疫系統合理地處理、遞呈和識別。因此,本研究的下一步將對這些重新預測的抗原表位進行實驗驗證。如果可能的話,還應通過體外免疫學試驗對它們進行功能鑒定,包括免疫原性和保護性的替代物。只有到那時,才有可能構思出一種包括這些抗原表位的疫苗,并將其應用于體內試驗中。

