唯物辯證法原理在金屬性教學中的應用
陳聯梅,康泰然,李紅梅,漆文勝
成都大學食品與生物工程學院,成都 610000
唯物辯證法中最核心的法則是矛盾分析法。矛盾具有普遍性,存在于一切事物中,化學學科也不例外;矛盾具有特殊性,在處理問題時要堅持具體情況具體分析的原則,反對一刀切、片面化[1,2]。在分析解決矛盾的過程中,要辯證看待主要因素和次要因素的關系。大多數情況下,主要因素占據支配地位,次要因素處于從屬地位,因此往往抓住主要因素來討論即可;但是,事物是發展變化的,主要因素和次要因素是互相影響、互相制約的,在一定條件下亦互易其位,因此在少數情況下次要因素也會成為影響事物的關鍵因素。運用唯物辯證法的這些觀點和方法來剖析無機化學教學中遇到各種矛盾,不僅可以成功化解這些教學難點,還可培養學生辯證的思維方式和解決復雜問題的能力。
在元素周期表中,金屬元素約占4/5。從化學角度來講,金屬元素最突出的性質是容易失去電子,稱之為金屬性。金屬性是一個復雜知識點,是無機化學教學中的一個難點[3,4]。在無機化學教材中討論金屬性強弱時,采用的衡量標準有電極電勢(φ?)、電離能(I)、生成自由能(ΔfGm?)、生成焓(ΔfHm?)等。如果不厘清這些標準的本質及其適用范圍,學生就很容易混淆它們,產生一系列矛盾問題。例如,根據電離能推導出金屬性Li < Na < K,根據φ?推導出金屬性Li > K > Na,它們之間為什么不一致呢?在解釋金屬單質的性質時,應該采用哪個衡量標準?又如,根據φ?推導出金屬性K > Na;然而在800 °C時Na + KCl → NaCl + K,此反應似乎利用不活潑金屬Na制取了活潑金屬K。再如,根據φ?推導出金屬性Li > K > Na,但是它們與水反應時,Li單質不如Na、K單質反應劇烈。諸如此類的矛盾問題很多,讓學生們感到很困惑,甚至讓一些年輕教師也感到不解。本文中,我們將運用唯物辯證法原理中的一些觀點和方法來剖析金屬性這個復雜知識點,那么上述矛盾問題就會迎刃而解。
1 分析矛盾產生的根源
唯物辯證法原理告訴我們,首先要對矛盾進行客觀分析,揭示矛盾的內在規律性,然后才能找出解決矛盾的方法。在討論金屬元素的金屬性強弱時,學生為什么會得出上面這些矛盾結論?我們深入分析其原因,可以歸結為三個方面。第一,金屬元素的金屬性與其存在形式有關。金屬元素有兩種存在形式——氣態自由原子和聚集態單質。存在形式不同,影響失電子反應的因素不同,所表現出的金屬性不同。第二,金屬元素的金屬性與反應條件有關。當金屬元素都以單質形式存在時,反應條件不同,影響失電子反應的因素不同,所表現出的金屬性也不同。第三,熱力學衡量標準只表明金屬元素失電子趨勢,不決定實際的反應速率;反應速率屬于動力學范疇,還需要研究與動力學相關的一些實際影響因素。可見,影響金屬性的因素較多,不可能用一個標準去衡量金屬元素在不同情況下的金屬性,這就要求我們用辯證觀點來剖析金屬元素的金屬性,堅持具體情況具體分析原則。
2 根據反應實際情況采用相應的金屬性衡量標準
金屬性是一個復雜知識點。在討論金屬性強弱時,一定要堅持具體情況具體分析原則,根據失電子反應的實際情況采用相應的標準來衡量。金屬元素的存在形式不同(氣態自由原子和聚集態單質),要采用不同的衡量標準;即使存在形式相同,都以單質形式存在,反應條件不同,采用的衡量標準也不同。
2.1 金屬元素處于氣態自由原子時的金屬性衡量標準
當金屬元素處于氣態自由原子時,失去電子后生成氣態陽離子,這個過程中所吸收的能量為電離能(I)。因此,金屬元素處于氣態自由原子時,金屬性的衡量標準應采用電離能。電離能越小,金屬自由原子越容易失電子,其金屬性越強。以IA和IIA金屬元素為例,它們的第一電離能數據見表1[5]。

表1 IA和IIA金屬元素的第一電離能(I1) (M(g) → M+(g) + e-)
從表1可以看出,當金屬元素處于氣態自由原子時,IA元素的金屬性強弱順序Cs > Rb > K > Na >Li;IIA元素的金屬性強弱順序Ba > Sr > Ca > Mg > Be。
在元素周期律中討論同周期和同族的金屬性遞變規律時,衡量標準常采用第一電離能,因此推導出的結論只能表明這些元素均處于氣態自由原子時的失電子能力。然而,金屬元素絕大多數時候并不處于氣態自由原子狀態,而是以聚集態單質的形式存在,因此我們更需要找出金屬單質的金屬性衡量標準。
2.2 金屬元素處于單質形式時的金屬性衡量標準
金屬元素雖然都以單質形式存在,但反應條件不同,分別在干態下(即反應中沒有水溶液參與)和水溶液中進行失電子反應,影響反應的因素不同,那么采用的金屬性衡量標準也會不同。
2.2.1 金屬單質在干態下反應時的金屬性衡量標準
在干態下金屬單質與非金屬單質反應生成金屬化合物,因此金屬單質在干態下的失電子能力可用產物的ΔfGm?來衡量。由于ΔGm?= ΔHm?-TΔSm?,決定ΔGm?的因素有ΔHm?和ΔSm?。很多情況下,考慮ΔSm?影響較小和ΔfGm?數據不全,也常用產物的標準摩爾生成焓(ΔfHm?)來衡量。由于不同產物中所含的化學鍵數目不同,不能直接比較產物的ΔfHm?和ΔfGm?,應換算成ΔfHm?/化學鍵數目和ΔfGm?/化學鍵數目來衡量。
1) 金屬單質與O2反應時的金屬性衡量標準。
以IA、IIA金屬單質與O2反應為例,先查出產物(金屬氧化物)的ΔfHm?和ΔfGm?,再計算出ΔfHm?/化學鍵數目和ΔfGm?/化學鍵數目(見表2和表3)[5]。

表2 堿金屬氧化物的ΔfHm?/化學鍵數目和ΔfGm?/化學鍵數目
表3 堿土金屬氧化物的/化學鍵數目和/化學鍵數目

表3 堿土金屬氧化物的/化學鍵數目和/化學鍵數目
堿金屬氧化物 Δ f H m ? /2/(k J·m o l-1) Δ f G m ? /2/(k J·m o l-1)B e O -3 0 4.7 -2 9 0.0 M g O -3 0 0.8 -2 8 4.6 C a O -3 1 7.4 -3 0 1.6 S r O -2 9 6.0 -2 8 1.0 B a O -2 7 4.0 -2 6 0.2
從表2和表3中可得出以下結論:① 干態下堿金屬單質與O2反應時,金屬性順序為Li > Na > K >Cs > Rb;干態下堿土金屬單質與O2反應時,金屬性順序為Ca > Be > Mg > Sr > Ba,可見金屬單質在干態下反應時的金屬性和金屬自由原子的金屬性不一致;② 根據ΔfHm?和ΔfGm?得出的結論基本一致;唯物辯證法原理認為,事物的性質常常由主要因素決定,處理問題時往往抓住主要因素來討論,因此熱力學中常常采用ΔHm?代替ΔGm?處理問題。
2) 金屬單質與Cl2反應時的金屬性衡量標準。
以IA、IIA金屬單質與Cl2反應為例,先查找出產物(金屬氯化物)的ΔfHm?和ΔfGm?,再計算出ΔfHm?/化學鍵數目和ΔfGm?/化學鍵數目(見表4和表5)[5]。

表4 堿金屬氯化物的ΔfHm?/化學鍵數目和ΔfGm?/化學鍵數目
表5 堿土金屬氯化物的/化學鍵數目和/化學鍵數目

表5 堿土金屬氯化物的/化學鍵數目和/化學鍵數目
堿土金屬氯化物 Δ f H m ? /2(k J·m o l-1) Δ f G m ? /2/(k J·m o l-1)B e C l 2 -2 4 5.2 -2 2 2.8 M g C l 2 -3 2 0.6 -2 9 5.9 C a C l 2 -3 9 7.7 -3 7 4.4 S r C l 2 - -B a C l 2 -4 2 7.5 -4 0 3.4
從表4和表5可得出以下結論:① 干態下堿金屬單質與Cl2反應時,金屬性順序K > Rb > Na;干態下堿土金屬單質與Cl2反應時,金屬性順序Ba > Ca > Mg > Be;可見,金屬單質在干態下的金屬性與前面自由原子態的金屬性不一致。② 相同的金屬單質分別與O2、Cl2反應時,所表現出金屬性也不一致;例如,Na、K、Rb單質與O2反應時,金屬性Na > K > Rb;它們與Cl2反應時,金屬性K >Rb > Na。
我們可利用產物的玻恩-哈勃循環來進一步分析金屬單質在干態下的金屬性和其自由原子態的金屬性不一致的原因。從NaCl的玻恩-哈勃循環圖(圖1)看出[5],影響反應的因素較多,除了金屬原子的電離能之外,還有金屬單質的升華能、非金屬單質的解離能和非金屬氣態原子的電子親合能、產物的晶格能等,這些因素共同決定了金屬單質在干態下反應時的金屬性。查出這些影響因素的數據,可以計算出NaCl的ΔfHm?。

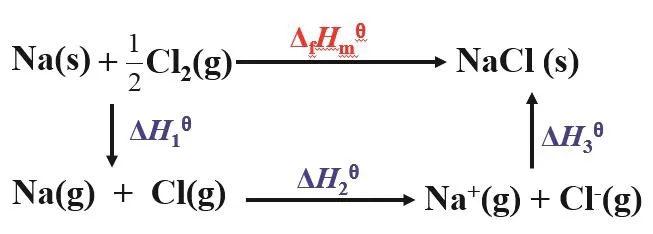
圖1 反應(Na + 1/2Cl2 → NaCl)的玻恩-哈勃循環圖
從圖1可知,金屬單質在干態下失電子過程比金屬自由原子失電子過程要更復雜,影響因素更多,因此不能用同一標準來衡量金屬單質和金屬自由原子的失電子能力。這充分體現了矛盾的特殊性,金屬元素的存在形式變了,影響失電子反應的因素就變了,金屬性衡量標準要隨之改變,這樣才能得到正確結論。
2.2.2 金屬單質在水溶液中的金屬性衡量標準
金屬單質在水溶液中失去電子之后生成水合金屬離子Mn+(aq),M與Mn+之間形成一個雙電層,這個雙電層的平衡電勢(φ)可用來衡量金屬單質在水溶液中的金屬性。為了使數據具有可比性,可選擇標準電極電勢(φ?)來衡量。若電對的φ?越小,表明金屬單質的金屬性越強;若電對的φ?越大,表明金屬單質的金屬性越弱。查找出金屬單質與其低價離子所形成電對的φ?,按照φ?從小到大順序排列(表6)[5],從而可以得到金屬單質在水溶液中的金屬性強弱順序。
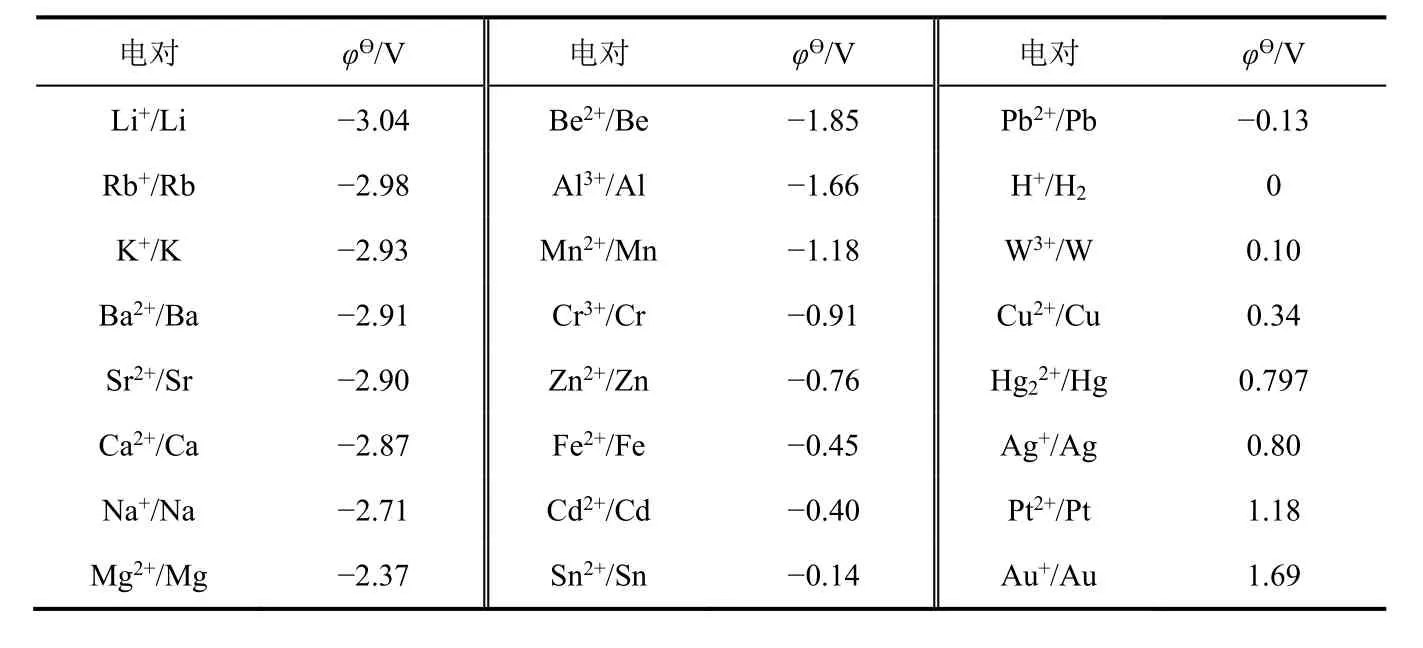
表6 Mn+/M的標準電極電勢(φ?)
從表6可得出以下結論:① 金屬單質在水溶液中金屬性強弱順序為Li > Rb > K > Ba > Sr > Ca >Na > Mg > Be > Al > Mn > Cr > Zn > Fe > Cd > Sn > Pb > H2> W > Cu > Hg > Ag > Pt > Au;與中學教材上的金屬活動順序表相比較,這是擴展版的金屬活動順序表;② 金屬單質在水溶液中的金屬性與干態下的金屬性不一致。
我們可利用電極反應的玻恩-哈勃循環來深入分析金屬單質在水溶液中與其干態下的金屬性不一致的原因。圖2是IA金屬單質的電極反應的玻恩-哈勃循環圖[6],從圖中可看出電極反應的影響因素較多,除了金屬原子的電離能之外,還有金屬單質的升華能、金屬離子的水合能。比較圖2和圖1可得出,金屬單質在水溶液中和其在干態下的失電子過程的影響因素不完全相同,因此不可能用同一標準來衡量金屬單質在這兩種不同反應條件下的失電子能力。這也再次體現了矛盾的特殊性,反應條件變了,影響因素也就變了,金屬性衡量標準要隨之改變。

圖2 IA金屬單質的電極反應(M(s) → M+(aq) + e-)的玻恩-哈勃循環圖
查出圖2中各影響因素的數據[6],計算出IA金屬單質的電極反應(M(s) → M+(aq) + e-)的ΔH?總,列在表7中。從表7可看出,IA單質在水溶液中反應時,金屬性強弱順序為Li > K > Rb > Na,可見在水溶液中Li單質的金屬性最強。究其原因,盡管Li的電離能和升華能最大,但Li+水合過程中放出的能量最大,導致其電極反應的ΔH?總小,因此Li單質在水溶液中反應時的金屬性最強。
仔細比較發現,根據表7中電極反應的ΔH?總推導出金屬性順序為Li > K > Rb > Na,而根據表6中電極反應的φ?推導出金屬性Li > Rb > K > Na,可見,利用ΔH?總和φ?推導出的金屬性順序不完全一致,這就需要進一步分析其原因。
表7 IA金屬單質的電極反應(M(s)→M+(aq) + e-)的
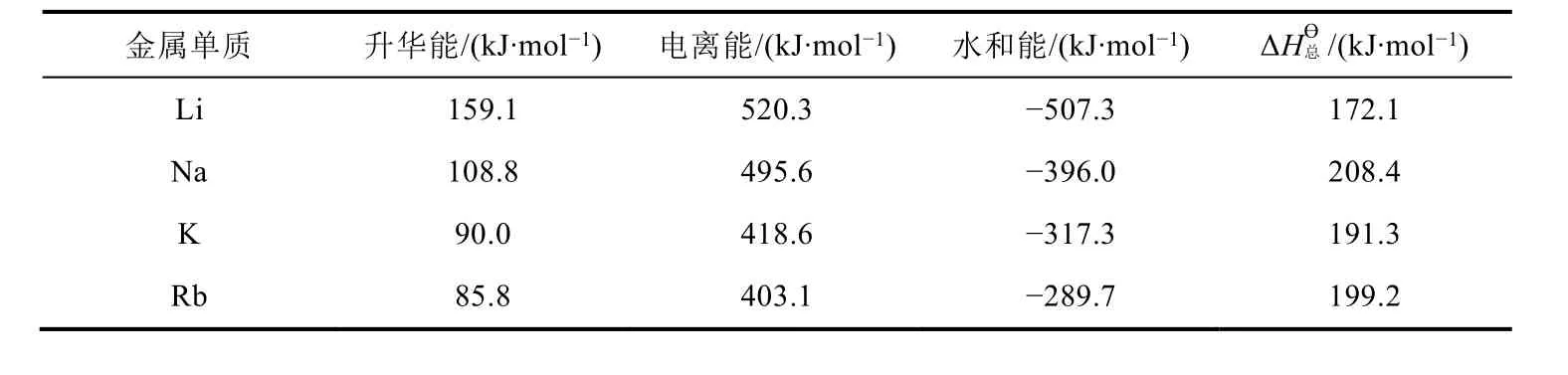
表7 IA金屬單質的電極反應(M(s)→M+(aq) + e-)的
金屬單質 升華能/(k J·m o l-1) 電離能/(k J·m o l-1) 水和能/(k J·m o l-1) Δ H總? /(k J·m o l-1)L i 1 5 9.1 5 2 0.3 -5 0 7.3 1 7 2.1 N a 1 0 8.8 4 9 5.6 -3 9 6.0 2 0 8.4 K 9 0.0 4 1 8.6 -3 1 7.3 1 9 1.3 R b 8 5.8 4 0 3.1 -2 8 9.7 1 9 9.2
對于氧化還原反應而言,ΔrGm?= -nFE?= -nF(φ+?-φ-?) = (-nFφ+?) - (-nFφ-?), 而ΔrGm?= ΔGm?(正極) - ΔGm?(負極),推導出電極反應的ΔGm?與φ?之間的計算式(ΔGm?= -nFφ?),因此φ?可以通過電極反應的ΔGm?計算而得。由于ΔGm?= ΔHm?-TΔSm?,絕大多數情況下ΔHm?是主要因素,ΔSm?是次要因素,因此利用ΔHm?和φ?來推導出的結論基本一致。唯物辯證法原理認為,事物是發展變化的,主要因素和次要因素是互相影響、互相制約的,在一定條件下亦互易其位。對于K和Rb而言,利用ΔHm?和φ?來推導出的結論相反,表明導致φ?(Rb+/Rb) <φ?(K+/K)的主要因素是ΔSm?,而ΔHm?成為次要因素。
根據前面的討論,就可找出850 °C時反應Na + KCl → NaCl + K能進行的原因。首先分析該反應的條件,此反應屬于金屬單質在干態下的反應,不能用水溶液中的金屬性衡量標準φ?來判斷,只能用ΔGm?來判斷。其次分析該反應進行的溫度是850 °C,顯然溫度是決定性因素。298 K時,ΔrHm?=ΔfHm?(NaCl) - ΔfHm?(KCl) = -411.2 - (-436.5) = 25.3 kJ·mol-1,屬于吸熱反應;298 K時反應物和產物都是固體,ΔSm?接近于0,因此ΔrGm?> 0,該反應298 K時不能進行。當溫度升高到850 °C時,Na處于液態(Na的沸點為883 °C),K處于氣態(K的沸點為759 °C),該反應ΔSm?>> 0;根據ΔrGm?= ΔHm?-TΔSm?,推導出850 °C時ΔrGm?< 0,從熱力學上角度判斷該反應能進行。
3 正確看待熱力學結論和反應速率的關系
金屬性的各個衡量標準(I,ΔfGm?、ΔfHm?和φ?)都屬于熱力學物理量,反應速率屬于動力學范疇。雖然熱力學和動力學之間存在一定聯系,但它們存在本質的不同,不能用熱力學結論去探討反應速率。熱力學結論只表明失電子的趨勢,不能決定反應快慢;反應速率需要研究與動力學相關的一些實際影響因素。當然,熱力學認為不可能的反應,就無需做動力學研究了。
例如,根據φ?(Li+/Li) <φ?(K+/K) <φ?(Na+/Na),從熱力學上推斷金屬單質在水溶液中的金屬性Li > K > Na,單質Li的金屬性最強。實際的反應現象,K與水反應劇烈,產生的H2能燃燒;Na與水反應劇烈,反應放出的熱使Na融化成小球。然而,Li與水反應比較平穩,不如K、Na劇烈,為什么?進一步研究發現,影響Li與水反應速率的因素有兩個,其一是Li單質的熔點較高,產生的熱量不足以使Li融化,固體Li與水的接觸面積不大,導致反應不劇烈;其二是反應產物LiOH溶解度小,它覆蓋在Li的表面,阻礙反應進行。當然,由于φ?(Li+/Li)很小,從熱力學角度表明Li單質的金屬性最強,這個性質有著重要用途。我們可用Li做電池的負極,制備出高比能量的鋰一次電池。已經商業化的Li/MnO2電池,其工作電壓2.9 V,遠高于Zn-MnO2電池工作電壓(1.5 V);Li/SOCl2、Li/CFx電池的比能量高,可用于心臟起搏器、深空探測飛行器、軍事武器等方面[7,8]。
4 結語
我們將唯物辯證法原理的一些觀點和方法應用于金屬性教學,成功化解了這個教學難點。影響金屬性的因素較多,這就要求我們用辯證觀點來剖析金屬性,反對片面化、一刀切。然后,堅持具體情況具體分析原則,根據金屬元素的存在形式和反應條件,采用不同的金屬性衡量標準。當金屬元素處于氣態自由原子時,采用電離能(I)作為金屬性的衡量標準。當金屬單質在干態下與非金屬單質反應時,采用產物的ΔfGm?和ΔfHm?作為金屬性的衡量標準。當金屬單質在水溶液中發生反應時,采用φ?作為金屬性的衡量標準。最后,還必須正確看待熱力學結論和反應速率之間的關系。熱力學物理量(I,ΔfHm?、ΔfGm?、φ?)只能表明金屬元素失電子趨勢,不決定反應快慢;若要解釋實際的反應速率,還需要結合動力學影響因素。若將唯物辯證法原理的觀點和方法廣泛應用于無機化學教學中遇到的各種矛盾問題,有助于厘清矛盾的本質,化解知識難點,提高教與學的效率,還可培養學生辯證的思維方式和解決復雜問題的能力。

