實驗教學與綠色化學的融合
——一個綠色Suzuki-Miyaura交叉偶聯反應教學實驗研究
王艷艷,高玲香,張偉強,顧泉,簡亞軍,高子偉
陜西師范大學化學化工學院,西安 710119
自第七十五屆聯合國大會中提出“碳達峰”“碳中和”以后,國家主席習近平于2021年4月22日發表題為《共同構建人與自然生命共同體》的重要講話,強調要堅持綠色發展,共同構建人與自然生命共同體。隨著人們對環境及安全生產認識的日益提高,綠色、可持續合成化學亟需發展。韓布興院士曾在中國化學會第32屆學術年會的學術報告中指出,綠色化學是21世紀的主題之一,已成為化學、化工及相關學科交叉滲透的研究領域,在解決經濟、資源、環境三者矛盾的過程中將發揮重要作用。在本科生實驗課程中融入綠色化學理念,將有助于深化學生的綠色化學認知,增強其綠色化學研發意識[1]。
鈀催化的Suzuki-Miyaura交叉偶聯反應(Suzuki-Miyaura cross-coupling,SMC)是現代有機合成中的一個重要反應,廣泛應用于藥物、天然產物、染料等化合物的合成,Akira Suzuki更因在該反應研究中的貢獻而獲得2010年度諾貝爾化學獎[2]。為將SMC反應引入大學課堂,關于SMC反應的實驗教學研究受到了人們的關注[3]。例如,熊就凱等人借助吡咯并吡咯二酮類熒光染料的合成實驗介紹了SMC反應[4],段新紅等人利用制備的Pd/β-環糊精催化劑設計了水中催化SMC反應的實驗[5],J. W. J.Ang利用制備的含氟鈀催化劑設計了在水相中可循環催化SMC反應的實驗[6],M. F. Koudehi等人通過設計一鍋SMC反應與分步反應的對照實驗向學生展示了省去催化劑預制備步驟的優勢[7]。近年來,SMC反應的相關實驗開始出現在《有機化學實驗》的教材中[8-10],但將其引入本科實驗課堂尚存在很大困難。這主要是因為該實驗成本高、附加污染大[11],具體表現在:貴金屬鈀的用量大且難以回收,有機溶劑和昂貴有機配體的使用增加成本且加劇了環境壓力,產物分離困難,實驗所需的時長較長。
最近,我們發展了一種綠色純水相含鈀體系,其催化劑無需特制且用量低,不僅能夠高效催化SMC反應,而且其反應和產物分離的操作簡便——利用大學無機化學中的常規實驗操作即可[12]。更重要的是,該純水相含鈀體系能夠多次循環應用于SMC反應,實驗成本低。該體系中催化的C-C交叉偶聯能夠于空氣氣氛中、45 °C下,反應1 h即可完成,從實驗設計、實驗試劑、反應裝置、實驗時長等方面考慮,符合本科實驗教學。從危險性方面考慮,利用該體系進行的SMC反應是一個理想的綠色化學實施案例,適合作為本科生的教學實驗。基于此,本文旨在介紹一項可作為綜合實驗引入高年級本科課程的“綠色Suzuki-Miyaura交叉偶聯反應的實驗”教學研究,以期向本科生介紹Suzuki-Miyaura交叉偶聯反應,并在實驗中培養和增強學生的綠色化學理念。
1 實驗目的
(1) 掌握Suzuki交叉偶聯反應的綠色有機合成新方法;
(2) 進一步學習有機化合物的薄層色譜分析和核磁譜圖的分析;
(3) 通過對反應路線和催化劑活性進行評價,強化對綠色化學的理解;
(4) 增強對諾貝爾化學獎的認識,培養創新能力、增強創新意識。
2 實驗原理
傳統Suzuki反應原理如圖1a所示,L是有機配體,用來穩定活潑的零價或二價鈀,并調節其催化活性。溶解在試劑中的鈀的金屬有機配合物是催化劑前體,該前體經活化后變成活性物種LnPd0。首先,鹵代芳烴與活性物種(LnPd0)絡合,發生氧化加成,進而與芳基硼酸反應,經轉金屬過程生成鈀偶聯芳基配合物,最后經還原消除生成偶聯產物,而鈀催化劑重新轉化成LnPd0,并再次催化反應進行。這里,催化物種LnPd0雖然活性高,但不穩定:該物種容易脫除L配體形成更活潑的零價鈀原子,導致鈀的團聚并形成催化活性很低的鈀納米顆粒,造成催化物種的失活。因此,如何在保證催化劑高活性的同時增強其穩定性一直是貴金屬催化領域研究的熱點課題。本文介紹的實驗中并未用到有機配體,其催化劑前體是Pd(NH3)4Cl2,初步研究認為其活性催化物種是亞納米的零價鈀,如圖1b所示。正如傳統的鈀催化一樣,催化劑活性、穩定性難以兼顧是一個問題。這里,我們的初步研究認為,體系中的季銨堿起到了穩定游離的二價鈀物種的作用,并抑制了二價鈀向零價鈀的轉化,使體系中的二價鈀和零價鈀達到某種平衡,實現了鈀的高穩定性和活性。首先,二價鈀在底物作用下被還原,形成亞納米的活性鈀簇,并參與催化循環;其次,亞納米鈀在堿的作用下,回到穩定且高分散的二價鈀狀態,避免了鈀的團聚失活。然而,如何平衡二價鈀和零價鈀在體系中的比例,真實的活性鈀物種究竟是什么狀態,這些問題尚模糊不清,其機理還需進一步深入研究。
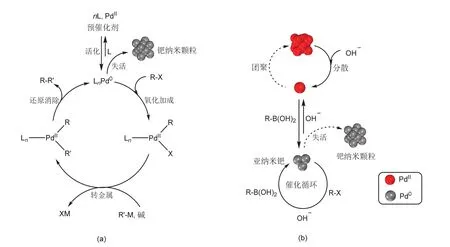
圖1 鈀催化Suzuki-Miyaura交叉偶聯反應機理和其催化物種變化的可能機制
本實驗以溴苯和4-甲氧基苯硼酸為原料,于含少量乳化劑的堿性水溶液體系中,在鈀催化作用下進行Suzuki偶聯反應,并以96%-99%的收率得到4-甲氧基聯苯。反應I如圖2a所示,其中:[Pd]充當催化劑的作用,催化劑前體為商業上可買到的四氨合氯化鈀一水合物;四丙基氫氧化銨(TPAOH)充當堿的作用,用于提供堿性環境;H2O用作溶劑;Triton X-100作為乳化劑,用于促進有機反應物在水中的分散;反應溫度為45 °C,反應時長為1 h。為了驗證催化劑及體系的可再利用,將反應I中的催化劑進行回收后,重新用于催化4-溴苯甲醚和苯硼酸間的Suzuki-Miyaura交叉偶聯反應,同樣得到4-甲氧基聯苯(圖2b,反應II)。

圖2 鈀催化SMC反應路線
該反應在空氣氛圍下進行,反應條件溫和(45 °C),所需鈀催化劑用量極少且易得、穩定、可循環。與現有方法相比,該反應具有體系綠色、反應條件溫和、產率高和易于操作等優點。由于反應中鈀的用量很少,本實驗所需的鈀催化劑可由實驗教師預先將其溶于水配制成一定濃度的含鈀水溶液。
3 試劑與儀器
3.1 試劑
溴苯(阿拉丁,99%),4-甲氧基苯硼酸(阿拉丁,97%),4-溴苯甲醚(阿拉丁,99%),苯硼酸(阿拉丁,97%),曲拉通(Triton X-100,阿拉丁,生化試劑級),四丙基氫氧化銨25% (w)水溶液(25% (w)TPAOH,伊諾凱),蒸餾水,四氨合氯化鈀水溶液(由教師提前將四氨合氯化鈀一水合物(Pd(NH3)4Cl2·H2O,阿拉丁)溶于水配制成Pd含量為6 × 10-4mol·L-1的水溶液)。
3.2 儀器
顯微熔點測定儀、薄層色譜板、電子天平、恒溫加熱磁力攪拌器、減壓水泵、燒杯、40 mL反應小瓶、全玻璃微孔濾膜過濾器、移液槍。日本電子株式會社(JNM-ECZ400S/L1) 400 MHz核磁共振波譜儀,CDCl3為溶劑,TMS為內標。
4 實驗過程
4.1 溴苯和4-甲氧基苯硼酸的交叉偶聯反應(反應I)
向40 mL反應瓶內加入0.172 g 4-甲氧基苯硼酸、0.106 mL溴苯、1.63 mL四丙基氫氧化銨25% (w)水溶液、0.1 mL曲拉通、7 mL水、2 mL二氯化四氨合鈀水溶液配制成反應液;將反應瓶置于45 °C水浴中攪拌1 h (TLC跟蹤反應進程),完成反應。最后,將反應瓶置于冰浴中充分結晶約30 min,析出白色4-甲氧基聯苯固體(圖3a)。
用全玻璃微孔濾膜過濾器過濾反應液。將濾液和濾餅分別做如下處理:(1) 收集濾液(包含H2O、TPAOH、Pd催化劑、Triton X-100)到干凈的40 mL反應小瓶中(圖3c),以備循環使用;在激光照射下觀察到丁達爾現象,說明濾液中含有納米微粒或微乳。(2) 將濾餅用蒸餾水淋洗多次后,轉移到稱量紙上,于室溫下自然干燥8 h,獲得純的白色4-甲氧基聯苯固體(圖3b),稱量,計算產率。
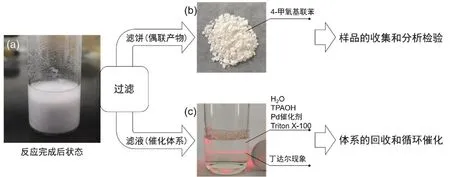
圖3 產物的分離、提純和催化循環流程圖
4.2 回收體系用于催化4-溴苯甲醚和苯硼酸的交叉偶聯反應(反應II)
首先,將步驟4.1中收集的濾液置于40 mL反應瓶中,加入0.138 g苯硼酸和0.126 mL 4-溴苯甲醚(1.0 mmol),并補加0.815 mL四丙基氫氧化銨25% (w)水溶液。之后,與步驟4.1類似,將該反應瓶置于45 °C水浴中攪拌,反應1 h (TLC跟蹤反應進程),完成反應。最后,將反應瓶置于冰浴中充分結晶約30 min,析出白色4-甲氧基聯苯固體。
按照步驟4.1對反應液進行過濾分離:將分離出的濾液集中回收;將濾餅用蒸餾水淋洗多次后,置于室溫下干燥8 h,獲得純的白色4-甲氧基聯苯固體,稱量,計算產率。
4.3 產品的檢驗和結構分析
取少量產物溶于石油醚后,以V石油醚: V二氯甲烷= 1 : 1為展開劑進行TLC分析,對照反應I和反應II產物的比移值(Rf),并初步檢驗產物的純度。
催化過程中,對反應液進行TLC分析。如圖4所示,其中A為對反應前的反應液的分析結果,B為對反應后的反應液的分析結果,P為對產物的分析結果。Rf值:溴苯為0.82;4-溴苯甲醚為0.60;苯硼酸和4-甲氧基苯硼酸為0;4-甲氧基聯苯為0.47。如圖4a所示,反應I進行1 h后,溴苯完全轉化;如圖4b所示,反應II進行1 h后,4-溴苯甲醚完全轉化。反應I和反應II均生成4-甲氧基聯苯。結果表明,不管是新鮮催化劑作用于溴苯和4-甲氧基苯硼酸的反應,還是回收體系作用于催化4-溴苯甲醚和苯硼酸的反應,均實現了反應的高效催化轉化,均獲得了4-甲氧基聯苯,且沒有硼酸自偶聯產物生成。
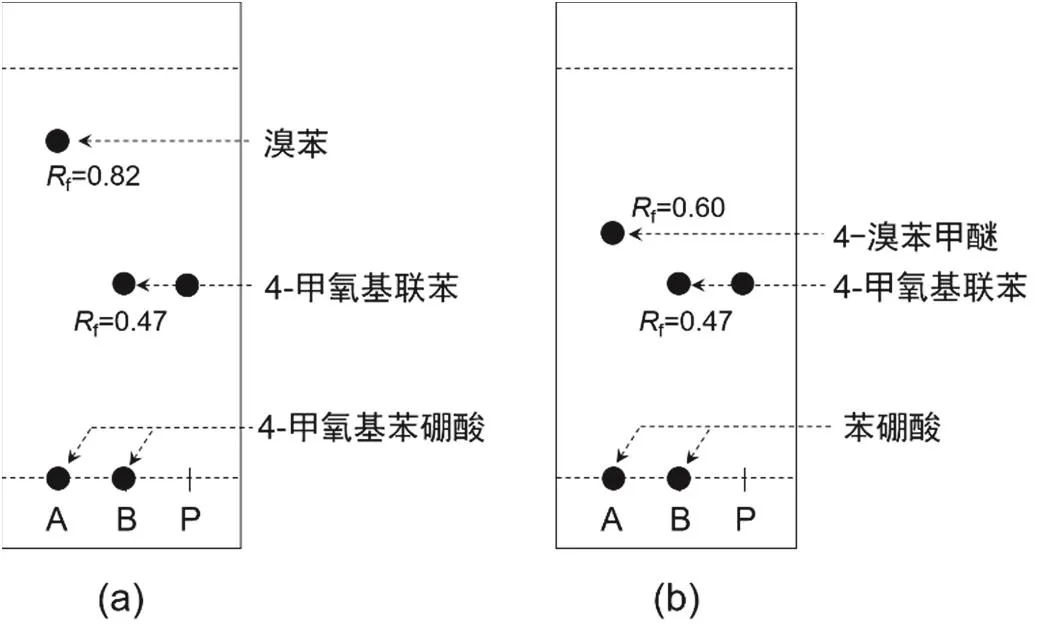
圖4 反應進行1 h后,反應I (a)和反應II (b)分別與其產物的薄層色譜對照
利用核磁共振氫譜(1H NMR)對經簡單水洗和過濾后獲得的產物——4-甲氧基聯苯進行分析表征(圖5)。具體結果如下:
白色固體,產量184 mg (產率> 99%)。1H NMR (400 MHz, CDCl3): δ 7.60-7.54 (m, 4H), 7.44 (t,J = 7.8 Hz, 2H), 7.33 (t, J = 7.3 Hz, 1H), 7.01 (d, J = 8.5 Hz, 2H), 3.87 (s, 3H)。
由1H NMR數據,可以確定其結構為4-甲氧基聯苯。圖5中δ 1.56附近的峰對應水的峰,可能是樣品在空氣中吸水所致。此外,整個1H核磁上沒有其他雜峰,說明該產物是純品。
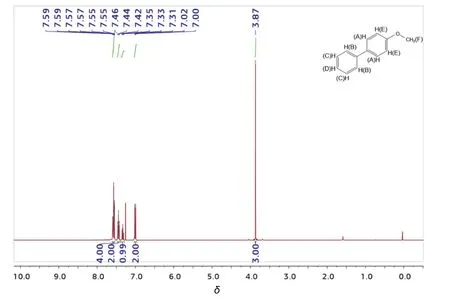
圖5 產物4-甲氧基聯苯的1H NMR圖
5 結果與討論
關于催化反應的一堂實驗課需要四個課時,參與實驗的學生人數為5-6人,學生單人進行或兩人一組分組進行。該實驗已經在大學生創新實驗課上開設了兩年。每次實驗課上,學生完成反應I和反應II,并獲得產物;待下次實驗課上稱量產物,計算產率。
5.1 貴金屬催化劑的利用率
如表1 (序號1-3)所示,三組學生使用新鮮的含鈀催化水體系催化溴苯和4-甲氧基苯硼酸的SMC反應,均得到了目標產物,產物的分離產率為96%-99%。說明該催化實驗的可重復性高。
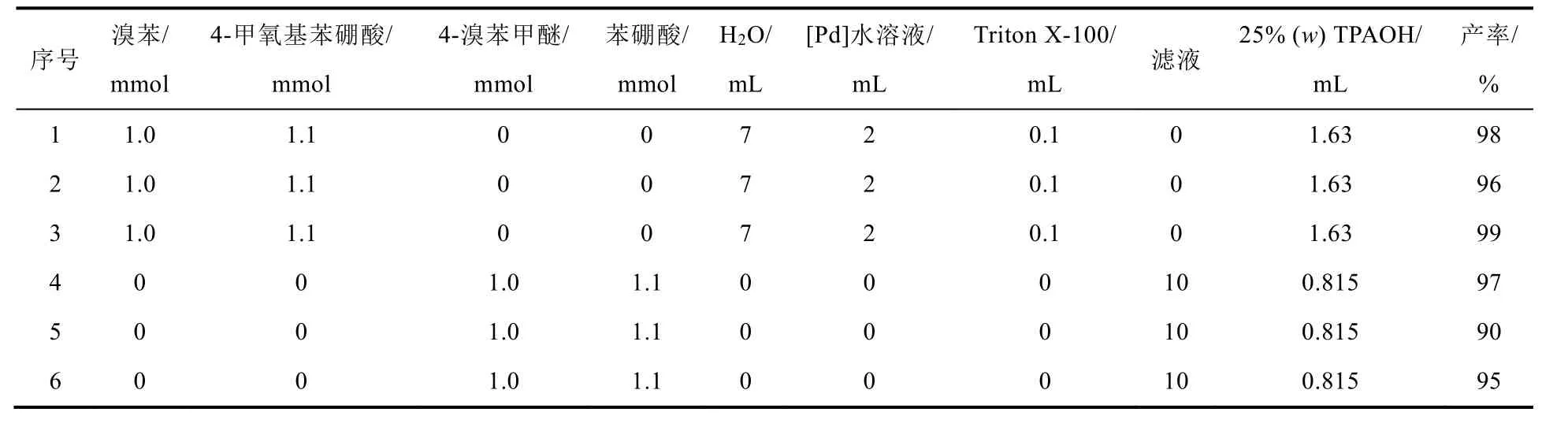
表1 第一次催化及循環催化結果對照
由加入的催化劑量和產率,通過指導學生計算催化劑的轉化數和轉化頻率評估催化劑的活性。從反應物及催化劑組成方面分析:對于1 mmol的反應物,[Pd]的用量為1.2 × 10-3mmol。這說明很少量的鈀即可催化該反應。
根據轉化數(TON)的定義得:TON = 生成的產物的物質的量/催化劑的物質的量。這里,反應物為1 mmol,產物為0.98 mmol (以產率為98%為例做計算),[Pd]催化劑用量為1.2 × 10-3mmol,則:
TON = (0.98 mmol)/(1.2 × 10-3mmol) = 816
因此,分離產率為98%時,該體系中催化劑的TON值為816。
根據轉化頻率(TOF)的定義得:TOF = (生成的產物的物質的量/催化劑的物質的量)/反應時長;這里,反應時長為1 h,則:
TOF = [(0.98 mmol)/(1.2 × 10-3mmol)]/1 h = 816 h-1
因此,分離產率為98%時,該體系中催化劑的TOF為816 h-1。
通過對多個學生的多次實驗結果進行匯總,其第一次催化獲得的產率范圍為85%-100%,對應的TON值范圍為708-833,TOF值范圍為708-833 h-1。
高的TON值和TOF值,說明該體系具有很高的催化效率。
5.2 催化循環情況考察
如表1 (序號4-6)所示,學生將相應的4-溴苯甲醚、苯硼酸和TPAOH投入回收的濾液中,同樣獲得了產率為90%-97%的4-甲氧基聯苯。該結果表明,回收的催化劑也能夠高效催化SMC反應。而且4-溴苯甲醚和苯硼酸的交叉偶聯產物與溴苯和4-甲氧基苯硼酸的交叉偶聯產物一致。通過對多個學生的多次實驗結果進行匯總,我們發現循環催化實驗的產率范圍為80%-97%,對應的TON值范圍為666-808,TOF值范圍為666-808 h-1。
為了考察催化劑的循環次數對產率的影響,我們針對鈀催化4-甲氧基苯硼酸和溴苯的交叉偶聯反應做了多次循環實驗,其產率如圖6所示。研究顯示,前兩次循環中產率均為95%以上,而第三次的產率明顯下降到約40%,且反應液出現較明顯的油水分離現象;到第四次循環時,我們向其中額外補加了少量乳化劑(Triton X-100, 0.03 mL),產率重新回歸到90%以上;之后每次都額外補加0.03 mL的Triton X-100,其產率隨著循環次數增加緩慢下降;到第八次循環時,我們將額外補加Triton X-100的量增加到0.06 mL,其產率略有上升。因此,我們推斷是因為我們一開始加入的乳化劑的量非常少(相對于約10 mL的水相反應液,其加入的乳化劑量僅為0.1 mL),而每次反應完成后,產品的過濾分離過程造成了部分乳化劑的損失,導致后面循環過程中的乳化劑的量不夠,以致油水分離并破壞了催化體系,使產率下降。因此,為了使該體系能夠多次循環應用,建議在每次循環時額外補加適量Triton X-100。
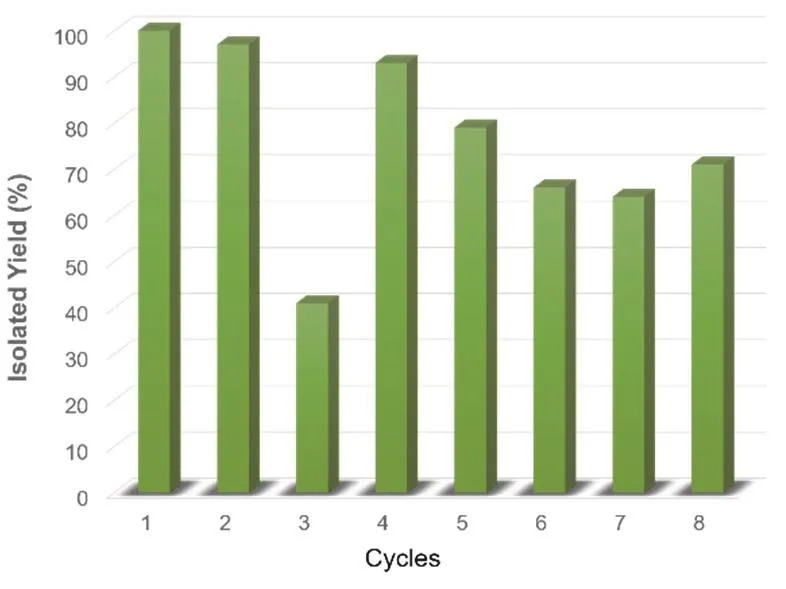
圖6 鈀催化4-甲氧基苯硼酸和溴苯的交叉偶聯反應的多次循環實驗結果
5.3 環境因子(E因子)和環境商值(environmental quotient,EQ)的計算
實驗完成后,指導學生通過計算反應中的E因子和EQ因子[13],衡量產品在生產過程中對環境造成的影響。
E因子是每生產1 kg目標產物的同時所產生的廢物的質量,主要考察產品生產全過程中產生的廢物量,其計算公式如下:
E= 廢物質量/產品質量
即:
E= [m(Pd(NH3)4Cl2·H2O) +m(Triton X-100) +m(TPAOH) +m(TPAB副產物)]/m(4-甲氧基聯苯)
考慮到Pd物種、堿、Triton X-100、TPAOH及其副產物TBAB均可以在循環過程中重復使用,該反應幾乎沒有產生廢物。隨著循環催化次數的增加,其E值逐漸減小。假設這些物種無限循環應用,則E值將趨近于零,從而實現零排放的理想狀態。
環境商值EQ =E×Q。Q值的大小通常以“致命劑量50”(LD50)為參考,表示廢棄物對環境的不友好程度。EQ值的大小則綜合考慮了廢物的排放量和廢物的環境行為本質兩種因素,能夠綜合衡量一個產品工藝的好壞。對于該催化反應,由于E值趨近于零,則EQ也趨近于零。因此,該催化體系具有突出的環境友好性,表現出明顯的節能減排和可持續發展優勢。
5.4 合成化學綠色化思考
對于化學反應,綠色化學的原則主要表現為:防止或減少廢物的產生、使用溫和的溶劑和試劑、增加反應的催化活性、簡化反應的流程以及避免產品分離中所衍生的附加污染[14]。
該實驗便于從幾個方面引導學生對綠色化學的設計展開思考:(1) 使用水溶劑代替有機溶劑,增加反應的安全性和綠色環保性;(2) 使催化劑及添加物變得可回收,實現催化劑的充分利用和反應的零排放;(3) 改進分離、純化方法,避免常規柱層析法中有機洗脫劑和硅膠的使用,減少附加污染;(4) 使反應條件溫和高效(45 °C,1 h),降低反應成本和能耗。
6 思考題
(1) Suzuki-Miyaura反應是哪兩類有機底物之間的交叉偶聯反應?舉例說明。
(2) 綠色溶劑的標準是什么?
(3) TON值反映的是催化劑的什么特性?為什么TON值越高越好?
(4) TOF值反映的是催化劑的什么特性?為什么TOF值越高越好?
(5) TON和TOF的聯系與區別是什么?
7 結語
本文介紹了一個利用可循環的水相含鈀體系催化Suzuki-Miyaura交叉偶聯反應的實驗。該實驗有助于加深學生對課堂所講授的綠色化學概念的理解,促進其綠色化學理念的建立。綠色Suzuki-Miyaura交叉偶聯反應應用到本科教學中,不僅使學生能夠理解金屬有機化學的知識,而且能夠培養學生的綠色環保意識、創新能力和創新意識,對化學實驗教學是一種有益的探索。

