EDTA滴定法測藥物制劑中的ZnO:定量分析在實踐中的應用
趙宏偉,槐佳孟,王澤,陳霞
山西大學化學化工學院,太原 030006
配位滴定法是一種非常重要的定量分析方法,其滴定分析是以配位反應為基礎的分析方法[1]。在大學的分析化學實驗課程中,EDTA (乙二胺四乙酸)常用作配位滴定法中的滴定試劑,能夠與大多數金屬離子形成穩定的1 : 1配位化合物[2]。在生活中常用EDTA作為滴定試劑進行離子檢測,例如自來水硬度的測定、鋁合金中鋁含量的測定、胃舒平藥片中Al(OH)3和MgO含量的測定等。
為保持學生在實踐課上的積極性,突出滴定法在日常生活中的應用,本文介紹了用經典EDTA滴定法測定痱子粉和皮膚軟膏中氧化鋅的方法,并將其作為我校分析化學實驗課程中配位滴定設計實驗之一。
氧化鋅(ZnO)是一種白色粉末狀的無機物,是必要礦物質鋅的來源。具有防腐、干燥、抗炎、除臭、紫外線防護等特性,是醫藥產品配料中常見的化學添加劑。然而,若人接觸鋅的濃度高于生理需要,是有一定毒性的[3]。因此,對藥物制劑中的鋅含量進行定量分析是非常必要的。在本實驗中,我們提出了一種通過經典EDTA滴定法測定兩種藥物制劑(痱子粉和皮膚軟膏)中氧化鋅含量的方法。
經典的滴定法由于其具有操作簡單、成本低、準確性高等特點,在分析高濃度分析物(例如藥物活性成分)的樣品時,仍被廣泛應用。Zn(II)離子的滴定方法有兩種,酸性溶液時使用二甲酚橙指示劑,堿性溶液時使用鉻黑T指示劑(EBT)[4,5]。本實驗分別采用上述兩種指示劑法測定了不同藥品中的ZnO的含量,具體分析方法如圖1所示:首先用稀鹽酸分別提取粉劑和膏劑藥品樣品中的氧化鋅,其中,1) 軟膏法提取的氧化鋅,在pH = 10的緩沖溶液中,以EBT為指示劑,用EDTA標準滴定;2) 粉末法提取的氧化鋅,將溶液的pH調至5-6,以二甲酚橙為指示劑,用EDTA標準溶液滴定。最后學生計算樣品中ZnO的含量及相對標準偏差,將結果與產品標簽信息進行比較,計算相對誤差。
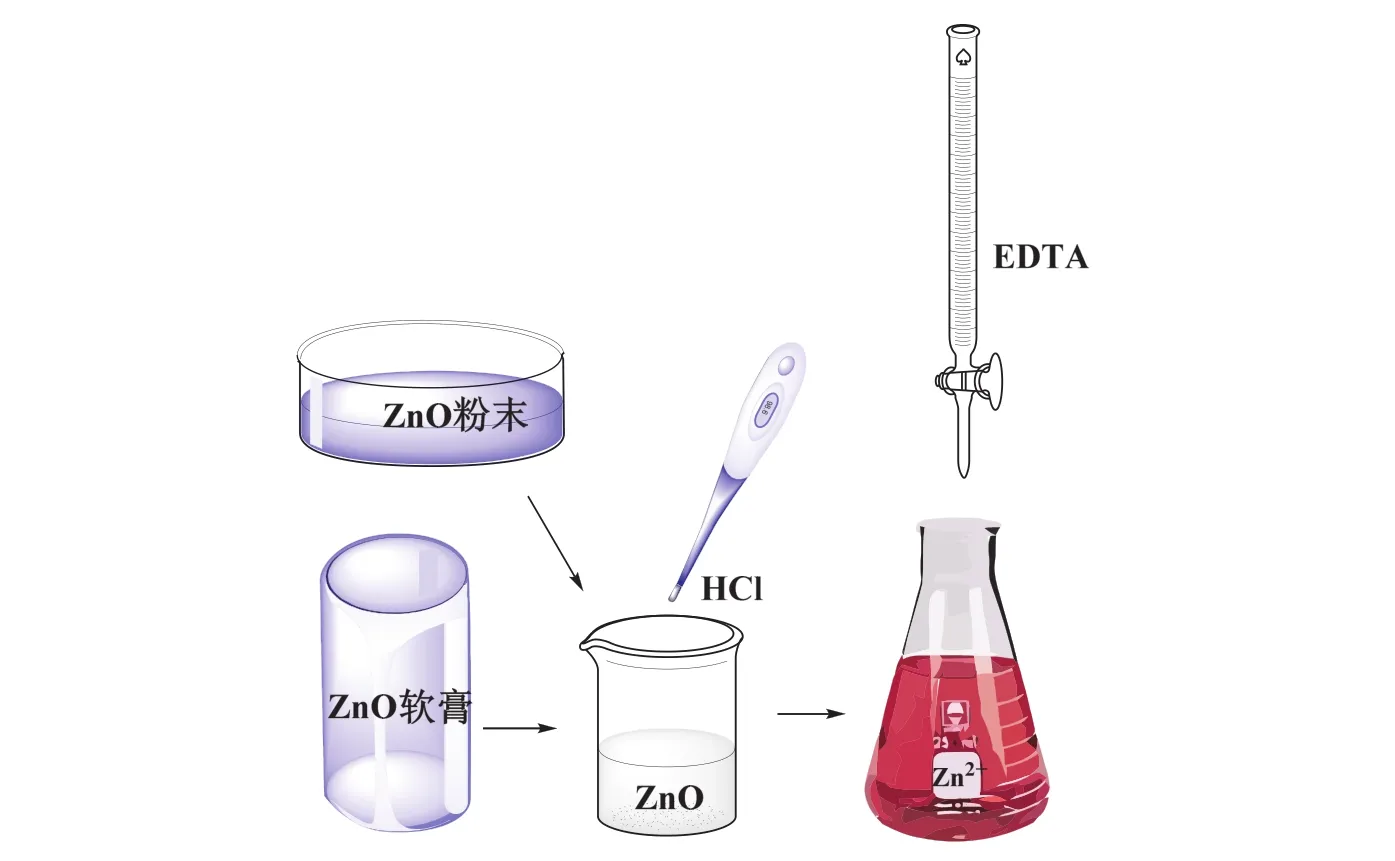
圖1 本文實驗操作流程圖
1 實驗目的
(1) 學會復雜樣品的處理方法和待測試液的制備方法。
(2) 掌握用配位滴定法測定ZnO的原理和應用。
(3) 了解利用滴定法測定藥品中金屬離子含量的實際意義。
2 實驗重點難點
(1) 實驗重點:掌握配位滴定法的實驗原理和操作。
(2) 實驗難點:待測樣品的分析和樣品的預處理。
3 樣品處理
ZnO是一種兩性氧化物,可以與酸和強堿發生反應。與酸反應見反應式(1):

粉末痱子粉樣品提取Zn(II)離子。將樣品溶解在酸性介質中,經過濾除去懸浮物,得到從樣品中提取的Zn(II)的澄清溶液。
皮膚軟膏樣品提取Zn(II)離子。將樣品溶解在鹽酸和乙酸乙酯中,軟膏中的有機成分溶解在乙酸乙酯中,氧化鋅溶解在鹽酸中[6]。利用分液漏斗將有機相和水相進行分離,得到從樣品中提取的Zn(II)的澄清溶液。
4 實驗原理
配位滴定法是基于金屬離子和配位離子之間的定量反應。EDTA是配位滴定中常用的滴定試劑,可以與金屬離子形成穩定的1 : 1配位化合物。標定EDTA時,一般選擇鉻黑T或二甲酚橙做指示劑,不同指示劑適應的條件有所不同。選用鉻黑T作為指示劑時,應在pH = 10的緩沖溶液中進行,選用二甲酚橙做指示劑,需將溶液pH調至5-6。
皮膚軟膏提取液中只有Zn(II)離子,可選擇上述兩個指示劑任意之一的測定條件進行滴定。粉末狀的痱子粉中含有滑石粉,制備的待測溶液中主要成分為Zn(II)離子,但其中含有Mg(II)離子。Mg2+、Zn2+均能與EDTA形成穩定的配合物,可以利用EDTA的酸效應進行分步滴定,防止Mg2+的干擾。當酸度不同時,鋅鎂離子的配位也不同[7]。在pH = 5-6時,EDTA只和Zn2+配位,而Mg2+不被滴定;只有當pH = 10的堿性條件下Mg2+可被滴定。
在滴定終點,消耗的EDTA的摩爾數等于溶液中所含的金屬離子的摩爾數。樣品中ZnO質量的計算式為:

式中:CEDTA是EDTA標準溶液的濃度,單位為mol·L-1;VEDTA是滴定終點消耗的EDTA平均體積,單位為mL;MZnO為ZnO的分子量(81.38 g·mol-1),ms是每份待測試樣的樣品質量,單位為g。
5 實驗注意事項
(1) 用酸處理樣品時要充分攪拌,盡量多地溶解待測離子。
(2) 用乙酸乙酯萃取時注意正確操作。
(3) 樣品處理時應在通風櫥下進行。
6 實驗部分
6.1 主要試劑和儀器
酸式滴定管,錐形瓶(250 mL),容量瓶(250.0 mL),移液管(10.00 mL,25.00 mL),FA/JA1004型電子天平,稱量瓶;EDTA (0.01 mol·L-1左右,待標定),HCl (1 : 1),ZnO (固體,AR),鉻黑T指示劑,二甲酚橙指示劑,六亞甲基四胺溶液(200 g·L-1),氨水(1 : 1),pH = 10的氨水-氯化銨緩沖溶液。
待測樣品:
1) 氧化鋅痱子粉(當地藥店獲得,健民集團葉開泰國藥(隨州)有限公司)。
2) 氧化鋅軟膏(當地藥店獲得,天津金耀藥業有限公司)。
6.2 實驗過程
6.2.1 Zn2+標準溶液的配制及EDTA溶液的標定
(1) 配制Zn2+標準溶液和EDTA溶液。
a) 0.01 mol·L-1Zn2+標準溶液配制。
準確稱取0.2-0.25 g ZnO于50 mL燒杯中,加少量去離子水潤濕后,緩慢滴加6 mol·L-1HCl水溶液,攪拌至其完全溶解。然后將溶液定量轉移至250.0 mL容量瓶中,加蒸餾水稀釋至刻度,搖勻,計算Zn2+標準溶液的濃度。計算公式如下:

Zn2+標準溶液濃度的計算,按照上述操作步驟,將準確稱取的mZnO= 0.2072 g代入公式(3)中,求得CZn2+= 0.01020 mol·L-1。
b) 0.01 mol·L-1EDTA溶液配制。
稱取3.5-4.0 g乙二胺四乙酸二鈉鹽于200 mL燒杯中,用蒸餾水溶解,所得溶液倒入聚乙烯塑料瓶中,再加蒸餾水稀釋至1000 mL左右,搖勻。
(2) 標定EDTA溶液。
用移液管移取25.00 mL Zn2+標準溶液于錐形瓶中,逐滴加入1 : 1的氨水,同時不斷搖動直至開始出現白色渾濁(Zn(OH)2固體),以中和溶液中過量的HCl,注意過量的氨水能與Zn2+絡合,渾濁消失變為澄清。然后加50 mL蒸餾水、10 mL NH3-NH4Cl緩沖溶液和2-3滴鉻黑T指示劑,用待標定的EDTA溶液滴至溶液由紫紅色剛好變為藍綠色,記下消耗的EDTA溶液的體積。如此再重復滴定3次,取平均值后計算EDTA溶液的準確濃度。實驗數據記錄在表1中。
數據處理:EDTA溶液滴定25.00 mL 0.01020 mol·L-1Zn2+標準溶液的體積分別記錄于表1中,EDTA與金屬離子形成穩定的1 : 1配位化合物,由定量關系可知EDTA溶液濃度CEDTA按下式計算:


表1 Zn2+標準溶液標定EDTA溶液
根據表1數據計算出EDTA標準溶液的濃度為:CEDTA= 0.01040 mol·L-1。
6.2.2 樣品中氧化鋅的提取及待測溶液的制備
1) 從痱子粉樣品中提取ZnO。
準確稱取37.5020 g痱子粉于250 mL燒杯中,加入10 mL 6 mol·L-1HCl水溶液和40 mL蒸餾水。混合物用玻璃棒攪拌10 min,靜置分層,上層為乳白色懸浮物,下層為無色透明液體,其中懸浮物通過布氏漏斗減壓過濾并用蒸餾水洗滌3次,所得濾液定量轉移至250.0 mL容量瓶中,加蒸餾水稀釋至刻度,搖勻,得到Zn(II)離子待測溶液。
2) 從皮膚軟膏樣品中提取ZnO。
準確稱取1.2509 g的皮膚軟膏于250 mL的燒杯中,通風櫥內加10 mL 6 mol·L-1HCl水溶液、40 mL蒸餾水和50 mL乙酸乙酯[8]。向混合液中加入磁子,在通風廚中用磁力攪拌器將混合物攪拌30 min。將得到的混合溶液轉移至分液漏斗中,靜置分層,下層水相收集至250.0 mL容量瓶中,上層有機懸浮用20 mL飽和食鹽水洗滌三次,水相合并收集至容量瓶中,加蒸餾水稀釋至刻度線處,搖勻,得到Zn(II)離子待測溶液(圖2)。

圖2 分液漏斗進行分液
6.2.3 氧化鋅含量的測定
痱子粉樣品。用移液管移取25.00 mL Zn2+待測試液3份于250 mL錐形瓶中,分別滴加2滴2 g·L-1二甲酚橙指示劑,滴加200 g·L-1六亞甲基四胺溶液至溶液呈現穩定的紫紅色,再加5 mL六亞甲基四胺溶液,然后用EDTA標準溶液滴定至溶液由紫紅色剛好變為黃色,如圖3A所示,記下消耗EDTA溶液的體積。平行滴定3份,取平均值,利用上述公式(2)計算氧化鋅含量。實驗數據記錄在表2中,與標簽含量對比結果記錄在表3中。

圖3 (A) 痱子粉樣品Zn2+溶液滴定前紫紅色和滴定終點黃色;(B) 皮膚軟膏樣品Zn2+溶液滴定前紫紅色和滴定終點藍綠色
皮膚軟膏樣品。用移液管移取25.00 mL Zn2+待測試液3份置于250 mL錐形瓶中,分別滴加1 : 1 NH3·H2O,同時不斷搖動直至開始出現白色渾濁(Zn(OH)2固體),注意過量的氨水能與Zn2+絡合,渾濁消失變為澄清。分別加10 mL NH3-NH4Cl緩沖溶液、50 mL蒸餾水和2-3滴鉻黑T指示劑,然后用EDTA標準溶液滴至由紫紅色剛好變為藍綠色,如圖3B所示,記下消耗EDTA溶液的體積。平行滴定3份,取平均值,利用上述公式(2)計算氧化鋅含量。實驗數據記錄在表2中,與標簽含量對比結果記錄在表3中。
數據處理:EDTA溶液滴定痱子粉和軟膏兩種25.00 mL Zn2+待測試液的體積分別記錄于表2中,氧化鋅在兩種藥品中的含量根據測定數據計算,并記錄于表2中,計算方法根據公式(2)。
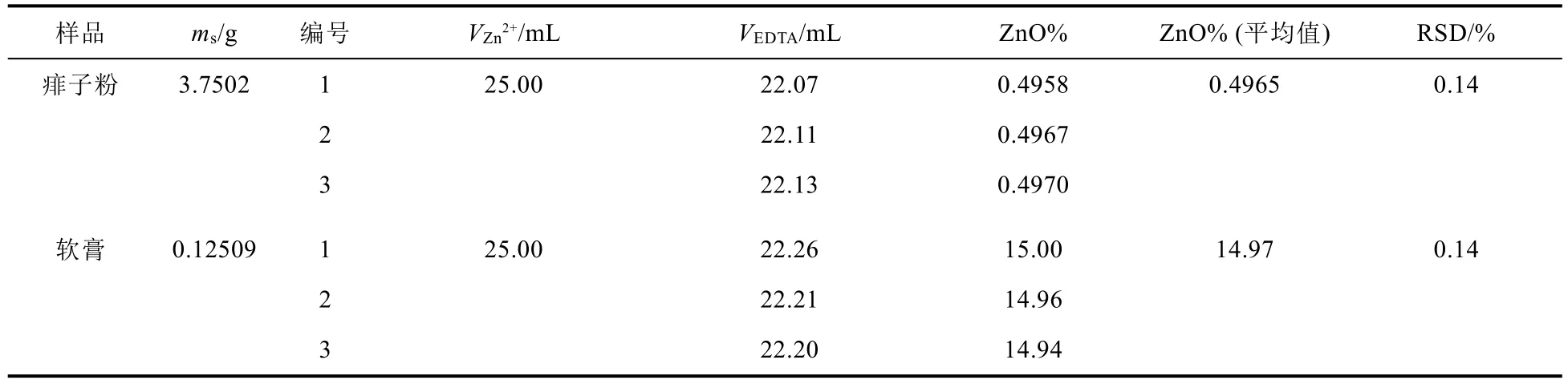
表2 ZnO氧化鋅的質量含量的測定
從表2中數據可以看出,痱子粉樣品中氧化鋅含量為0.4965%,皮膚軟膏樣品中氧化鋅含量為14.88%。因復雜樣品可接受的相對標準偏差RSD數值不得高于5%,而兩種方法獲得的所有RSD值均低于1%,表明該方法具有較高的準確度[9]。
6.2.4 氧化鋅含量的分析
為便于比較,將測得的氧化鋅的含量換算成與產品標簽中相同的單位表示,數據列于表3中。

表3 氧化鋅測得值與標簽值比較
本文中提到的方法準確性和精確性,通過表2和表3的RSD和Er數據得到很好的驗證。從表3中的數據可以看出,實驗中測得1 g痱子粉樣品含有4.9653 mg氧化鋅,1 g軟膏樣品含有149.7 mg氧化鋅。測定值與標簽值相比,結果顯示:痱子粉樣品與產品標簽信息的相對誤差為-0.69%,軟膏樣品的相對誤差-0.20%,二者的相對誤差均小于1%[9],測定結果也令人滿意。根據以上結果,兩種樣品的滴定方法都得到了有效驗證。
6.2.5 實驗方法驗證
已知EDTA滴定Zn(II)離子時可以在兩種不同的條件下進行,即pH為5-6、二甲酚橙做指示劑或者pH = 10的緩沖溶液、鉻黑T作為指示劑。
文中實驗(見4.2.3小節)采用的實驗步驟是:1) 痱子粉樣品在pH為5-6、二甲酚橙做指示劑、0.01040 mol·L-1EDTA溶液滴定;2) 軟膏樣品在pH = 10的緩沖溶液、鉻黑T作為指示劑、0.01040 mol·L-1EDTA溶液滴定。
除了以上實驗操作還做了以下條件實驗:1) 將軟膏樣品試樣在pH為5-6、二甲酚橙做指示劑、0.01040 mol·L-1EDTA溶液滴定,與4.2.2小節中的實驗數據進行對比,結果基本一致,說明該試樣在兩種滴定方法中都適用;2) 將痱子粉樣品試樣在pH = 10的緩沖溶液、鉻黑T作為指示劑、0.01040 mol·L-1EDTA溶液滴定,利用上述公式(2)計算氧化鋅含量,測得三次結果的ZnO%平均值為0.9913%,即9.9 mg·g-1,其數值遠遠超過標簽含量5.0 mg·g-1的數值,根據實驗數據證實在堿性條件下,痱子粉中由于Mg2+存在會影響Zn2+的滴定。因此,該樣品的滴定應在酸性條件下進行。事實上,在進行滴定分析時,當屏蔽掉鎂離子的干擾時,實驗結果和標簽數據一致,因此,我們認為痱子粉樣品中除了鎂離子和鋅離子外,不含其他金屬離子,在酸度pH = 5-6時,滴定的是痱子粉樣品中鋅離子,而不存在其他離子干擾。
6.2.6 線性度曲線
用EDTA滴定法分析5、10、20、25、30 mL的Zn(II)待測溶液的等分試樣,并將每個等分試樣中ZnO的含量與預期含量作圖。線性擬合的r2值都在0.99以上,這表明兩種方法在這個工作范圍內是線性的。其中藍色表示預測氧化鋅含量,紅色表示實驗氧化鋅含量(圖4)。
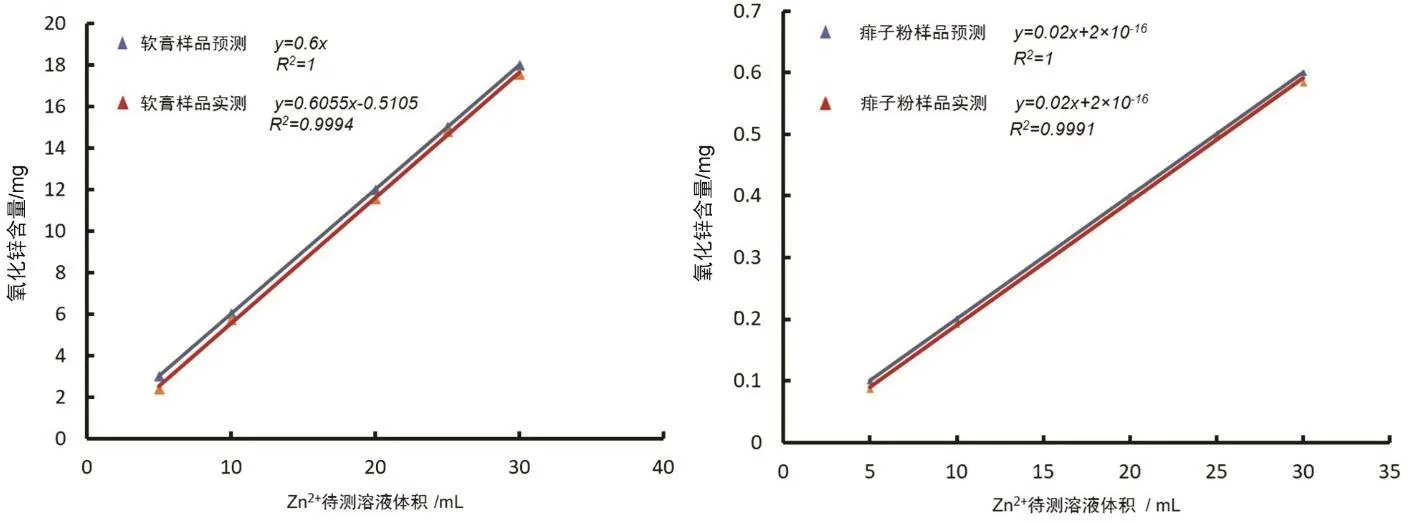
圖4 實測的樣品中ZnO的質量與預測的樣品中ZnO的含量關系
痱子粉和軟膏樣品的測定系數(R2)分別為0.9991和0.9994。這高于線性方法的最低接受值0.99,因此可以認為該方法在分析的范圍內是有線性關系的。
7 實驗在教學中的應用
在具體教學中,先讓學生查閱資料,擬定實驗方案,在此基礎上,本實驗的實施過程需要學時數為4學時。具體實施如下:1) 首先進行實驗原理的講解,用時0.5小時。包括氧化鋅在制藥工業中的重要性、HCl提取氧化鋅原理、使用緩沖劑的原因,以及演示預先準備好轉折點的顏色變化,最后講解ZnO含量的計算。2) 操作環節及測定過程用時2.5小時。包括:樣品稱重、提取及待測溶液的配制,EDTA溶液的標定,組分含量的測定等等,所有學生都做了三個平行滴定,所需緩沖液和指示劑溶液由實驗代課老師預先制備。3) 結果處理用時1小時。實驗結束后整理數據、計算ZnO平均含量、計算RSD、相對誤差上交實驗報告。
山西大學化學化工學院分析化學實驗課的學生在定量分析課程中應用了本實驗。本文提供了10名同學粉末痱子粉樣品數據及5名學生的軟膏樣品數據。學生進行實驗操作并進行數據分析。將學生數據中氧化鋅含量對比進行匯總,列于表4和表5中。
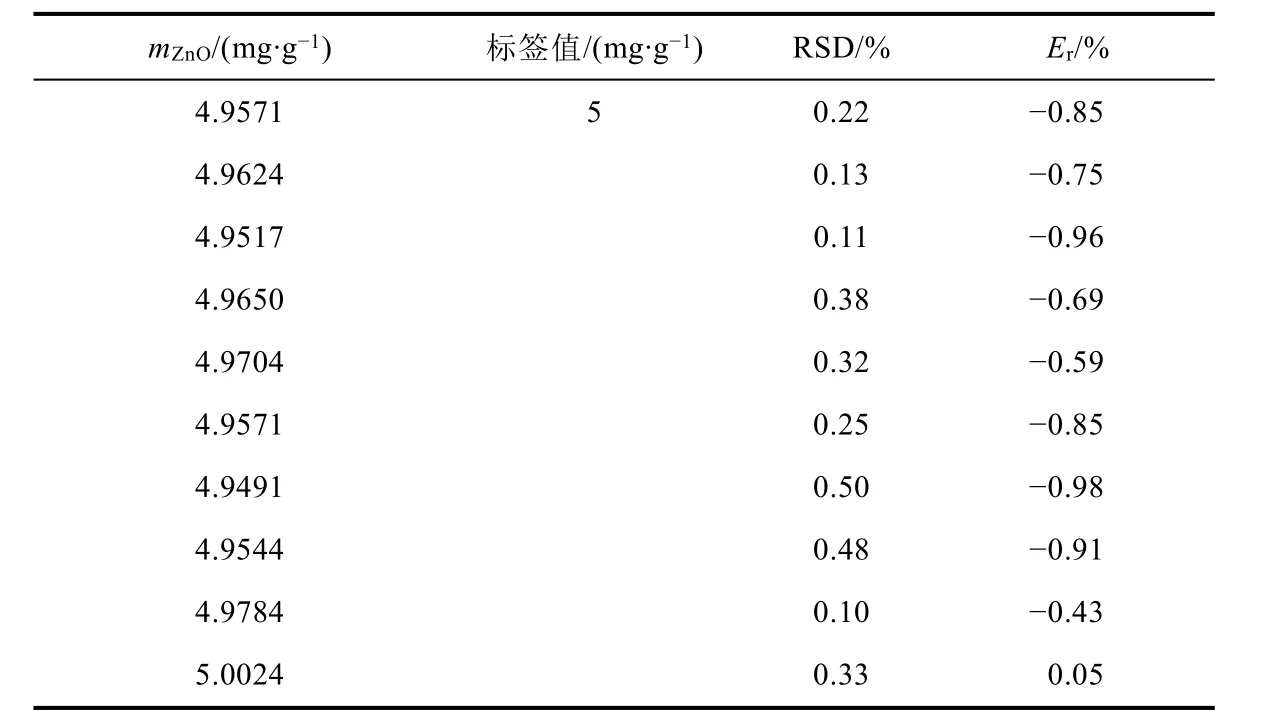
表4 學生使用痱子粉樣品獲得的氧化鋅含量的比較
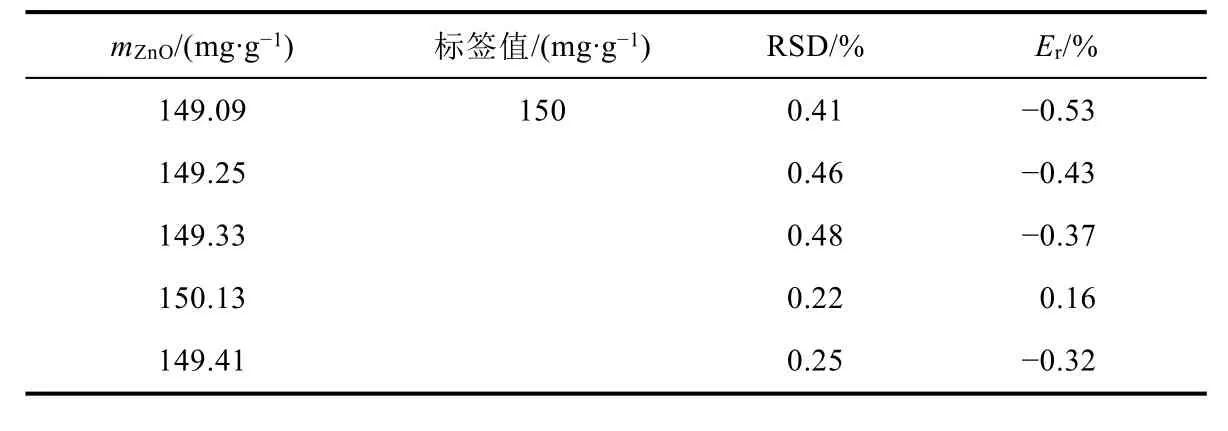
表5 學生使用軟膏樣品獲得的氧化鋅含量的比較
學生們對痱子粉和皮膚軟膏的分析結果分別顯示在表4和表5中。每個結果都代表了每個學生三次單獨測定的平均值。結果顯示:粉末法測定值的RSD值范圍從0.10%到0.50%,軟膏法從0.22%到0.41%。學生測定值與標簽數據的相對誤差(Er/%)分別為:痱子粉為-0.98% - 0.05%,皮膚軟膏為-0.53% - 0.16%。在滑石粉的分析中,10項分析的相對誤差全部低于±1%,在軟膏的分析中,5項分析的相對誤差全部低于±1%。比較二者的相對誤差,發現痱子粉樣品相對誤差比較大,可能是因為痱子粉樣品粉末較細,對離子吸附較強,學生過濾樣品時洗滌不夠充分,痱子粉中氧化鋅含量較少,導致誤差相對較大。總之,獲得數據誤差的原因可能是學生缺乏經驗導致樣品污染、技術儀器錯誤、乙酸乙酯提取過程中樣品丟失,以及超過了滴定的終點。
8 結語
文中提及的配位滴定法內容,在定量分析課程教學中是十分重要的。本實驗從痱子粉和軟膏兩種不同狀態的藥物樣品中提取待測成分,應用過濾、萃取和滴定等技術進行分析測定,不僅提高了學生的學習興趣,而且還鍛煉了他們解決問題的能力,同時也豐富了教學內容。實際樣品的分析不同于定量分析中教材上的經典實驗,增加了樣品預處理環節,為了得到待測試液,須除去干擾雜質而采取萃取和過濾等步驟,將分析化學和有機化學的基本實驗技術聯系起來,既彌補了理論教學中往往缺乏實際樣品分析內容,又鍛煉了學生的動手能力。另外整個實驗過程中學生學會了如何評價一種實驗方法是否準確,以及如何從統計學角度比較實驗測定值和預期值的關系。
該實驗已成功地應用于我校化學專業學生的定量分析實驗課程中。通過總結分析化學實驗課程中學生的反饋,使用真實的樣品對吸引學生學習興趣和提高學生的實驗技術具有重要作用。為提高學生在實際教學中的積極性,增強和發展學生的實驗技術,建議在實際教學中多分析日常使用的樣品。

