硫:古老元素的新征程
——第54屆國際化學奧林匹克試題第4題解析
李姝,邱曉航,王穎霞,程方益
1南開大學材料科學與工程學院,天津 300350
2南開大學化學學院,天津 300071
3北京大學化學與分子工程學院,北京 100871
便攜式二次電池已經對我們的生活產生了深遠的影響。然而,由于化石能源引發的環境污染和能源危機等問題,對儲能技術提出更高的要求。鋰硫電池是以金屬鋰為負極,單質硫為正極活性物質的一種儲能設備。得益于其多電子轉移特性,單質硫S8作為正極材料,其理論比容量高達1675 mAh·g-1。同時,硫在地殼中儲量豐富,具有明顯的成本優勢。因此,鋰硫電池被認為是未來儲能領域中最具應用前景的一類設備[1-3]。
鋰硫電池通過反應S8+ 16Li → 8Li2S來實現化學能與電能間的相互轉化。在放電過程中,硫并非被直接還原為Li2S,而是經歷了一個極為復雜的多步反應過程,涉及S8分子的開環、各種多硫化物的生成,以及難溶化合物Li2S2和Li2S的轉化等。放電過程中產生的多硫化物可溶解在電池電解液中,并隨電解液擴散到負極。在負極表面,多硫化物與金屬鋰直接發生氧化還原反應,造成電池的自放電現象,導致電極活性物質的損失和電池容量的衰減。這種現象被稱為“穿梭效應”,該效應是鋰硫電池商品化過程中最為嚴重的一個技術難題[4]。
1 出題依據
探究電解液中多硫化物的存在形式,對于有效抑制“穿梭效應”,設計硫宿主材料和電池隔膜具有重要的意義。Li2S6被認為是鋰硫電池高電壓平臺中最具代表性的放電中間產物,而1,2-二甲氧基乙烷(DME)對多硫化物具有良好的穩定性,是鋰硫電池研究中常用的醚類電解液。南開大學言天英教授課題組和高學平教授課題組通過從頭算方法和UV-Vis光譜研究了Li2S6在DME中的存在狀態[5]。研究表明,Li2S6在DME中主要是以分子的形式存在,而以及的濃度非常少,這為設計有合適孔徑及結構的電池隔膜提供了理論指導。
此外,鋰硫電池的工作電壓會隨電解液的不同發生變化[6]。由于硫在正極的反應為準固相反應,其電極電勢受電解液的影響較小,而金屬鋰的電極電勢與電解液的選取密切相關。南開大學言天英教授課題組和高學平教授課題組使用從頭算方法研究了Li+/Li電對在不同有機溶劑中的標準電極電勢[7]。通過調節溶劑降低金屬鋰的電極電勢,提升了鋰硫電池的工作電壓,從而提高電池的能量密度。
第54屆國際化學奧林匹克試題第4題[8],從工業生產單質硫開始,首先引導學生了解通過返滴定碘量法對生產條件進行監測,然后引出單質硫在鋰硫電池中的應用,以上述兩項研究為依據,將硫的前沿應用和化學基礎相結合,設計考題。通過電極反應方程式的書寫及活性物質質量比的計算,使學生了解鋰硫電池的基本化學原理;通過對理想鋰硫電池工作時長的計算,向學生展示了鋰硫電池迷人的應用前景。針對鋰硫電池中的關鍵技術難題——“穿梭效應”,通過書寫多硫化物與金屬鋰的反應方程式,讓學生了解“穿梭效應”的本質,認識具有氧化性的多硫化物與具有還原性的金屬鋰在電極處直接發生氧化還原反應對電池性能的影響。進一步,根據上述研究的數據,讓學生們計算并確定Li2S6在DME中的主要存在形式,通過設計合理的熱力學循環求取Li+/Li電對在有機溶劑中的標準電極電勢。最后,考查學生根據多硫化物在二甲基亞砜(DMSO)中的濃度比,應用物料及電荷守恒反推初始投料質量的能力。
2 題目及解析
2.1 題目
硫自遠古時代就被人們所知曉并使用。如今,硫作為一種廉價的化工原料仍被廣泛用于化工和醫藥生產。
黃鐵礦(FeS2)是工業生產單質硫的一種常用原料。在控制空氣通量的條件下加熱黃鐵礦,單質硫的理論產量可達100%,同時生成黑色磁性氧化物(Fe3O4)。
4-1 (2分) 寫出上述轉化的反應方程式并配平。
在實際生產過程中,除單質硫外,還會有少量SO2副產物產生。通過測量SO2的量,可對生產條件進行監測[9]。具體方案如下:將粉碎后的礦石粉末放入管式控溫爐中加熱,產生的SO2用2 mol·L-1NaOH溶液吸收。反應結束后,將吸收液轉移至500 mL容量瓶中,并用蒸餾水稀釋至刻度。準確移取25.00 mL定容后的溶液至碘量瓶中,加入50.00 mL 0.05122 mol·L-1I2標準溶液和5 mL 20% H2SO4溶液。在暗處放置5 min,用0.1012 mol·L-1Na2S2O3標準溶液滴定。當瓶中溶液為淺棕色時,加入3 mL 0.5%淀粉指示劑,然后繼續滴定至藍色消失。
4-2 (4分) 寫出上述過程中涉及I2的反應方程式并配平。
4-3 (4分) 若該測試實驗所用反應物為黃鐵礦,反應后收集到17.6 g單質硫。采用上述過程分析氣體副產物,消耗Na2S2O3標準溶液18.47 mL。請計算黃鐵礦中硫元素的損失率(假設沒有其他含硫物質生成)。
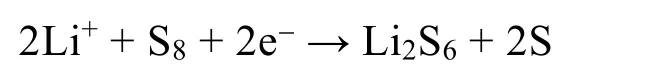
鋰硫電池是一類引人注目的儲能設備,其理論能量密度高于傳統的鋰離子電池。鋰硫電池的總反應方程式為:16Li + S8→ 8Li2S。在充電過程中,單質硫為正極活性物質,金屬鋰為負極活性物質。
4-4 (3分) 寫出充電過程中正極(a)和負極(b)發生的電極反應方程式并配平。
4-5 (1分) 根據電池總反應,計算正、負極活性物質的質量比。
一個工作電壓為3.8 V,可用容量為3110 mAh的鋰離子電池在充滿電后,可供手機不間斷播放視頻22小時。
4-6 (5分) 若該鋰離子電池被平均工作電壓為4.2 V的理想鋰硫電池組替代。假設鋰硫電池組放電過程完全按電池總反應的化學計量比進行,有23 g正極活性物質硫參與反應。那么,鋰硫電池組在充滿電后,可為手機不間斷播放視頻幾小時?
單質硫常以S8分子的形式存在。在鋰硫電池的實際放電過程中,S8分子并非直接被還原成Li2S,而是經過多步反應,生成多種多硫化鋰(Li2Sn,n = 3-8)。這些多硫化鋰會擴散到負極,并腐蝕負極,造成電極活性物質的損失,這一現象被稱為“穿梭效應”。
4-7 (2分) 寫出可溶性多硫化鋰腐蝕負極生成Li2S的反應方程式并配平。
為了抑制“穿梭效應”,關于多硫化物在電解液中存在形式的研究備受關注。Li2S6就是其中一種最具代表性的中間產物:
研究顯示,在鋰硫電池的常用電解液1,2-二甲氧基乙烷(DME)中,存在兩種能量相近的異構體,Li2S6(I)和Li2S6(II)。Li2S6在DME中的解離如圖4.1所示,所涉反應的Gibbs自由能變見表4.1。

表4.1 298.15 K,1 bar時,DME中不同解離反應的吉布斯自由能(kJ·mol-1)

圖4.1 Li2S6、、和在DME中的解離平衡

4-9 (5分) 計算DME (298.15 K,1 bar)中反應的表觀平衡常數。
4-11 (6分) 298.15 K,1 bar時,金屬鋰在水中的標準電極電勢為:E?(Li+/Li) = -3.040 V。利用表4.2的數據,請計算金屬鋰電極在DME中的標準電極電勢。

表4.2 氣體Li+(g)溶解在不同溶劑中生成Li+(sol)的標準吉布斯自由能變
研究表明,用二甲亞砜(DMSO)代替DME可以提高鋰硫電池的電動勢。因此,DMSO中多硫化物的形態也引起了研究者的關注。
在一項實驗中,將一定量的Li2S和4.81 mg的硫粉加入10.00 mL DMSO中,加熱攪拌至完全溶解(忽略體積的變化)。假設DMSO中只存在以下多硫化物:,且它們的平衡濃度之比為:
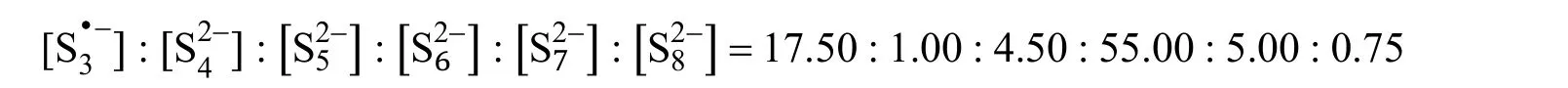
4-12 (5分) 請計算Li2S的初始投料質量m(單位:mg)。
2.2 答案與解析
4-1 介紹了一種由黃鐵礦制備單質硫的方法。由題干可知,黃鐵礦中所有的硫元素都轉化為單質硫,鐵元素轉化為Fe3O4,故答案為:

4-2 引導學生如何通過返滴定碘量法對反應條件進行監測,考查碘量法的基本原理。碘量法應在近中性介質中進行。若堿性太強,I2會歧化:3I2+ 6OH-→ IO-3+ 5I-+ 3H2O,而酸性太強,Na2S2O3易發生分解:+ 2H+→ SO2↑+ S + H2O。故在書寫方程式時,不應該寫成HSO-3或H2SO3的形式。答案為:
4-3 I2總的物質的量:0.05122 mol·L-1× 50.00 mL = 2.561 mmol
由4-2的反應方程式可知,被Na2S2O3滴定的I2的物質的量:

與SO2反應的I2的物質的量等于SO2的物質的量。因此,在制備單質硫的過程中,產生的SO2的質量:(2.561 - 0.9346) × 10-3× 20 × 32.06 = 1.043 g。需要注意的是,SO2的吸收液被定容至500.00 mL。在定量分析時,只移取了25.00 mL進行滴定,故計算時需乘以20。

4-4 介紹了鋰硫電池的基本化學原理。在電池放電過程中,負極發生氧化反應,正極發生還原反應。單質硫在正極得到電子后,會與電解液中的Li+生成不溶的Li2S,而非以S2-的形式存在,因此正極的最終產物不能寫成S2-。
(a) 正極:S8+ 16Li++ 16e-→ 8Li2S 或 S + 2Li++ 2e-→ Li2S
(b) 負極:Li → Li++ e-或 16Li → 16Li++ 16e-

4-6 電池的容量是衡量其性能的重要參數之一。由容量的單位可知,容量即電池儲存的總電量,換算成國際單位(庫倫)為:
3110 mAh × 10-3× 3600 s·h-1= 11196 C

由于每個硫原子可接受兩個電子,因而含23 g單質硫的理想鋰硫電池組按電池總反應的化學計量比完全放電時,共轉移電量:


4-7 本題旨在引導學生了解“穿梭效應”的本質。過氧鏈“-O-O-”的氧化性是最基礎的元素知識,比如CaO2、BaO2都是常見的氧化劑。同樣,過硫鏈“-S-S-”也具有氧化性,只是氧化能力弱于過氧鏈。在鋰硫電池中,當具有氧化性的多硫化物擴散到金屬鋰負極后,兩者就會在電極處直接發生氧化還原反應,電子不通過外電路做功,造成電極活性物質的損失。這就是“穿梭效應”的化學本質。答案為:

式中:[Li2S6] = c0(Li2S6) - [Li+] = [Li2S6(I)] + [Li2S6(II)]。由4-8題的計算結果可知,[Li2S6(II)] = 0.492[Li2S6(I)],因此,[Li2S6] = 1.492[Li2S6(I)] = 3.03[Li2S6(II)]。代入反應的表觀平衡常數表達式,則有:

4-10 本題由表4.1中的自由能數據即可判斷出溶液中各離子的平衡濃度大小。ΔGd2最大,因此最小。由均裂反應的自由能變大于一級解離反應的自由能變可知,。再結合4-9中的計算結果,本題答案為:

這說明在DME中,Li2S6主要以分子的形式存在。溶液中存在很少量的,而的含量幾乎可以忽略不計。這為抑制“穿梭效應”,設計有合適孔徑及結構的隔膜提供了重要的理論依據。
4-11 考查學生合理設計熱力學過程的能力。

由金屬鋰在水中的標準電極電勢可求出Li(metal) → Li+(H2O) + e-半反應的Gibbs自由能變,即上圖中的。這里需要注意的是,在電極電勢表中,電極反應通常表示為還原半反應式,此時對應的ΔG?= -nFE?。

4-12 考查電荷平衡和物料平衡在溶液化學中的應用。由題目所給比值,可假設的初始濃度為c0,根據電荷平衡:

3 結語
本題結合南開大學言天英教授和高學平教授在鋰硫電池領域的研究成果,向學生介紹了鋰硫電池的基本工作原理。通過簡要的計算,不僅讓學生了解了電池常用性能參數(容量)的物理意義,還向學生展現了理想鋰硫電池的應用前景,彰顯了化學學科對人類生活的重要作用。最后,引出鋰硫電池在實際應用中遇見的難題,引導學生學以致用地將化學原理應用到科學研究上,激發學生的科研興趣。本題綜合考查了返滴定法、元素性質、化學平衡、電化學、物料及電荷守恒等知識點。

