二氧化碳的捕獲和轉化
——第54屆國際化學奧林匹克試題第3題解析
鄭捷,張振杰,程方益,李愷,王穎霞,*
1北京大學化學與分子工程學院,北京 100871
2南開大學化學學院,天津 300071
3鄭州大學化學學院,鄭州 450001
氣候變化是人類面臨的最嚴峻的挑戰之一。人類活動排放帶來的大氣二氧化碳濃度增加已被認為是全球變暖的主要驅動因素。從1880年到2012年,全球平均地表溫度上升了0.85 °C,其中超過85%的溫度上升發生在20世紀,與工業化進程密切相關[1-5]。此外,大氣中的大部分二氧化碳最終會被海洋吸收,導致海洋酸化,危害海洋生物。與工業化前的水平相比,海洋的pH已經降低了0.1個單位,并且隨著化石燃料燃燒不斷排放二氧化碳,最終可能降低0.7個單位[4]。
因此,降低CO2的排放,吸收已排放的CO2,封存CO2乃至將CO2轉化為有用的化合物,都是學術研究和工業應用中的重要課題。本題從最基本的堿液吸收CO2開始,結合吸收體系的重生和CO2的純化,介紹基于電化學過程的最新的研究進展,進一步拓展到新的材料——類沸石咪唑骨架(Zeolitic Imidazolate Framework,簡稱ZIF)體系,介紹ZIF-8的組成和結構特點,分析其在CO2的分離、存儲和轉化中的應用,逐步遞進,引導學生了解基本化學原理在解決人類面臨的重大環境問題中的作用,了解新材料新方法的發展狀況以及潛在的應用價值。
1 出題依據
顯而易見,從排放點甚至直接從空氣中捕獲CO2為減少CO2排放并最終降低大氣中的CO2濃度提供了一種直接的解決方案。傳統的碳捕獲技術需要與大型CO2排放點相結合,而直接空氣捕集(Direct Air Capture,DAC)技術,顧名思義,就是直接從環境空氣中吸收CO2,從而實現CO2捕集處處可行。但是,由于空氣中的CO2濃度低,DAC的熱力學最低能量需求相對于從排放的煙道氣中捕獲碳的要求更高。盡管如此,對DAC的進一步研究對于降低氣候風險至關重要。
DAC常用的吸收劑是NaOH等堿性溶液,吸收劑的再生也是處理過程中的重要一環。傳統上通過碳酸鹽分解進行處理,這一過程在高溫下進行,能耗大。題目中給出的電化學還原就是近年來發展的一種新方法,這一過程巧妙利用電能,通過H2的還原和氧化-“電解水”的拓展-“濃差電池”的構建,實現了CO2的純化和吸收劑的再生[5]。
隨著新型多孔材料的發現和發展,金屬有機骨架(Metal Organic Framework,MOF)在CO2的選擇性分離、儲存和轉化中的應用備受關注[5-7],其中,典型的體系便是類沸石咪唑骨架(Zeolitic Imidzolate Framework,ZIF)[8-10]。題目根據多孔材料的結構特點,進行比表面、孔體積和孔隙率的計算,結合材料的組成,討論催化過程的特點和機理,引導學生強化基礎知識,理解多孔材料吸附和催化的物理基礎。
2 題目及解析
本題可分為三大部分,分別是CO2的直接吸收、吸收劑的再生以及類沸石材料在CO2吸收和轉化中的應用。為清楚起見,題目及其解答和分析也分成三部分展開。
2.1 二氧化碳的吸收
2.1.1 題目
氣候變化是當今最嚴峻的全球挑戰之一。大氣中二氧化碳濃度的增加已被認為是全球變暖的主要驅動因素。CO2的捕集與轉化研究備受關注。在環境空氣中直接提取二氧化碳的直接空氣捕獲(DAC)技術很有前景。傳統的DAC法采用堿性氫氧化物溶液(通常用NaOH),將空氣通入堿液濕法處理吸收CO2,直至溶液的pH ≈ 10 (步驟1)。在吸收所得體系中加入氫氧化鈣進行吸收劑的再生(步驟2)。步驟2中所得白色沉淀A在700 °C熱解,產生CO2和另一種白色化合物B (步驟3)。最后,B與水反應再生成氫氧化鈣。這個過程是個高耗能的過程。(H2CO3:Ka1= 4.5 × 10-7,Ka2= 4.7 × 10-11)
3-1 (2分) 分別寫出A和B的化學式。
3-2 (5分) 寫出步驟1-3中所有可能反應方程式并配平。采用NaOH溶液做吸收劑。
2.1.2 答案與解析
答案:A是CaCO3,B是CaO。
步驟1-3涉及的反應有:
步驟1: (2a) 2NaOH + CO2→ Na2CO3+ H2O
或 2OH-+ CO2→ CO32-+ H2O
(2b) NaOH + CO2→ NaHCO3
或 OH-+ CO2→ HCO3-
或 Na2CO3+ CO2+ H2O → 2NaHCO3
或 CO32-+ CO2+ H2O → 2HCO3-
步驟2: (2c) Na2CO3+ Ca(OH)2→ CaCO3+ 2NaOH
(2d) NaHCO3+ Ca(OH)2→ CaCO3+ NaOH + H2O
步驟3: (2e) CaCO3→ CaO + CO2
在中學階段,鑒定CO2氣體的方法是向石灰水中通入CO2,觀察是否出現白色沉淀CaCO3。可見,此題目所涉及的均為基本反應和基礎知識,不難作答。題文中,在步驟1給出吸收CO2后的體系pH約為10,并在段后給出碳酸解離的平衡常數,這主要是提示吸收體系中既有CO32-也有HCO3-產生。
2.2 吸收劑的再生——H2循環的電化學法
2.2.1 題目
最近開發了一種電化學工藝,用于DAC濕法吸收工藝中吸收后堿液的再生,同時可以獲得適合儲存直接利用的純CO2氣體[5]。該過程基于H2循環的電化學體系(H2-recycling electrochemical system,HRES),如圖3.1所示。
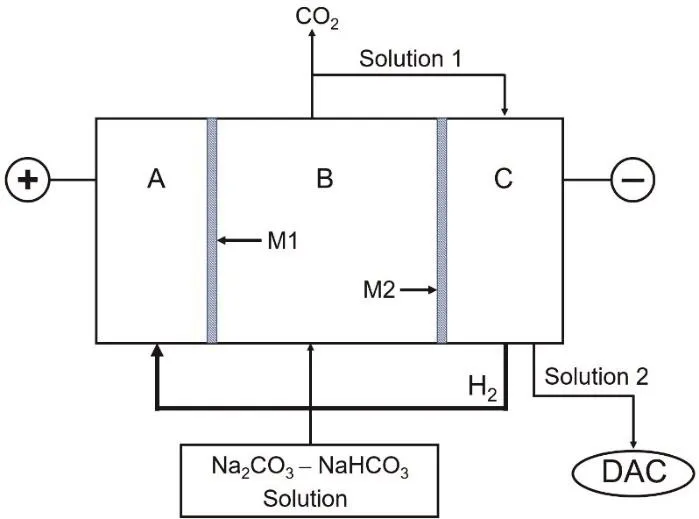
圖3.1 實驗裝置示意圖
圖中所示的電化學體系包含三個隔室:陽極區(A)、“酸化”區(B)和陰極區(C)。它們由離子選擇性滲透膜M1和M2隔開。在工作過程中,H2在陽極氧化,產生的質子被輸送到酸化室,來自直接空氣捕獲技術的乏溶液(Na2CO3-NaHCO3)被通入酸化室。在酸化室中,溶液的pH降低,導致碳酸根轉化為碳酸氫根(反應1),碳酸氫根進一步轉化為碳酸(反應2),當溶液中溶解的CO2達飽和時(溶解度:0.033 mol·L-1),進一步降低pH會導致CO2氣體釋放(反應3)。同時,在陰極區,由于氫氧根的產生而使得NaOH再生,其可作為DAC吸收劑重復使用。
3-3 (2分) 分別寫出陽極(A)和陰極(C)的電極反應。
3-4 (3分) 寫出酸化區(B)中反應1-3的方程式并配平。
3-5 (2分) 選擇能正確描述系統運行過程中陽離子運動的項目。
(a) H+離子通過M1從A滲透到B
(b) H+離子通過M2從B滲透到C
(c) Na+離子通過M1從B滲透到A
(d) Na+離子通過M2從B滲透到C
(e) H+和Na+離子都可以透過M1和M2
3-6 (8分) 使上述電池在穩態下工作,通過電池的電流為2.00 A,溶液(0.050 mol·L-1Na2CO3-0.10 mol·L-1NaHCO3)以10.0 mL·min-1的流量導入區域B。在穩態下陽極室中的pH保持為1。計算電池穩態工作時CO2氣體的生成速率(單位:mmol·min-1)。
2.2.2 答案與解析
第3-3到3-6題的答案如下:
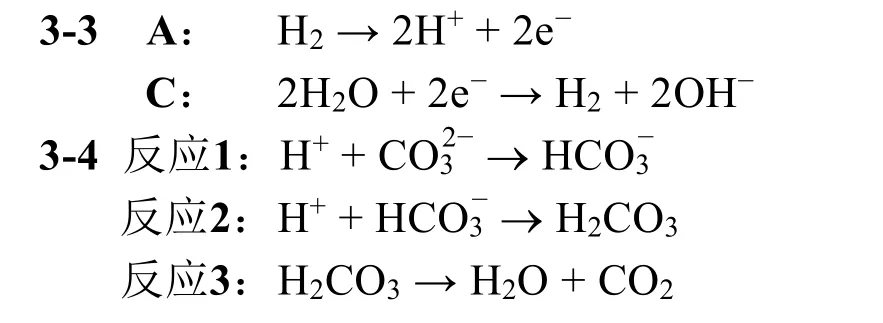
3-5 (a) (d) (e)
3-6 解答步驟如下:

以上題文的設置和問題的解答給出了“H2循環的電化學法”實現吸收劑再生的原理。第3-3題涉及的是電解池的基本工作原理,其本質上可以看作“濃差電池”。基于體系的巧妙設計使得陽極區為酸性,而陰極區為堿性。陰極產生的H2被導入陽極,循環使用。如此,通過電能的消耗驅動電化學反應的發生,通過離子選擇性隔膜的作用有選擇地促使離子合理遷移并驅動反應。第3-4題是本方法的核心,如何進行乏溶液的處理使之再生?源自陽極的H+在此發揮作用,中和CO32-和HCO3-形成H2CO3,H2CO3分解從而使得CO2放出。鑒于H2CO3也常被當作H2O + CO2,如果反應2寫成H++HCO3-→ H2O + CO2,而反應3隨之寫成CO2(aq) → CO2(g),也可以。這3個反應的正確書寫是第3-6題進行計算的基礎。這里,別忘了CO2的溶解!
需要說明的是,題目給出的是大大簡化的理想體系,在實際過程中,受離子遷移率、電化學效率的影響,電流效率并非100%,并需要進一步優化體系結構,降低再生的電能消耗。此外,圖3.1中所示的溶液1需要經過曝氣處理使CO2充分逸出后再導入區域C,如此不僅提升CO2(g)的產出量,也避免其直接引入區域C后和電解產生的堿液反應降低再生效率。
2.3 類沸石咪唑骨架(Zeolitic Imidozate Framework,ZIF):組成、結構與應用
2.3.1 題目
類沸石咪唑骨架(ZIF)是金屬有機骨架(MOF)的一個子類,在二氧化碳捕獲和轉化中有潛在應用[6-16]。在ZIF結構中,通過咪唑酸根(Im-)及其衍生物與具有四面體配位特性的金屬離子(如Zn2+、Co2+)結合而形成3D類似于沸石的骨架。作為咪唑(HIm)的共軛堿,咪唑根陰離子通過其兩個N原子與金屬(M)的陽離子連接。M-Im-M夾角類似于沸石中的Si-O-Si夾角(145°),見示意圖3.2。據此,合成了大量具有沸石型四面體拓撲結構的ZIF材料。
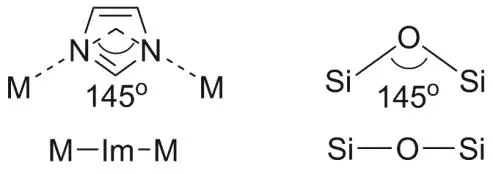
圖3.2 金屬咪唑化合物和沸石中的橋連角
ZIF-8是典型的ZIFs之一,它采用方鈉石(SOD)拓撲骨架,如圖3.3所示。ZIF-8最早由中國科學家陳小明等人通過Zn2+與2-甲基咪唑(CH3(C3N2H3),HmIm)的反應合成得到[12],他們將其命名為MAF-4。ZIF-8屬立方晶系,晶胞參數a = 1.632 nm,驅除溶劑后的有效孔徑為1.16 nm,如圖3.3(d)中的孔內虛擬球所示。
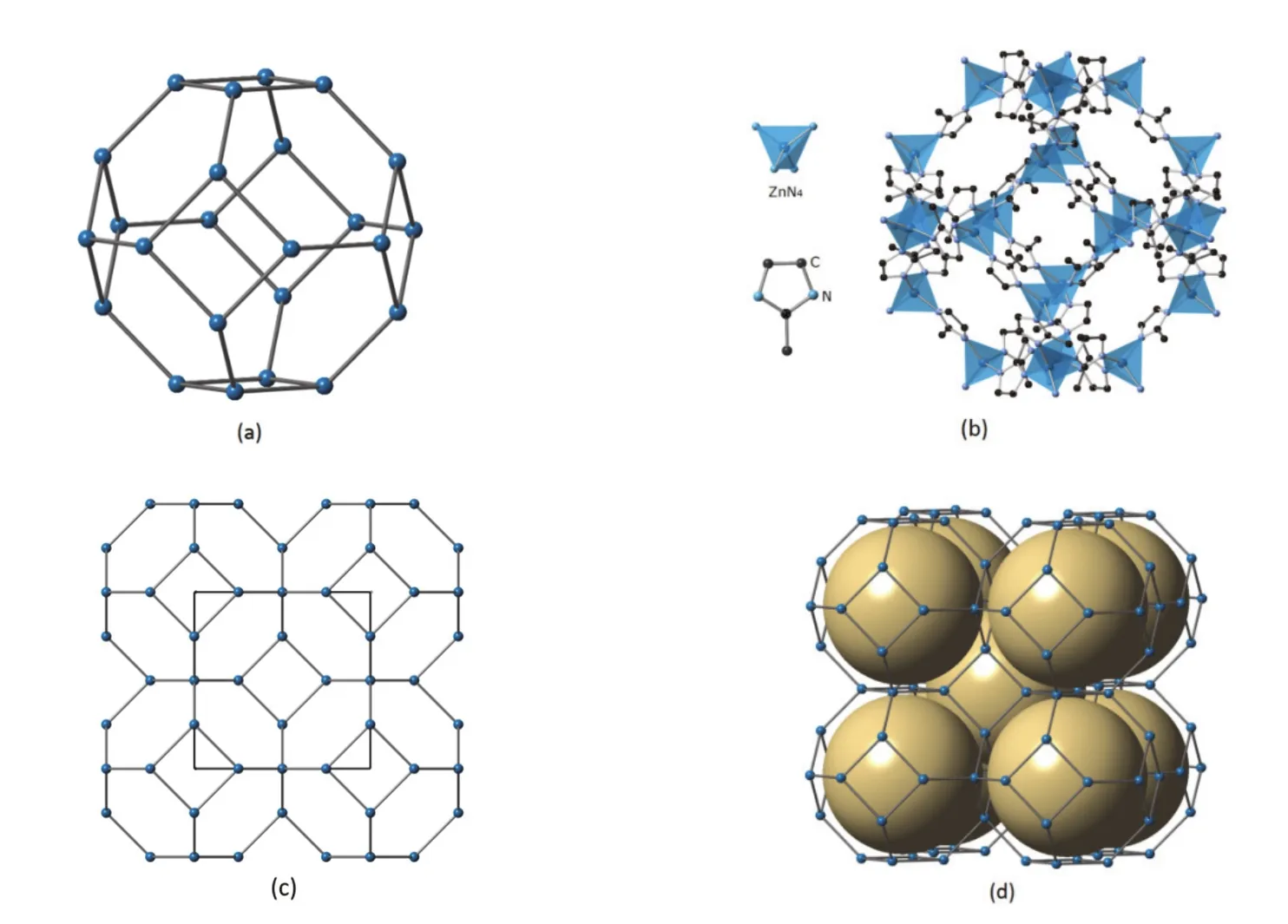
圖3.3 SOD的拓撲結構和對應的ZIF-8結構
ZIF-8還可以作為催化劑,促進二氧化碳轉化為高附加值化學品。最有希望的固定CO2途徑之一是通過CO2的環加成反應制備環狀碳酸酯。其中的代表性例子如下所示[11]:

作為催化劑ZIF-8催化CO2轉化為環狀碳酸酯的可能機理如下[12]:
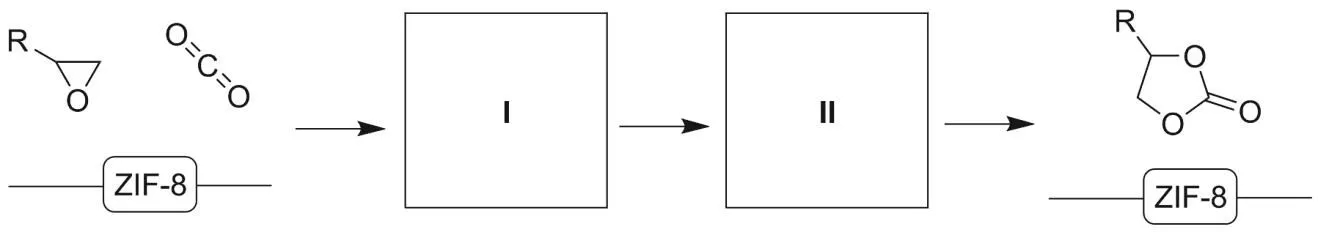
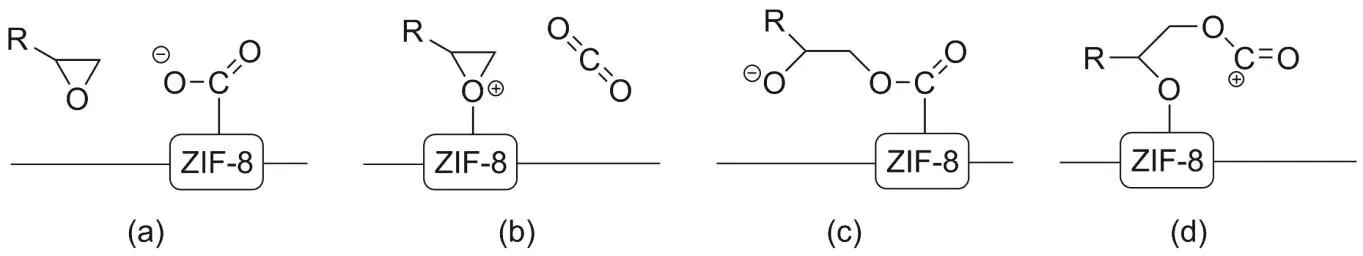
如果在上述催化過程中,ZIF-8提供酸性位點。從下列選項中選擇合理的中間體完成反應:
ZIF-8顯示出較高的熱穩定性。然而,最近的一項研究表明,ZIF-8如果用在潮濕的酸性環境中,它的結構會被破壞[16]。CO2和H2O與ZIF-8的共存會導致ZnCO3的形成。
3-7 (2分) 寫出一個孤立方鈉石籠的化學式。
3-8 (2分) 寫出ZIF-8晶胞的組成。
3-9 (5分) 計算1 g ZIF-8結構中孔(由虛擬球示出)的內表面積S (以m2為單位)。
3-10 (7分) 計算ZIF-8的孔隙率R (R為孔體積與材料實際體積之比)和1 g ZIF-8的孔體積Vp(單位cm3)。
3-11 (2分) 分別寫出與I、II對應的中間體的字母符號。
3-12 (2分) 寫出ZIF-8與CO2和H2O反應的方程式并配平。
2.3.2 答案與解析

3-11 I對應(b),II對應(d)。
3-12 Zn(C4H5N2)2+ CO2+ H2O → ZnCO3+ 2C4H6N2
提起ZIFs系列的研究工作,人們常常想到的是Yaghi教授領導的課題組,他們確實貢獻卓著[6-10]。但實際上,我國的科學家如南京大學游效曾院士、中山大學陳小明院士等領導的課題組比Yaghi研究組更早就有原創性的貢獻,他們當時就將這類材料的拓撲結構與沸石結構明確關聯起來[13-15]。我們也希望通過這道題目,展示中國科學家的工作,激發我國的青少年繼續探索新材料的熱情和勇氣。
如前所述,類沸石咪唑骨架(ZIF)結構中,M-Im-M夾角類似于沸石中的Si-O-Si夾角(145°),即可用咪唑根(Im-)及其衍生物代替氧原子,用具有四面體配位特性的金屬離子(如Zn2+、Co2+)代替Si原子,由此可以獲得一大類具有沸石型結構的金屬-有機框架材料。沸石類骨架理想組成為SiO2,若ZIF中金屬離子為+2價,形成的M(Im)2也為電中性。目前已經得到的M(Im)2類化合物的拓撲骨架類型,除SOD外,還有CRB,DFT,CAG,GAR,GIS,LTA,RHO,MER等類似沸石的骨架類型[17]。具有SOD拓撲結構的ZIF,也有多種組成,可是咪唑根2-,3-,4-位取代,通過有機小分子結構的改變進而調變所得類沸石的結構和反應性。
SOD籠及其對應的方鈉石結構在第54屆國際化學奧林匹克預備題7中已有介紹[18]。本考題就是在此基礎上的知識延伸。第3-7題主要考查的是幾何結構與推理能力。這個孤立的多面體——SOD籠可以看成削角的八面體,有24個頂點,14個面,根據歐拉定理,很容易推出有24 + 14 - 2 = 36條邊。24個頂點上是Zn2+離子,通過處在邊上的2-甲基咪唑根橋連結合形成SOD籠,所以,組成可以寫成,如果將頂點上結合的咪唑根一并考慮進來,就是,頂點的咪唑根是和相鄰接的SOD籠通過橋連方式共享的。第3-8題要求確定晶胞結構,可以結合圖3.3(c)考慮,從圖中可以看出,SOD籠所有頂點的Zn2+離子都處在晶胞的面上且被相鄰晶胞共用,因此,晶胞中只有24/2 =12個Zn2+離子,而要保持電荷平衡,晶胞組成為Zn12(C4H5N2)24。需要指出的是,在3-7題中,若仍考慮的是硅氧骨架,將組成寫為,亦可,因為此處主要是考查理想的拓撲組成;但是,第3-8題的答案只能寫實際組成Zn12(C4H5N2)24,即必須體現所給ZIF-8的晶胞組成。
在ZIF中,借助有機小分子的拓展,可以實現比經典沸石更大的孔道和更高的孔隙率。考慮到中學階段的知識基礎,關于比表面、比孔體積的概念直接給出。因此,需要確定晶胞中孔(虛擬球)的數目,計算出球面積、球體積及晶胞體積大小。依據圖3.3(c)和3.3(d),可以推知每個晶胞中有孔的數目為2,根據球面積、球體積以及立方體體積計算公式,便可以計算出題目3-9和3-10要求的相關的參數。通過這些參數,可以對ZIF材料的孔特性有定量的了解。對比文獻中的數據,利用氣體吸附測得的比表面可達1600 m2·g-1左右,孔體積約為0.6 cm3·g-1,前者和計算值相近,而后者遠高于題目中的計算值。原因何在?第一,題目中計算采用的是“剛性球”模型,而實際的材料中孔道可以連通,結構中的基團具有一定的柔性,之間也可以容納分子;第二,實際材料會有缺陷,這些位置也是很好的氣體吸附中心;以上原因都會導致實測體積較大;第三,實驗得到的“孔體積”是根據吸附數據基于一定的理論模型計算出來的。盡管理論和實驗之間存在誤差,但二者依然具有可比性。通過定量數據,可以使我們對于相關材料體系有更深入的了解。
不僅如此,通過金屬離子和有機配體的調控,ZIF可以實現良好的催化性能,其應用于二氧化碳的催化轉化就是具有代表性的實例。CO2具有高的熱力學穩定性,直接以CO2為原料的聚合反應難度很大,將CO2轉化為可聚合中間體便是一種常用的策略。CO2與高能單體(如環氧化物)反應生成碳酸酯,而環狀碳酸酯開環聚合可以得到具有重要應用價值的聚碳酸酯類高聚物。題目中展示的就是ZIF-8催化苯基環氧乙烷與CO2進行反應生成苯基環乙酸甲酯的過程。關于這一催化過程,也有三種可能的機理:1) 酸式機理,即Mn+離子(通常用其他離子如Co2+,Fe2+,Ni2+全部或部分取代Zn2+)作為Lewis酸中心,通過活化烷基氧,誘導CO2上O作為Lewis堿參與親核加成;2) 堿性機理,咪唑根中的N起到Lewis堿中心的作用,與CO2上的Lewis酸中心C作用,消弱碳氧雙鍵,并吸引烷氧基與之結合,轉移電子對;3) 協同機理,即金屬離子作為Lewis酸中心、咪唑根上的N作為Lewis堿中心,共同起作用。
可調變的組成、結構與性質,遠高于通常MOFs的穩定性,潛在的應用價值,使得ZIFs類材料如眾星捧月,倍受關注。然而,近期研究發現[16],這類材料也有弱點,正如題目中所提到的,在水和CO2共存時,ZIFs會被破壞,生成碳酸鹽和咪唑——這是酸堿和沉淀平衡共同作用的結果!因此,使用此類催化劑時需要注意條件。
3 結語
本題結合備受關注的溫室效應氣體二氧化碳的處理展開,考查了酸堿、沉淀、電化學等基本化學原理和方法,介紹了新型多孔材料的組成、結構和孔結構特點及其在CO2的吸收和轉化中的應用。受考試內容容量的限制,不可能面面俱到,還有很多重要的知識和方法未涉及。
首先,在二氧化碳處理的科學研究中,比如CO2的封存和直接還原也非常引人關注,預備第8題和9題也涉及到轉化的基本方法和原理[17]。二氧化碳封存過程常常和籠形水合物有關,研究者設想在一定條件下讓二氧化碳和水作用形成籠形水合物沉入海底,而將海底的“可燃冰”——甲烷水合物置換出來作為可用的能源。另一方面,以二氧化碳作為氧化劑,尋找合適的電催化材料,使之在合適的條件下與還原劑(如金屬鈉)構造二氧化碳-金屬電池,通過電極反應,提供電能。這就是化學之妙!
第二,類沸石咪唑骨架及其所屬的金屬有機骨架材料,以其多樣的組成和可調控的結構,20多年來一直是材料領域研究的熱點。基于無機離子和有機配體的完美配合,這類材料形成了龐大豐富的物質體系,在氣體吸附分離、催化、發光等領域具有巨大的應用潛力。ZIF的應用也不只是在二氧化碳的儲存和轉化中!例如,南開大學科研人員合成了一例具有SOD拓撲結構的MOF (ZPF-2)[19],其可在干燥環境中(低于30%濕度)從空氣中快速吸附水蒸汽,然后經加熱或抽真空處理可將水脫除。該材料有望用于在干燥環境中富集水分,解決干旱地區的飲水問題。最后,值得一提的是,當利用純咪唑參與反應時,得到的往往是致密相或者畸變的微孔結構,如果引入取代基,特別是在2-位引入甲基、乙基等取代基,就可以調控得到較為“完美”的類沸石材料。從這一思路出發,進行各種取代,既有2-位的取代,也有4-,5-位取代甚至4-,5-位并環的體系拓展,設計化學合成路線,實現了多樣的類沸石及其調控結構,大大拓展了材料的體系,優化了材料的性能。這就是化學之美!

