急性缺血性卒中后睡眠障礙及卒中危險因素與預后的關系*
王衛華,賀 赟,于夢偉,汪可強,陳貴海
(安徽醫科大學附屬巢湖醫院,安徽巢湖 238000)
急性缺血性卒中(AIS)是一類高發的腦血管疾病,占卒中的70%~80%,不僅導致神經系統缺損癥狀,還常伴隨睡眠障礙的發生,AIS患者睡眠障礙主要表現為睡眠質量下降、夜間睡眠減少、日間瞌睡增多、睡眠節律紊亂、睡眠呼吸暫停等[1]。AIS后睡眠障礙的發病機制尚不明確,目前,有學者認為可能與AIS導致的腦結構器質性損傷,以及5-羥色胺、去甲腎上腺素等多種神經遞質失衡有關[2]。一項關于慢性卒中后患者睡眠障礙和預后關系的橫斷面研究表明,理想的睡眠狀態是機體正常的生理需求,同時也是促進卒中患者康復的關鍵因素之一[3],正常睡眠結構中的慢波睡眠期人體基礎代謝率降低、合成代謝功能增強,有助于機體能量儲備和神經系統建立新生突出聯系,睡眠結構紊亂導致慢波睡眠減少會影響神經系統損傷后的康復[4],未經治療的睡眠障礙不僅延緩了卒中后腦損傷的恢復,還會增加卒中復發風險,對AIS患者預后產生諸多不利的影響[5]。盡管國內外很多研究表明,睡眠障礙與預后存在關聯,但仍有許多問題需要解決,因為睡眠障礙定義及評估方法無一致性共識,得出的研究結論也缺乏一致性[6-7]。本研究選取本院收治的AIS患者和同期健康體檢者作為研究對象,探討了AIS后睡眠障礙與預后的關系,分析影響預后的相關危險因素,現報道如下。
1 資料與方法
1.1 一般資料
選取2019年12月至2020年12月本院收治的AIS患者106例作為觀察組,其中預后良好[改良RANKIN量表(mRS)評分0~2分]46例(預后良好組),預后不良[mRS評分3~6分]60例(預后不良組);選取同期健康體檢者103例作為對照組。納入標準:(1)符合2018年頒布的《急性缺血性腦卒中急診急救中國專家共識》[8]中AIS的診斷標準;(2)首次卒中或有卒中史但無后遺癥;(3)病程小于或等于3 d;(4)年齡大于或等于18歲;(4)對本研究知情同意并自愿參與。排除標準:(1)既往有肢體運動功能及認知或精神障礙;(2)合并嚴重心、肝、腎功能不全,以及惡性腫瘤或存在嚴重并發癥;(3)既往存在明確睡眠障礙及抑郁癥病史;(4)無癥狀性腦梗死。觀察組患者性別、年齡、體重、吸煙史等一般資料與對照組比較,差異均無統計學意義(P>0.05),具有可比性。見表1。本研究思路設計與方法均符合本院醫學倫理委員會審核要求,且均在獲取患者監護人同意后才整理、翻閱病歷資料。

表1 觀察組與對照組一般資料比較
1.2 方法
1.2.1睡眠障礙評估
采用匹茲堡睡眠質量指數(PSQI)[9]、Epworth嗜睡量表(ESS)[10]、STOP-Bang問卷(SBQ)[11]評估觀察組和對照組研究對象睡眠情況。PSQI包括主觀睡眠質量、睡眠潛伏期、睡眠時間、睡眠效率、睡眠障礙、睡眠藥物的使用和日間功能障礙7個維度,計0~21分,分值越高表示睡眠質量越差;ESS評估8種不同情況下嗜睡程度,每種情況均為一種相對靜止的狀態,如看電視的情況、堵車的情況等,總分為0~24分,≥6分表示存在日間瞌睡,得分越高表示日間瞌睡傾向越明顯;SBQ計0~8分,≥3分表示具有發生睡眠呼吸暫停綜合征的高風險。
1.2.2資料收集
記錄觀察組和對照組研究對象PSQI、ESS、SBQ評分,以及性別、年齡、高血壓史、糖尿病史、冠心病史、心房纖顫史、吸煙史、血小板計數、晨空腹血糖水平、平均動脈壓、美國國立衛生研究院卒中量表(NIHSS)評分、發病至溶栓時間(ONT)等臨床資料,并分析影響預后的相關因素。
1.2.3隨訪
卒中后6個月對觀察組患者進行電話隨訪或入院后復診,依據mRS評分判定患者預后。
1.3 統計學處理
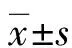
2 結 果
2.1 睡眠情況
觀察組患者PSQI、ESS評分均明顯高于對照組,差異均有統計學意義(P<0.05);SBQ評分與對照組比較,差異無統計學意義(P>0.05)。見表2。

表2 觀察組與對照組患者睡眠情況比較分)
2.2 睡眠障礙與預后的關系
預后不良組患者PSQI、ESS、SBQ評分均明顯高于預后良好組,差異均有統計學意義(P<0.05)。見表3。

表3 預后不良組與預后良好組睡眠情況比較分)
2.3 PSQI、ESS、SBQ評分與預后的相關性
PSQI評分與預后不良呈正相關(r=0.251,P<0.05);ESS、SBQ評分與預后不良無關(r=0.163、0.185,P>0.05)。
2.4 單因素分析
性別、冠心病史、高脂血癥史、心房顫動史、糖尿病史、高血壓史、吸煙史、血小板計數、平均動脈壓與預后無關,差異均無統計學意義(P>0.05);年齡、ONT、晨空腹血糖、纖維蛋白原水平、NIHSS評分與預后有關,差異均有統計學意義(P<0.05)。見表4。

表4 單因素分析
2.5 logistic回歸模型多因素分析
多因素分析結果顯示,以預后是否良好作為因變量(預后良好=0,預后不良=1),以PSQI評分、ESS評分、SBQ評分、年齡、ONT、纖維蛋白原水平、晨空腹血糖水平、NIHSS評分作為自變量進行賦值,年齡:≤60歲=0,>60歲=1;ONT:≤4.5 h=0,>4.5 h=1;纖維蛋白原水平:≤4 g/L=0,>4 g/L=1;晨空腹血糖水平:≤6.1 mmol/L=0,>6.1 mmol/L=1;NIHSS評分:≤8分=0,>8分=1;PSQI評分:≤7分=0,>7分=1;ESS評分:≤10分=0,>10分=1;SBQ評分:≤3分=0,>3分=1。PSQI評分大于7分、年齡大于60歲、纖維蛋白原水平大于4 g/L、NIHSS評分大于8分、ONT>4.5 h是預后不良的獨立危險因素,差異均有統計學意義(P<0.05)。見表5。
3 討 論
AIS是由多種病因和發病機制組成的腦動脈缺血綜合征,具有高發病率和高致殘率等特點,如何改善AIS患者預后一直是臨床研究的熱點。盡管超早期藥物靜脈溶栓和血管內介入治療在很大程度上提高了時間窗內AIS患者的救治效果,但仍有部分卒中患者預后不良,可能與諸多影響因素有關,其中睡眠障礙近年來被認為與預后密切相關[12]。本研究結果顯示,觀察組患者PSQI評分明顯高于對照組,差異有統計學意義(P<0.05),說明AIS患者睡眠質量下降,可能與AIS患者腦結構損傷,以及5-羥色胺、去甲腎上腺素等神經遞質分泌失調、繼發性炎癥和氧化應激反應等因素有關,從而導致卒中后患者睡眠質量下降和睡眠結構紊亂[13-14]。本研究觀察組ESS評分明顯高于對照組,差異有統計學意義(P<0.05),說明AIS患者日間瞌睡傾向更為明顯,與卒中后中樞神經系統病理性改變導致覺醒/睡眠調節系統異常有關,可能是卒中后日間瞌睡直接和最重要的原因之一[15]。
本研究結果顯示,預后不良組患者PSQI、ESS、SBQ評分均明顯高于預后良好組,差異均有統計學意義(P<0.05),究其原因考慮為睡眠質量下降導致AIS患者動力缺乏、執行功能降低、疲乏癥狀等,這些因素將影響患者是否能夠積極配合治療,從而間接影響其預后。ALEXANDROV等[16]對48 h內AIS患者的研究發現,日間瞌睡與腦逆向盜血綜合征(RRHS)呈正相關,ESS評分每增加1分RRHS的風險增加36%(95%可信區間:7%~73%)。RRHS系一種由腦血流動力學導致的異常腦灌注,表現為缺血區腦組織的灌注血流減少,而健側腦組織血流異常增多,進一步加重了患側腦組織的缺血、缺氧,從而導致神經系統功能缺損持續性加重。同時,卒中后睡眠呼吸暫停現象增多可導致機體長時間的間歇性低氧暴露狀態,進而引起腦血流灌注減少,腦組織缺血損傷加重[17]。本研究Spearman檢驗分析結果顯示,PSQI評分與預后不良呈正相關(r=0.251,P<0.05)。劉紅等[18]發現,AIS患者睡眠障礙發生率更高,AIS患者睡眠質量下降與預后不良密切相關,與本研究結果一致。
本研究多因素分析結果顯示,PSQI評分大于7分、年齡大于60歲、纖維蛋白原水平大于4 g/L、NIHSS評分大于8分、ONT>4.5 h是卒中預后不良的獨立危險因素。分析原因:(1)PSQI評分是體現睡眠質量的一個重要量表參數,卒中后腦損傷導致的睡眠調節中樞結構性損傷、抑制性神經遞質水平降低和興奮性神經遞質過度,睡眠-覺醒調節系統長時間處于覺醒狀態,從而導致卒中后患者的睡眠質量下降,可出現睡眠潛伏期延長、睡眠片段化、睡眠效率降低等,部分患者很容易出現焦慮、抑郁及執行功能降低等表現[19-20],直接或間接影響患者預后。(2)老年AIS患者存在基礎功能差、新陳代謝緩慢、腦側支循環不良等因素,發生腦缺血性卒中事件后更容易出現腦損傷加重及遠期預后不佳。(3)纖維蛋白原作為一種血液凝固因子,在凝血酶催化作用下可生成纖維蛋白,直接參與凝血過程,高纖維蛋白原血癥容易促進血栓形成,從而導致卒中后癥狀進展和預后變差[21]。(4)NIHSS評分作為反映卒中病情嚴重程度公認的客觀性指標,評分越高表示神經系統損害越嚴重,預后越差,在既往的大量研究中已被明確證實。(5)AIS患者隨缺血時間窗延長,缺血半暗帶的腦組織出現不可逆壞死,ONT時間的延長是導致卒中預后不良的重要因素。車鋒麗等[22]發現,卒中發病至治療時間、NIHSS評分、年齡是影響AIS預后的獨立危險因素,與本研究結果也是一致的。
綜上所述,AIS患者睡眠質量下降,日間瞌睡傾向更為多見,預后不良患者睡眠質量下降、日間瞌睡、睡眠呼吸暫停現象更明顯,PSQI評分與預后不良呈正相關,PSQI評分大于7分、年齡大于60歲、纖維蛋白原水平大于4 g/L、NIHSS評分大于8分、ONT>4.5 h是預后不良的獨立危險因素。因此,在臨床診治過程中對具有PSQI評分大于7分、年齡大于60歲、纖維蛋白原水平大于4 g/L、NIHSS評分大于8分、ONT>4.5 h的一種或多種影響因素的卒中患者更應給予密切關注,及時改善睡眠障礙并對相關卒中危險因素進行干預,可能對改善AIS患者預后具有重要意義。

