EHF 通過抑制Wnt/β-catenin 通路活性下調胰腺癌細胞的干性*
王昊天 段晶晶 陳幸運 高春濤
E26 轉化特異性同源因子(E26 transformationspecific homologous factor,EHF),又名上皮特異性轉化因子3(epithelium-specific ETS factor family member 3,ESE3),是ETS 超家族中的一員,廣泛存在于細胞核內,屬于轉錄調控因子。EHF 在胰腺癌、前列腺癌中均發揮抑癌作用[1-4]。最新研究發現EHF 可下調胰腺癌細胞的干性[5],而干性是導致胰腺癌耐藥及進展的重要原因[6-7],提示有望針對EHF 通路探索治療胰腺癌的新方法。基于此,本研究通過生物信息學分析,結合分子生物學實驗及經典的干性功能學實驗[8]探討EHF 調控胰腺癌細胞干性的具體機制,以期為探索胰腺癌治療新靶點提供科學依據。
1 材料與方法
1.1 材料
1.1.1 胰腺癌細胞系 BXPC-3 及PANC-1 購自中國科學院上海細胞庫,MIA PaCa2 及SW1990 購自美國American Type Culture Collection(ATCC)公司。
1.1.2 主要試劑及儀器 EHF 抗體(貨號LS-C30726)購自美國LifeSpan Biosciences 公司;GADPH 抗體(貨號RM-2005)購自中國北京銳抗生物科技有限公司;β-catenin 抗體(貨號YM3345)、c-myc 抗體(貨號YT0991)、CD44 抗體(貨號YM6155)購自美國Immunoway 公司;PE-Cy7 標記的ESA 抗體(貨號9C4)、FITC 標記的CD24 抗體(貨號ML5)以及APC 標記的CD44 抗體(貨號BJ18)購自美國Biolegend 公司;GFP 標記的EHF 過表達和敲低的病毒液購自中國北京奧科鼎盛生物科技有限公司;Polybrene 購自美國Santa Cruz Biotechnology 公司;Wnt/β-catenin 通路抑制劑XAV939 購自美國MedChemExpress 公司;BCA蛋白濃度測定試劑盒、RIPA 裂解液購自中國碧云天生物科技公司;Trizol Regent、逆轉錄試劑盒、SYBR Green PCR Master Mix 和RNA 熒光定量檢測試劑盒均購自日本Takara 公司;ChIP 試劑盒購自瑞士Roche公司;雙熒光素酶報告基因試劑盒購自美國Promega 公司;帶有目標基因片段的PGL3 熒光素酶質粒及海腎質粒購自中國吉凱基因公司;Western Blot 化學發光成像儀購自中國深圳佰思恒科技有限公司;CFX96 Real time PCR 反應儀購自美國Bio-Rad 公司;流式細胞儀購自美國Thermo Fisher Scientific 公司;普通倒置顯微鏡購自日本Olympus 公司。
1.2 方法
1.2.1 EHF 過表達及敲低細胞系構建 利用PANC-1 細胞構建EHF 穩定過表達細胞系,利用SW1990 細胞構建EHF 穩定敲低細胞系。通過感染EHF 過表達和敲低的病毒,繼而以嘌呤霉素藥篩的方法構建EHF外源性過表達及敲低細胞系。
1.2.2 蛋白提取及Western blot 利用RIPA 裂解液進行細胞蛋白的提取。Western blot 具體步驟同常規實驗。
1.2.3 RNA 提取、反轉錄及RT-qPCR 利用Trizol裂解液提取細胞RNA,使用逆轉錄試劑盒將總RNA逆轉錄為cDNA。按照試劑盒說明書構建RT-qPCR 體系上機檢測。引物序列見表1,基因的相對表達水平用2-ΔΔCt法計算。

表1 RT-qPCR 的引物序列
1.2.4 流式細胞術 將實驗細胞進行消化、計數、清洗后,避光條件下加入binding buffer 及流式抗體,室溫孵育半個小時后清洗細胞,移入流式檢測管內,避光保存于4℃冰箱內,在24 h 內上機檢測。
1.2.5 懸浮細胞成球 將實驗細胞進行消化及計數,將5 000 個細胞均勻加入含有2 mL 干性培養基的低粘附6 孔板內,保證細胞不成團且均勻懸浮分布,每3 d 添加500 μL 干性培養基,約14 d 后用普通倒置顯微鏡進行采圖,計算干性細胞球的細胞成球率(sphere formation efficiency,SFE):每個孔中形成的干性球總數/每孔細胞數總數×100%。實驗重復三次,計算平均值。
1.2.6 軟瓊脂克隆形成 將培養基與1.2%的瓊脂糖液按1∶1 比例混合,取1 mL 迅速鋪于6 孔板內,待其凝固。取500 個目標細胞與2×全培養基及0.7%的瓊脂糖液進行混合(后兩者按1∶1 的比例提前混合),隨后將含有細胞的混合液均勻鋪至已經凝固的下層凝膠上,等待上層凝膠慢慢凝固。凝固后,在表面均勻滴加500 μL 2×全培養基,隨后每3d 滴加500 μL 2×全培養基。14d 后觀察克隆形成的數量和大小,計算克隆形成率(colony formation efficiency,CFE)。每50 個細胞形成的集落認為是1 個單克隆,計數每個孔中克隆總數/孔中細胞總數×100%即得單孔的克隆形成率。實驗重復三次,計算平均值。
1.2.7 ChIP 實驗 按照試劑盒說明書進行實驗,EHF 結合序列的PCR 引物為:β-catenin-F:5,-CGCCTT ACCACCCACCAAG-3,,β-catenin-R: 5,-GGCATATC GTTGTGCCAGGT-3,。
1.2.8 雙熒光素酶報告基因實驗 按照試劑盒說明書進行實驗,重復三次,計算平均值。
1.3 生物信息學分析
下載TCGA 數據庫中的胰腺癌數據,通過DAVID 網站及KOBES 網站進行EHF 差異基因的功能富集分析及KEGG 通路富集分析[9],在前十位分子通路中尋找與胰腺癌細胞干性相關的信號通路。在此基礎上繼續利用基因探針富集分析(GSEA)[10]對TCGA中胰腺癌數據進行計算,進一步驗證EHF 與KEGG富集出的干性相關通路是否存在相關性。
1.4 統計學分析
2 結果
2.1 生物信息學分析發現Wnt/β-catenin 通路參與EHF 對胰腺癌細胞干性的調控
通過KEGG 通路分析,發現在富集出的與EHF相關的前十位分子通路中,與胰腺癌細胞干性相關的為位列第五位的Wnt/β-catenin 通路(圖1A),該通路為經典的干性通路[11]。在此基礎上,GSEA分析提示EHF mRNA 水平與Wnt/β-catenin 通路的活性呈負相關,差異具有統計學意義(P<0.01,圖1B)。
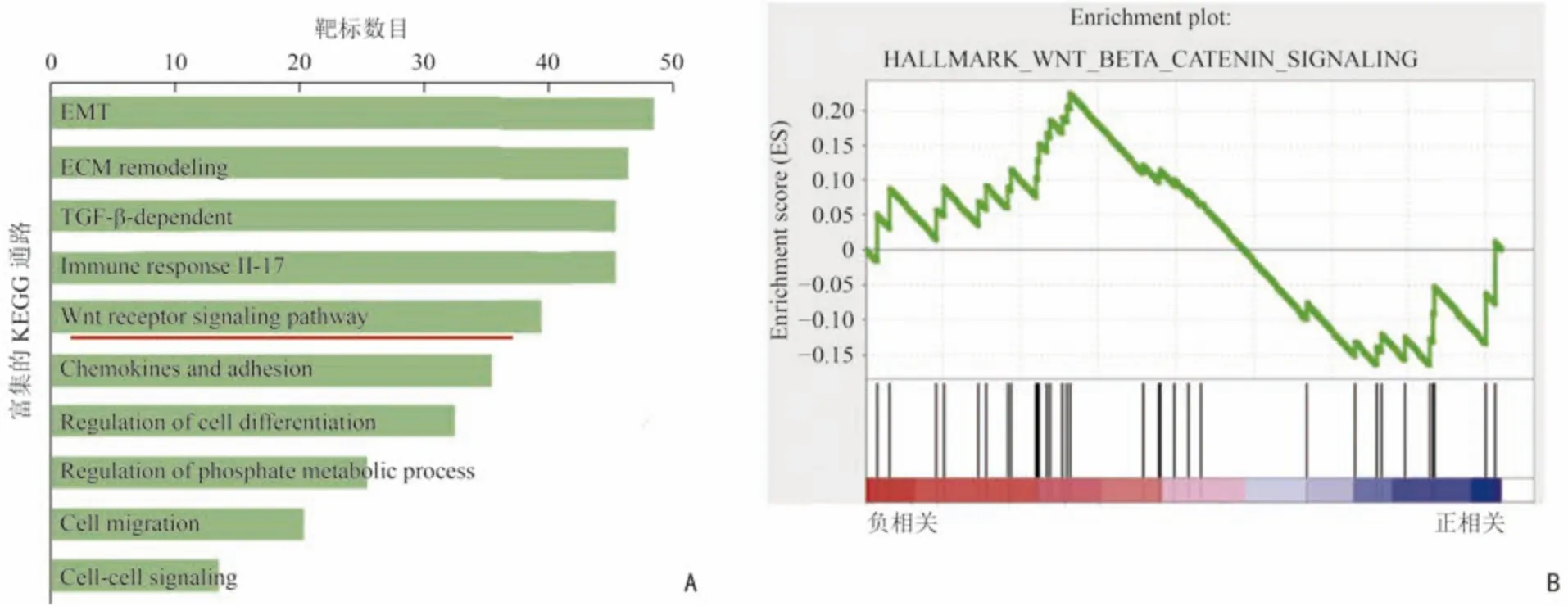
圖1 胰腺癌EHF 表達與Wnt/β-catenin 通路存在相關性
2.2 胰腺癌細胞EHF 的表達水平與Wnt/β-catenin通路的活性呈負相關
選取4 種常用的人源胰腺癌細胞系BXPC-3、PANC-1、MIA PaCa2 以及SW1990 進行常規培養,檢測其EHF 的基礎表達量。PANC-1 細胞及MIA PaCa2 細胞EHF 基礎表達量低,后續利用PANC-1細胞構建外源性EHF 穩定過表達的細胞系;BXPC-3細胞及SW1990 細胞EHF 基礎表達量高,后續利用SW1990 細胞構建外源性EHF 穩定低表達的細胞系。進而以上述細胞系為基礎探討EHF 對Wnt/β-catenin 通路活性的影響(圖2A)。Wnt/β-catenin 通路中有多個重要分子,如β-catenin、c-myc、Cyclin D1、CD44、TCF-1[12],本研究最終選擇β-catenin、c-myc 及CD44作為代表Wnt/β-catenin 通路活性的指標。前兩個蛋白是研究Wnt/β-catenin 通路最常用的蛋白,而考慮到本研究選取CD44 作為胰腺癌細胞干性特征的標志物,故CD44 的表達也用于反映Wnt/β-catenin 通路的活性。通過Western blot 及RT-qPCR 實驗,證實EHF的表達水平與代表Wnt/β-catenin 通路活性的因子βcatenin、c-myc 及CD44 的表達呈負相關,差異具有統計學意義(均P<0.01,圖2B,2C)。
2.3 EHF 直接調控β-catenin 的轉錄
為了探索EHF 與β-catenin 的相關性是否由EHF的轉錄調控所引起,首先利用JASPAR 和UCSC 兩個在線數據網站預測β-catenin 啟動子區可能存在的與EHF 發生結合的高分序列(圖2D),隨后利用ChIP 實驗發現EHF 可結合于β-catenin 啟動子區(圖2E)。為進一步證實這種空間結構上的結合可引起轉錄改變,本研究進行了雙熒光素酶報告基因實驗。無論在293T 細胞還是在胰腺癌細胞中,將β-catenin 啟動子區全長序列的質粒導入后,在外源EHF 質粒的刺激下,熒光強度明顯下降,差異具有統計學意義(P<0.001,圖2F)。而將β-catenin 啟動子區中EHF 結合位點突變后的質粒導入后,即使給予同樣的外源性EHF 質粒刺激,熒光強度較對照組也無明顯變化(P>0.05)。由此證實,EHF 可直接抑制β-catenin 的轉錄。
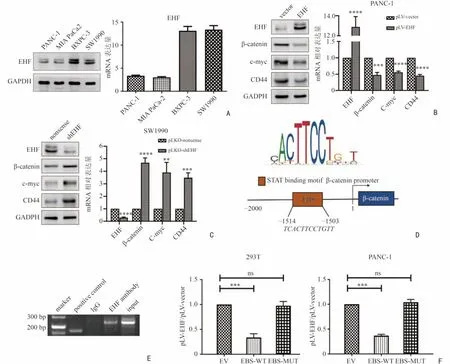
圖2 EHF 通過抑制β-catenin 的轉錄影響Wnt/β-catenin 通路的活性
2.4 利用XAV939 阻斷Wnt/β-catenin 通路的活性
以上結果證實EHF 可抑制Wnt/β-catenin 通路的活性,為進一步證實Wnt/β-catenin 通路在EHF 促進干性過程中的重要性,本研究進行了阻斷實驗,借助XAV939 阻斷Wnt/β-catenin 通路的活性。XAV939通過抑制聚ADP-核糖基化酶tankyrase 1 和tankyrase 2穩定axin,從而刺激β-catenin 發生降解進而阻斷Wnt/β-catenin 通路的活性[13],是效果確切的Wnt/βcatenin 通路抑制劑。在EHF 敲低后,Wnt/β-catenin 通路激活,在此基礎上利用XAV939 抑制該通路的活性,隨后通過Western blot 和RT-qPCR 實驗進行驗證。結果發現,在SW1990 細胞中,由EHF 敲低引起的Wnt/β-catenin 通路激活,經XAV939 處理后,βcatenin、c-myc 及CD44 的含量均出現明顯的回落,差異均具有統計學意義(均P<0.01,圖3),但EHF 的含量并不受XAV939 的影響。且由于XAV939 僅影響β-catenin 的降解,故β-catenin 的mRNA 水平并不會受到XAV939 的影響。
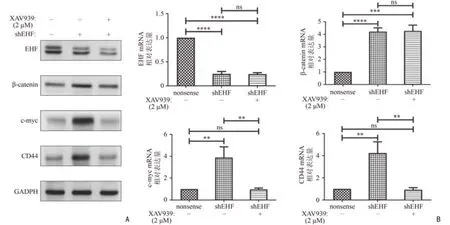
圖3 利用XAV939 阻斷Wnt/β-catenin 通路的活性
2.5 阻斷Wnt/β-catenin 通路可抑制由于EHF 敲低引起的干性上調
利用流式細胞術、懸浮成球及軟瓊脂克隆這3 種經典的干性功能學實驗檢測胰腺癌細胞的干性變化。研究顯示[14],選擇ESA、CD24 和CD44 作為胰腺癌干性特征的標志物,三個指標均為陽性的細胞被認為是具有干性特征的胰腺癌細胞。如圖4A 所示,在SW1990 細胞中,隨著EHF 敲低,干性特征細胞增多(P<0.01),但是經XAV939 處理后,具有干性特征的細胞比例明顯減少(P<0.01),甚至降至對照組水平(P>0.05)。與流式細胞術結果相同,發現隨著EHF 的含量下降,胰腺癌細胞的懸浮成球能力及軟瓊脂克隆形成增加(P<0.001),但經XAV939 處理(2 μM)后,懸浮成球及軟瓊脂克隆的數量和大小均出現明顯下降(P<0.001,圖4B,4C)。雖然EHF 作為轉錄因子可能會通過調控多條通路而抑制胰腺癌細胞的干性,但通過上述實驗可以得出結論,Wnt/β-catenin 通路在其中占有主導作用。
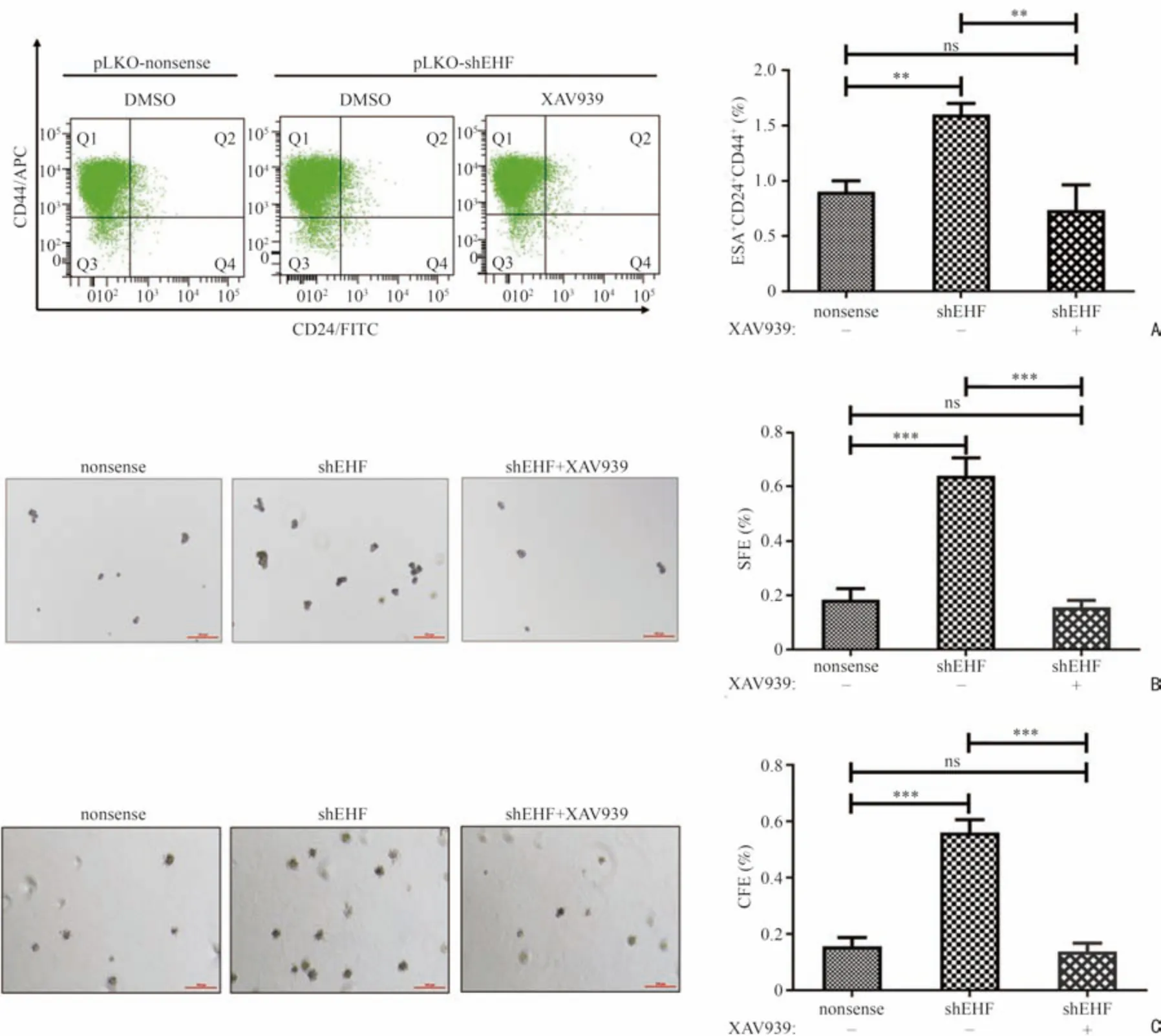
圖4 阻斷Wnt/β-catenin 通路可有效抑制由EHF 敲低引起的胰腺癌細胞干性上調
3 討論
胰腺癌是一種相對少見的消化道惡性腫瘤[15],其發病率為十萬分之十二到十五,位于胃癌、結直腸癌、肝癌、食管癌之后,位列消化道惡性腫瘤的第5 位[16]。由于其解剖位置相對隱匿,早期癥狀缺乏特異性,患者就診時往往已處于晚期,可接受手術的患者比例不足20%,而可以從中獲益的患者甚至不足5%[17]。胰腺癌可以選擇的化療藥物非常有限[18],且存在嚴重的耐藥現象[19],而分子靶向治療[20]及免疫治療[21]在胰腺癌中的響應均較差[22],導致胰腺癌整體的死亡率幾乎與發病率持平[23]。因此迫切需要尋找胰腺癌治療的新靶點。
EHF 為本課題組重點關注的具有抑癌作用的轉錄因子,前期研究發現EHF 可抑制胰腺癌發生上皮間質轉化,進而抑制胰腺癌的轉移[2]。考慮到惡性腫瘤發生上皮間質轉化與腫瘤細胞的干性特征息息相關[24],干性又是引起惡性腫瘤耐藥[25]和遠處轉移[26]的重要原因,而EHF 被證實可抑制胰腺癌細胞的干性[5],故推測可以從EHF 入手尋找抑制胰腺癌細胞干性的方法。作為轉錄因子,EHF 調控的下游靶基因及信號通路眾多。在精準治療的背景下,可將影響權重最大的通路篩選出來,并針對其進行臨床治療的轉化研究。因此,本課題組借助生物信息學的分析方法篩選出受EHF 調控且會影響腫瘤細胞干性的Wnt/β-catenin 通路,通過Western blot 和RT-qPCR 實驗證實其調控關系,即在胰腺癌細胞中EHF 的表達水平與Wnt/βcatenin 通路的活性呈負相關。后續的機制實驗也證實,EHF 可通過抑制β-catenin 的轉錄發揮下調Wnt/βcatenin 通路活性的作用。
為證實Wnt/β-catenin 通路在EHF 影響胰腺癌干性過程中發揮重要作用,本研究利用該通路的活性抑制劑XAV939 成功構建了阻斷實驗模型。以此模型為實驗對象,應用流式細胞術、懸浮細胞成球實驗和軟瓊脂克隆形成實驗等得出了一致的結論,雖然EHF可能調控很多分子信號通路,但Wnt/β-catenin 通路在其中占據主導地位,針對該通路進行抑制是有意義的。后續可以嘗試利用Wnt/β-catenin 通路抑制劑來降低胰腺癌細胞的干性能力,進而減少遠處轉移,甚至逆轉耐藥,而EHF 也有望成為篩選從該治療中獲益人群的分子標記物。
本研究也存在不足之處。首先,僅在胰腺癌細胞系中進行了探索,后續仍需在動物體內甚至臨床試驗中驗證實驗結論的正確性和治療的安全性。其次,XAV939 是否符合活體使用的標準,是否需要改變化學結構以適用于臨床試驗,亦或在已經上市的藥物中是否已經存在抑制Wnt/β-catenin 通路活性的藥物,這些均是接下來研究工作的重點。EHF 伴隨診斷的檢測方法及標準也存在很多不確定性,使用免疫組織化學法進行檢測還是基因測序[27],或者使用創傷性更小的技術如ctDNA 或ctRNA 的液態活檢等[28],需要更加深入的頭對頭研究去選擇敏感性和特異性更高、臨床操作簡便、同時符合醫學經濟學要求的檢測方法。
綜上所述,EHF 可抑制胰腺癌細胞的干性,而Wnt/β-catenin 通路在該過程中起著主導作用,體外實驗證實通過抑制該通路的活性可有效降低腫瘤細胞的干性。該研究為胰腺癌臨床治療提供了新的思路,但尚待進一步的體內研究進行論證。

