RNA干擾HSF1增強碘125粒子放療裸鼠胰腺癌移植瘤敏感性的分析
龔 敏 王愛萍 王桂良 邱 萍 徐林芳 李 興 文劍波
胰腺癌是常見的消化道腫瘤,起源于胰腺導管上皮細胞或腺泡細胞腫瘤,其侵襲能力強、惡性程度高、發病機制復雜,治療難度大,預后差,中位生存期不到1年,整體5年生存率僅為6%[1]。手術切除是唯一可治愈早期胰腺癌的方法,對于晚期患者,患者就診時已至中晚期,已失去手術機會,只能采用保守治療,如放療、化療、免疫治療等。碘125粒子局部植入治療是一種新興的治療方案,碘125粒子能釋放大量的 X 射線及 γ 射線,可抑制腫瘤細胞有絲分裂并破壞細胞核的 DNA 及產生氧自由基持續性殺滅腫瘤細胞[2]。但是在癌組織接受放療時,會產生放療抵抗,HSF1是和應激相關的一個非常重要的轉錄因子,在胰腺癌組織中,通過DNA修復、調節細胞周期、調節能量代謝、調節細胞凋亡和自噬等途徑,促進放療抵抗[3]。本實驗采用小干擾RNA(small RNA interference,siRNA)沉默 PANC-1 細胞的HSF1基因,建立移植瘤模型,探討HSF1與胰腺癌放療抵抗的關系及沉默HSF1與胰腺癌放療敏感性之間的關系。
1 材料與方法
1.1 材料
1.1.1 細胞和主要試劑 胰腺癌PANC-1 細胞系購自美國ATCC公司。HSF1抗體購自美國Abcam公司,碘125粒子(粒子活度為0.6mCi) 購自原子高科股份有限公司,TUNEL試劑盒購自瑞士Roche公司,Trizol試劑自美國Invitrogen公司,PCR反轉錄試劑盒和Taq聚合酶購自日本TaKaRa公司。Realtime-PCR擴增基因引物序列見表1,由上海生工生物科技有限公司合成。

表1 各基因的引物序列
1.1.2 動物 本實驗符合國家有關實驗動物保護規范和管理條例,經本院倫理委員會審批。BALB/c-nu裸鼠(5~6周齡,體重18~22 g)購自江西中醫藥大學動物部[許可證號SYXK(贛)2008-2006)],飼養于恒定溫度(22 ℃~25 ℃)的無菌層流動物房內SPF環境。
1.2 方法
1.2.1 裸鼠成瘤 取空白細胞和干擾HSF1的PANC-1 細胞進行實驗,制成單細胞懸液,用DMEM培養液調細胞懸液為 1×106個/100 μL,每只裸鼠前腋下皮下接種細胞懸液200 μL,待腫瘤直徑達 0.8~1 cm時繼續下一步實驗。
1.2.2 胰腺癌細胞移植瘤裸鼠分組及碘125粒子放療 成瘤裸鼠隨機分為4組:空白細胞組;ShRNA-HSF1組;空白細胞+碘125粒子組;ShRNA-HSF1+碘125粒子組;每組4只。碘125粒子植入裸鼠方法:乙醚吸入麻醉,碘伏消毒腫瘤局部和周圍皮膚,18 G穿刺針在距腫瘤邊緣1 cm處穿刺皮膚,皮下潛行進入腫瘤組織中央,退出針芯,然后將一粒碘125粒子置入穿刺針,改用圓頭針芯后將碘125粒子推入瘤體中央。20 天后處死裸鼠,取瘤體,計算體積,稱重。體積=0.52×長徑×短徑×短徑;抑瘤率=[(對照組平均瘤重-碘125組平均瘤重) /對照組平均瘤重]×100%。
1.2.3 病理組織學觀察 仔細完整剝離腫瘤組織,去除邊緣結締組織,生理鹽水清洗瘤體表面,濾紙吸干水分,以10%福爾馬林固定,石蠟包埋制片,蘇木精-伊紅染色,在光學顯微鏡下400倍觀察腫瘤細胞形態學變化并拍照。觀察各組腫瘤瘤體內壞死區域的大小,按壞死面積所占瘤體面積比例評分。評分標準:根據組織結構的破壞和細胞空泡化,水腫,出血和壞死,壞死分級,1分:1%~25%;2分:25%~50%;3分:50%~75%;4分:75%~100%。
1.2.4 TUNEL法檢測腫瘤組織中細胞凋亡情況 腫瘤組織切片、脫蠟至水,使用20 μg/ml蛋白酶K對切片通透,37 ℃孵育30 min;磷酸鹽平衡鹽水清洗,將切片浸入3%過氧化氫封閉液室溫封閉10 min;磷酸鹽平衡鹽水清洗后,置于濕盒37 ℃孵育末端脫氧核苷酸轉移酶(terminal deoxyribonucleotidyl transferase,TdT)反應液60 min;磷酸鹽平衡鹽水清洗,孵育生物素-辣根過氧化物酶工作液,37 ℃避光反應30 min;DAB工作液顯色后,蘇木精復染細胞核;晾干后中性樹脂封片。使用光顯微鏡隨機選取5個視野(×400)觀察腫瘤組織中細胞凋亡情況。細胞中顯示綠色顆粒為陽性表達,使用Motic 6.0圖像分析系統進行統計分析,凋亡指數(AI)%=[凋亡細胞數/腫瘤細胞總數]×100%。
1.2.5 Real-time PCR檢測mRNA表達 取80~100 μg組織,Trizol法提取RNA,反轉錄成cDNA。PCR引物序列見表1,由生工生物工程(上海)股份有限公司合成。 配制20 μL的多聚酶鏈反應體系:加入上游引物0.5 μL,下游引物0.5 μL SYBR Enzyme 10 μL,cDNA1 μL,無酶水8 μL。PCR 反應條件為:95 ℃預變性10 min,95 ℃變性30 s,60 ℃延伸1 min,共40個循環。GAPDH作為內參,逆轉錄聚合酶鏈式反應擴增,分析各基因的表達水平。2-ΔΔCt法分析表達數據 (標準化至內部對照水平后)。
1.2.6 Western blot 免疫印跡法檢測蛋白表達 取80~100 μg組織,提取組織總蛋白,以10%十二烷基硫酸鈉-聚丙烯酰胺膠電泳1 h,使用轉移電泳裝置,在4 ℃、300 mA恒流條件下電轉150 min,將蛋白轉移到聚偏二氟乙烯膜上。 用含5%脫脂牛奶的TBST 溶液室溫封閉1 h,加入一抗,4 ℃孵育過夜;TBST洗膜3次,每次10 min,加入熒光二抗,室溫避光孵育1 h,洗膜后滴加適量混勻的超靈敏化學發光 (enhanced chemiluminescence,ECL)液,放置在化學顯色儀中進行曝光顯像。使用Image J軟件分析計算各條帶灰度值,以目的蛋白與內對照GAPDH蛋白條帶的比值分析目的蛋白的相對表達量。
1.3 統計學分析
應用SPSS 22.0軟件對數據進行統計學分析。計量資料以均數±標準差表示,計數資料以百分率表示,兩組之間的比較用t檢驗,多組差異比較采用單因素方差分析,兩兩比較采用SNK-q檢驗,以P<0.05表示差異有統計學意義。
2 結果
2.1 HSF1在空白細胞組和ShRNA-HSF1組細胞中的表達
HSF1蛋白在空白細胞組中表達較高,而在 ShRNA-HSF1組中表達較低,差異有統計學意義(圖 1)。
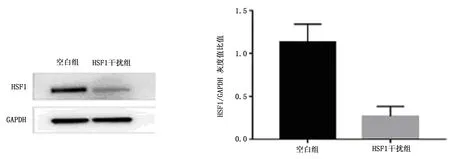
圖1 HSF1在空白細胞組和ShRNA-HSF1組細胞中的表達
2.2 各組裸鼠移植瘤體積、瘤重、抑瘤率比較
與自然生長的裸鼠移植瘤體積相比,ShRNA-HSF1組小于空白細胞組,差異有統計學意義;經碘125粒子治療的裸鼠移植瘤體積相比,ShRNA-HSF1組小于空白細胞組,差異有統計學意義;ShRNA-HSF1組抑瘤率高于空白細胞組(表2)。

表2 各組裸鼠移植瘤體積、瘤重、抑瘤率比較
2.3 蘇木精-伊紅染色檢測4組裸鼠移植瘤組織壞死評分
自然生長的空白細胞及ShRNA-HSF1組無明顯壞死,空白細胞+碘125粒子組及ShRNA-HSF1+碘125粒子組的壞死評分增加,兩者比較差異有統計學意義(表3)。
2.4 4組裸鼠移植瘤凋亡指數比較
自然生長的空白細胞組及ShRNA-HSF1組凋亡不明顯,空白細胞+碘125粒子組和ShRNA-HSF1+碘125粒子組凋亡細胞增多,細胞質濃縮、染色質濃集于核膜周圍,典型的凋亡小體形成。凋亡細胞分析,ShRNA-HSF1+碘125組較空白細胞+碘125組顯著性增多(表4)。

表3 4組裸鼠移植瘤壞死評分比較

表4 4組裸鼠腫瘤凋亡指數情況比較
2.5 ShRNA-HSF1對凋亡相關基因Bcl2、Bax與Caspase 3 mRNA表達的影響
在自然生長條件下,與空白細胞組相比,ShRNA-HSF1能抑制Bcl2 mRNA的表達,經碘125粒子放療后,Bcl2 mRNA表達降低,ShRNA-HSF1進一步促進Bcl2 mRNA表達降低。在自然生長條件下,與空白細胞組相比,ShRNA-HSF1能促進Bax mRNA的表達,經碘125粒子放療后,Bax蛋白表達升高,ShRNA-HSF1進一步促進Bax mRNA表達升高。在自然生長條件下,與空白細胞組相比,ShRNA-HSF1能促進Caspase 3 mRNA的表達,經碘125粒子放療后,Caspase 3蛋白表達升高,ShRNA-HSF1進一步促進Caspase 3 mRNA表達升高(圖2)。
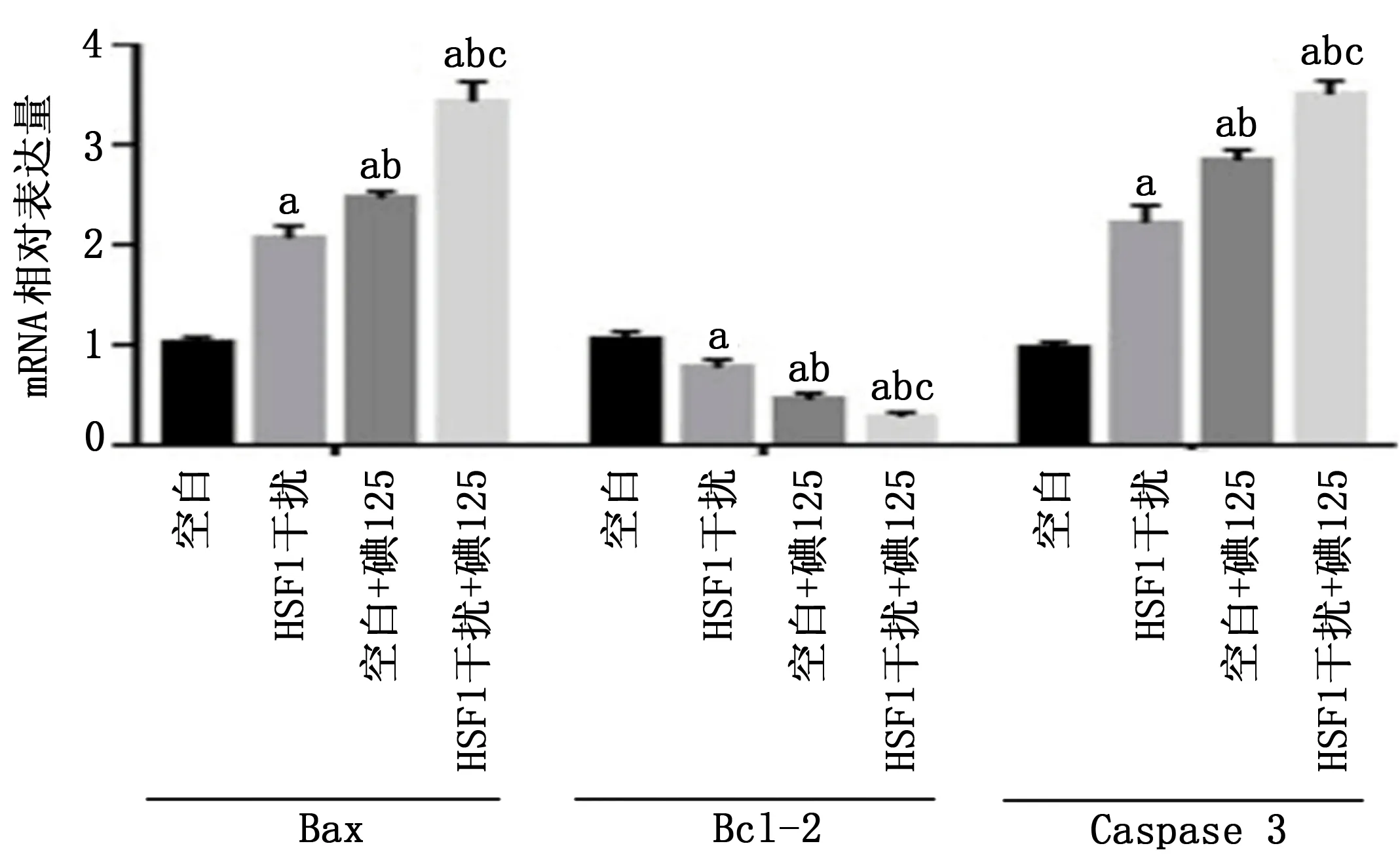
注:a為與空白細胞組比較,P<0.05;b為與ShRNA-HSF1組比較,P<0.05;c為與空白細胞+碘125組比較,P<0.05。
2.6 ShRNA-HSF1對凋亡相關基因Bcl2、Bax和Caspase 3蛋白表達的影響
在自然生長條件下,與空白細胞組相比,ShRNA-HSF1能抑制Bcl2蛋白的表達,經碘125粒子放療后,Bcl2蛋白表達降低,ShRNA-HSF1進一步促進Bcl2蛋白表達降低。在自然生長條件下,與空白細胞組相比,ShRNA-HSF1能促進Bax蛋白的表達,經碘125粒子放療后,Bax蛋白表達升高,ShRNA-HSF1進一步促進Bax蛋白表達升高。在自然生長條件下,與空白對照組相比,ShRNA-HSF1能促進Caspase 3蛋白的表達,經碘125粒子放療后,Caspase 3蛋白表達升高,ShRNA-HSF1進一步促進Caspase 3蛋白表達升高(圖3)。

注:a為與空白細胞組比較,P<0.05;b為與ShRNA-HSF1組比較,P<0.05;c為與空白細胞+碘125組比較,P<0.05。
3 討論
胰腺癌是目前全球第七大癌癥死亡原因。完全手術切除可顯著延長生存期,但腫瘤通常在晚期才被診斷出來,因此只有一小部分患者適合手術治療。由于其發病位置隱匿、早期癥狀不明顯、無特異性標志物、影像學技術對較小的病變診斷率低,惡性程度高、手術僅能切除早期較小的腫瘤,中期及晚期的患者往往失去了手術機會,化療、介入治療和放療是主要治療方案[4]。由于體外放療副反應大,部分患者難以接受,故碘125粒子植入內放療成為了倍受重視的治療方案。碘125粒子可向腫瘤組織釋放 γ 射線破壞腫瘤細胞細胞膜、破壞DNA雙鏈結構從而殺滅或抑制腫瘤細胞生長、抑制腫瘤細胞增殖、促使凋亡和自噬而起到治療作用,具有低劑量率、持續性電離輻射、半衰期長(59.6天)、對腫瘤局部照射劑量高、而對周圍正常組織照射劑量低等優點[5]。胰腺癌的放療后殘留和復發與多種因素有關,如腫瘤的分期、大小、侵犯范圍、病理類型有關,但胰腺癌細胞對放射線的抵抗亦是重要因素。而這種抵抗是通過對損傷的腫瘤細胞 DNA 進行修復實現的。放射線導致細胞 DNA 損傷,此時腫瘤細胞可以激活多種蛋白來修復損傷的 DNA,從而使腫瘤細胞存活下來,放療停止后,腫瘤細胞可以再次增殖導致復發[6]。
在哺乳動物中,HSF1是這一古老轉錄程序的主要調節因子。在蛋白質毒性損傷時,熱休克反應/熱休克蛋白反應(HSR/HPSR)對蛋白質組內穩態或蛋白質平衡至關重要,從而抵抗應激和拮抗蛋白質錯誤折疊疾病和衰老,而在腫瘤細胞中HSR/HPSR具有意想不到的促癌作用。HSF1在沒有壓力的情況下會潛伏在原代細胞中,但在惡性細胞中會被激活。HSR/HPSR作為致癌網絡的一個組成部分,幾個控制HSF1通過環境應激源激活的關鍵途徑與惡性腫瘤有因果關系。重要的是,HSF1對癌癥蛋白質組有系統的影響,包括維持或促進腫瘤發生、促進腫瘤發生和惡性轉化、維持蛋白穩態和阻礙細胞凋亡。多項證據表明,過表達HSF1可促進癌的發展,抑制HSF是一種有希望的抗腫瘤策略[7-10]。因此,HSF1被認為是一種有希望的癌癥治療候選靶點,而能夠通過調節HSF1表達來激發抗癌活性的策略最近引起了人們的極大興趣[11]。
本課題組前期工作發現,HSF1在胰腺癌中表達升高[12],為了進一步探討HSF1對胰腺癌放療效果的影響,本研究構建了RNA干擾HSF1胰腺癌細胞株,并構建裸鼠胰腺癌移植瘤模型,采用碘125放療,結果發現,與空白細胞組比較,ShRNA-HSF1組的體積增量比和瘤重顯著性降低,抑瘤率和凋亡指數顯著性升高。提示HSF1能促進腫瘤生長、參與 DNA 的損傷修復和放療抵抗,干擾HSF1更容易受到放射線損傷。
在癌細胞中,促凋亡蛋白(如Bax、Bak及Bad等)、抗凋亡蛋白(如Bcl-2、Bcl-xL及 Bcl-w 等)和凋亡調控因子(Caspase家族等)等相互調控誘導細胞有序性死亡[13]。通常情況下,在胞外死亡信號刺激下,細胞膜表面的死亡受體激活,促使線粒體釋放細胞色素 C 至胞漿,與Caspase 9和凋亡酶激活因子 1(Apaf-1)等形成凋亡小體,進一步在三磷酸腺苷的作用下 Caspase 9 酶切并激活Caspase 3,從而介導細胞凋亡的死亡受體途徑及線粒體途徑并激活其他Caspase成員,啟動激酶級聯反應,從而促進細胞凋亡[14]。Bax和 Bcl-2 是作用互為拮抗作用的凋亡調控蛋白。正常情況下,Bax和 Bcl-2以適當比例存在,調節細胞的基本生理過程,在放療狀態下,二者的比例發生變化。 Bax 表達增多,形成的Bax/Bax 同二聚體明顯增多,使線粒體膜通透性增加,細胞色素 C 釋放增多,激活 Caspase 家族蛋白[15]。本研究結果發現,在自然生長條件下,ShRNA-HSF1能抑制Bcl2蛋白的表達,而促進Bax和Caspase 3蛋白的表達,經碘125粒子放療后,Bcl2蛋白表達降低,而Bax和Caspase 3蛋白表達升高,ShRNA-HSF1進一步促進Bcl2蛋白表達降低,而進一步促進Bax和Caspase 3蛋白表達升高。由于胰腺癌的發病機制及治療機制非常復雜,HSF1其對胰腺癌致病相關基因表達的影響,及其怎樣調控放療抵抗的進一步機制,尚需以后的實驗進一步研究。
綜上所述,RNA干擾HSF1能抑制胰腺癌移植瘤的生長,碘125粒子能誘導胰腺癌移植瘤凋亡,沉默HSF1能通過抑制 Bcl2 mRNA和蛋白、促進Bax和Caspase 3 mRNA和蛋白的表達而促進碘125放療胰腺癌移植瘤的敏感性。

