多模式鎮(zhèn)痛對坐骨神經(jīng)慢性收縮損傷大鼠背根神經(jīng)節(jié)的作用及機制*
李斐, 楊曉惠, 遲曉慧, 候俊德, 陳永學, 陳娟**
(1.邯鄲市中心醫(yī)院 麻醉科, 河北 邯鄲 056008; 2.邯鄲市第一醫(yī)院 麻醉科, 河北 邯鄲 056004)
外周神經(jīng)性疼痛可能是由于神經(jīng)損傷或影響體感神經(jīng)系統(tǒng)外周成分的疾病引起[1]。外周神經(jīng)細胞體是位于背根神經(jīng)節(jié)(dorsal root ganglion,DRG)中的小纖維,可釋放P物質(zhì)、降鈣素基因相關(guān)肽或谷氨酸等神經(jīng)遞質(zhì),這些有害的感覺信息從外周組織傳遞到脊髓[2]。研究表明血管緊張素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)及其衍生物和醛固酮通過與感覺神經(jīng)纖維或中樞神經(jīng)系統(tǒng)表達的受體相互作用,在調(diào)節(jié)痛覺中發(fā)揮作用[3]。AngⅡ是腎素-血管緊張素系統(tǒng)的主要成分,參與控制血壓和水液穩(wěn)態(tài),但也參與其他功能,包括神經(jīng)系統(tǒng)的其他功能[4]。在藥物開發(fā)過程中,研究人員發(fā)現(xiàn)存在2種血管緊張素受體,包括血管緊張素1型受體(angiotensin type 1 receptor,AT1 receptor)和AT2 receptor[5-7]。研究表明,AngⅡ可以在組織局部產(chǎn)生,參與傷害性傳遞,并且AT2 receptor拮抗劑具有鎮(zhèn)痛特性[8];AngⅡ可刺激T細胞增殖,增加CD3+T細胞浸潤[9]。神經(jīng)性疼痛作為一種慢性病,可引起痛苦并嚴重影響患者的生活質(zhì)量,這種情況常規(guī)治療是難以治愈的[10]。由于外周神經(jīng)性疼痛的病因、癥狀和潛在機制的影響,有效藥物獲批數(shù)量少且臨床療效有限,至少45%的神經(jīng)病理性疼痛患者同時接受2種或多種藥物治療[11]。多模式鎮(zhèn)痛是將具有不同藥理作用機制的藥物聯(lián)合使用以期望產(chǎn)生更大的療效,并且更有可能調(diào)節(jié)多種疼痛機制,旨在通過共同給藥以緩解疼痛[12]。多模式鎮(zhèn)痛用于坐骨神經(jīng)阻滯具有諸多優(yōu)點[13],但是對坐骨神經(jīng)慢性收縮損傷(chronic contractile injury of sciatic nerve,CCI)的影響機制尚不明確。因此,本研究探討多模式鎮(zhèn)痛對CCI大鼠DRG的作用和機制,現(xiàn)將結(jié)果報告如下。
1 材料與方法
1.1 實驗材料
1.1.1大鼠來源 雄性Sprague Dawley(SD)大鼠(中科院上海實驗動物中心)30只,體質(zhì)量200~225 g;按5只/組飼養(yǎng)于實底聚丙烯籠中,室內(nèi)溫度(22±2)°,空氣濕度為(55±15)%,照明控制為12 h光照和1 2h黑暗的循環(huán)。大鼠可隨意獲取飼料和水。
1.1.2主要藥物和試劑 曲唑酮和加巴噴丁、0.05% Tween 20、正常山羊血清、牛血清白蛋白、小鼠抗大鼠AngⅡ單克隆抗體(1 ∶200)、小鼠抗大鼠單克隆特異性結(jié)合分化簇3(specific binding differentiation cluster 3,CD3)抗體(1 ∶100)、小鼠抗大鼠Alexa Flour 633單克隆抗體(1 ∶500)、小鼠抗大鼠抗生物素蛋白(deglycosylated avidin,Cy3)單克隆抗體(1 ∶800)、蛋白酶抑制劑混合物、小鼠抗大鼠細胞外信號調(diào)節(jié)激酶1/2(extracellular signal-regulated kinase 1/2,p44/p42 MAPK)單克隆抗體(1 ∶1 000,美國Sigma公司),戊巴比妥、4%多聚甲醛(上海碧云天公司),小鼠抗大鼠CD3單克隆抗體(1 ∶100,美國Abcam公司),Bradford法試劑盒、0.45 μm Immobilon-FL PVDF膜(美國Millipore公司),小鼠抗大鼠β肌動蛋白單克隆(1 ∶10 000)及IRDye?二抗(1 ∶8 000,美國Invitrogen公司),HaltTM磷酸酶抑制劑混合物和聚丙烯酰胺凝膠(澳大利亞賽默飛世爾公司)。
1.1.3主要儀器 Randall-Selitto痛覺測試儀(香港友誠生物科技有限公司),-80 ℃冰箱(日本松下公司),Axiocam MRm相機(北京榮興光恒科技有限公司),Axioskop 40顯微鏡(上海五久自動化設(shè)備有限公司),Odyssey?CLx 成像系統(tǒng)(美國Li-Cor公司)。
1.2 實驗方法
1.2.1實驗分組及處理 30只SD大鼠隨機均分為對照組(n=10)、模型組(n=10)及多模式鎮(zhèn)痛組(n=10)。對照組大鼠行坐骨神經(jīng)手術(shù)假手術(shù)處理(坐骨神經(jīng)暴露但未結(jié)扎),并注射0.9%生理鹽水;模型組大鼠行CCI術(shù),3%異氟醚深度麻醉,于右側(cè)髖骨下方切開1個平行于坐骨神經(jīng)的切口,暴露坐骨神經(jīng),將3個結(jié)扎線(0~3絲線)松散地綁在坐骨切跡遠端的神經(jīng)周圍,間距為1 mm,直到觀察到后肢出現(xiàn)短暫抽搐;多模式鎮(zhèn)痛組大鼠行CCI術(shù),采用管飼法(曲唑酮)和腹腔注射(加巴噴丁)行多模式鎮(zhèn)痛給藥處理,其中曲唑酮和加巴噴丁分別溶解于0.9%NaCl。每只大鼠接受皮下芐青霉素60 mg作為抗生素預防;手術(shù)當天視為第0天,從術(shù)后第1天開始連續(xù)給藥,1次/d,持續(xù)14 d。
1.2.2大鼠挖洞和筑巢試驗 手術(shù)后第14天給藥后1 h,對各組大鼠進行挖洞測試,挖洞性能表示為管中剩余的礫石量;筑巢能力采用5級評分法評估各組大鼠的挖土重量和筑巢能力,分別將床上用品沒有明顯接觸、被褥部分撕裂、墊料大多被撕碎但通常沒有可識別的巢穴、可識別但平坦的巢及完美或接近完美的巢定義為1、2、3、4及5分。
1.2.3疼痛閾值 采用Randall-Selitto痛覺測試儀(意大利UGO公司)分別于手術(shù)后第3天、第7天和第14天檢測各組大鼠的疼痛閾值,以測試針頭施加增加的壓力(20~500 g/s),直到大鼠掙扎或尖叫,當大鼠爪子縮回時候的針頭壓力作為大鼠的疼痛閾值,以克(g)為單位[14]。
1.2.4腰椎DRG制備 取手術(shù)后第14天的“1.2.1”項下各組大鼠給藥后1 h,采用過量戊巴比妥麻醉處死大鼠,行椎板切除術(shù),取同側(cè)腰椎(L4-L6)DRG,用于后續(xù)免疫組織化學(immunohistochemisty,IHC)染色和蛋白質(zhì)印跡(Western blot)研究。
1.2.5IHC染色檢測CD3+T細胞、AngⅡ/AT2 receptor蛋白、NGF及受體表達 取“1.2.4”項下多模式鎮(zhèn)痛組大鼠的腰椎DRG切片于IHC染色前風干,含0.05% Tween 20的PBS洗滌2次、10 min/次;切片置于10%正常山羊血清(normal goat serum,NGS)或5%牛血清白蛋白(bovine albumin,BSA)的封閉緩沖液中孵育1~2 h、與一抗孵育20 h、與相應(yīng)的二抗于室溫下孵育1 h;4′,6-二脒基-2-苯基吲哚二鹽酸鹽染色,ProLong?Gold抗褪色試劑封片;對苯二甲酸丁二醇酯(polybutylene terephthalate,PBST)清洗2次、10 min/次。為鑒定同側(cè)腰椎DRG切片中Ang Ⅱ的細胞定位,使用這些標記物CD3和神經(jīng)膠質(zhì)纖維酸性蛋白的同步免疫染色,一抗包括小鼠抗大鼠AngⅡ單克隆抗體(1 ∶200);小鼠抗大鼠CD3單克隆抗體(1 ∶100);小鼠抗大鼠CD3單克隆抗體(1 ∶100);抗體均在含2%NGS或BSA封閉緩沖液的PBST中適當稀釋;Axiocam MRm相機的Axioskop 40顯微鏡于固定曝光時間對切片進行成像。
1.2.6蛋白質(zhì)印跡分析檢測DRG中P-p38 MAPK和P-p44/p42 MAPK蛋白表達 檢測時間點為第14天,取“1.2.4”項下各組大鼠的同側(cè)腰椎DRG(L4-L6)于冰上勻漿,放射免疫沉淀(radioimunoprecipitation assay,RIPA)緩沖液提取蛋白質(zhì)。緩沖液是通過溶解10 mmol Tris 制備,緩沖液還添加了1%HaltTM磷酸酶抑制劑混合物和蛋白酶抑制劑混合物,用 Bradford 方法測定蛋白質(zhì)濃度;從每個提取物中,總蛋白30 μg加載到4%~20%Mini-PROTEAN?TGX Stain-FreeTM 預制聚丙烯酰胺凝膠上;轉(zhuǎn)移至0.45 μm Immobilon-FL PVDF膜,OdysseyTM 封閉緩沖液中孵育1 h(磷酸化特異性抗體的封閉緩沖液包含 5%BSA和0.1%Tween-20);將膜與小鼠抗大鼠神經(jīng)生長因子(nerve growth factor,NGF)單克隆抗體(1 ∶500,H-20)、小鼠抗大鼠酩氨酸激酶受體單克隆抗體(muscarine kinase receptor,TrkA;1 ∶500)、小鼠抗大鼠磷酸-p38 MAPK(phosphoric acid-p38 MAPK,P-p38 MAPK;1 ∶1 000)單克隆抗體、小鼠抗大鼠磷酸-p44/pp42 MAPK(phosphate - p44 / pp42 MAPK,P-p44 / pp42 MAPK;1 ∶1 000)單克隆抗體及小鼠抗大鼠p42/p44 MAPK(phosphate - p42/p44 MAPK,ERK1/2;1 ∶1 000)單克隆抗體,小鼠抗大鼠β肌動蛋白單克隆抗體(1 ∶10 000)為加載對照;PBST洗滌3次、5 min/次,將膜在適當?shù)腎RDye?二抗(1 ∶8 000)于室溫孵育1 h;Odyssey?CLx 成像系統(tǒng)顯示膜。
1.3 統(tǒng)計學分析
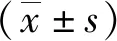
2 結(jié)果
2.1 挖洞筑巢試驗
挖洞筑巢試驗結(jié)果顯示(表1),模型組大鼠挖土重量和筑巢能力得分分別較對照組和多模式鎮(zhèn)痛組降低,差異有統(tǒng)計學意義(P<0.05);與模型組比較,多模式鎮(zhèn)痛組大鼠挖土重量和筑巢能力得分升高,差異有統(tǒng)計學意義(P<0.05)。
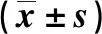
表1 各組大鼠挖土重量和筑巢能力Tab.1 Digging weight and nesting ability of
2.2 疼痛閾值
疼痛閾值實驗結(jié)果顯示(表2),多模式鎮(zhèn)痛組和模型組大鼠手術(shù)后第3天和第7天的疼痛閾值分別較對照組降低,差異均有統(tǒng)計學意義(P<0.05);模型組大鼠手術(shù)后第14天的疼痛閾值較對照組降低,且多模式鎮(zhèn)痛組>模型組,差異均有統(tǒng)計學意義(P<0.05)。
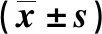
表2 各組大鼠的疼痛閾值Tab.2 Pain threshold of rats in each
2.3 DRG中CD3+T細胞的表達
CD3+T細胞檢測結(jié)果顯示,模型組和多模式鎮(zhèn)痛組大鼠DGF中表達AngⅡ的CD3+ T細胞和未表達AngⅡCD3+T細胞數(shù)量均較對照組增多,且模型組>多模式鎮(zhèn)痛組,差異均有統(tǒng)計學意義(P<0.05)。見圖1和表3。

注:綠色表示CD3+T細胞。圖1 各組大鼠DRG中CD3+T細胞的表達(免疫熒光染色,×200)Fig.1 Expression of CD3+T cells in DRG of rats in each group (immunofluorescence staining , ×200)
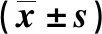
表3 各組大鼠DRG中CD3+T細胞的定量表達Tab.3 Quantitative analysis of CD3+T cells by immunofluorescence staining
2.4 DRG中NGF及受體的表達
檢測結(jié)果顯示(表4),模型組和多模式鎮(zhèn)痛組大鼠DRG中TrkA蛋白表達分別較對照組降低,且模型組>多模式鎮(zhèn)痛組,差異均有統(tǒng)計學意義(P<0.05);模型組和多模式鎮(zhèn)痛組大鼠DRG中前體-NGF蛋白和成熟-NGF蛋白表達分別較對照組降低,且多模式鎮(zhèn)痛組>模型組,差異均有統(tǒng)計學意義(P<0.05)。
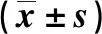
表4 各組大鼠DRG中NGF及受體的表達Tab.4 Expression of NGF and receptor in DRG of rats in each group
2.5 AngⅡ/AT2 receptor蛋白的表達
檢測結(jié)果顯示,模型組和多模式鎮(zhèn)痛組大鼠DRG中AngⅡ和AT2 receptor的蛋白表達較對照組升高,差異有統(tǒng)計學意義(P<0.05);多模式鎮(zhèn)痛組大鼠DRG中AngⅡ和AT2 receptor 蛋白表達較模型組降低,差異有統(tǒng)計學意義(P<0.05)。見表5和圖2。

圖2 各組大鼠DRG中AngⅡ和AT2 receptor蛋白的表達Fig.2 Expression of AngⅡ and AT2 protein in DRG of rats in each group
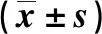
表5 各組大鼠DRG中AngⅡ和AT2 receptor蛋白的表達Tab.5 Expression of AngⅡ and AT2 receptor protein in DRG of rats in each
2.6 P-p38 MAPK和P-p44/p42 MAPK蛋白的表達
結(jié)果顯示(表6),模型組和多模式鎮(zhèn)痛組大鼠DRG中P-p38 MAPK和P-p44/p42 MAPK的蛋白表達較對照組升高,差異有統(tǒng)計學意義(P<0.05);多模式鎮(zhèn)痛組大鼠DRG中P-p38 MAPK和P-p44/p42 MAPK的蛋白表達較模型組降低,差異有統(tǒng)計學意義(P<0.05)。見圖3和表6。

圖3 各組大鼠DRG中P-p38 MAPK和P-p44/p42 MAPK蛋白的表達Fig.3 The expression of P-p38 MAPK and P-p44/p42 MAPK protein in DRG of rats in each group
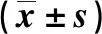
表6 各組大鼠DRG中P-p38 MAPK和P-p44/p42 MAPK蛋白的表達Tab.6 Expression of P-p38 MAPK and P-p44/p42 MAPK protein in DRG of rats in each
3 討論
在臨床環(huán)境中,多種鎮(zhèn)痛/麻醉技術(shù)作為“平衡麻醉”共同給藥,以獲得更好的麻醉質(zhì)量并減少術(shù)中和術(shù)后疼痛[15]。因為疼痛是一個涉及多個致敏過程的動態(tài)過程,在不同的手術(shù)類型中變化很大,個人對疼痛的敏感性、心理認知差異和個體藥理反應(yīng)都混淆了最終的鎮(zhèn)痛效果,即使在研究中組合方案相同,顯示出的效果不相同。加巴噴丁是一種抗驚厥藥,最初注冊用于治療癲癇,最近被批準用于某些神經(jīng)性疼痛形式[16-18]。
本研究表明,通過坐骨神經(jīng)術(shù)建立的大鼠外周神經(jīng)損傷模型中,其同側(cè)腰椎DRG中Ang Ⅱ的表達和CD3+ T細胞的數(shù)量增加;通過管飼曲唑酮和腹腔注射加巴噴丁后逆轉(zhuǎn)了Ang Ⅱ和CD3+ T細胞的增加。研究證明,外周免疫細胞(T細胞)會浸潤到,在CCI大鼠的腰椎DRG中有大量外周免疫細胞(T細胞)浸潤[19-22]。
本研究結(jié)果表明,與對照組大鼠相比,多模式鎮(zhèn)痛組大鼠腰椎DRG中NGF的前體和成熟亞型的表達水平降低,模型大鼠腰椎DRG中成熟NGF的表達降低可能是由于前NGF的成熟缺陷所致。模型組大鼠腰椎DRG中TrkA蛋白表達上調(diào),TrkA是CCI大鼠腰椎DRG中NGF的高親和力受體,CCI大鼠中TrkA的表達降低,這表明增強的Ang Ⅱ/AT2 receptor信號與NGF/TrkA通路之間存在潛在的串擾[23-25],即與單獨使用Ang Ⅱ或NGF相比,與NGF共刺激后,Ang Ⅱ誘導的ERK(p44/p42)磷酸化激活降低[26-28]。
本研究還顯示,在模型大鼠中P-p38 MAPK和P-p44/p42 MAPK顯著增加,這表明將培養(yǎng)的大鼠DRG神經(jīng)元與Ang Ⅱ孵育30 min可顯著增加P-p38 MAPK和P-p44/p42 MAPK的免疫熒光,而多模式鎮(zhèn)痛逆轉(zhuǎn)了P-p38 MAPK和P-p44/p42 MAPK的上調(diào);Ang Ⅱ和AT2 receptor不僅由腰椎DRG中的感覺神經(jīng)元表達,CD3+ T在內(nèi)的非神經(jīng)元細胞也能表達。這表明,阻斷這些表達Ang Ⅱ以及AT2 receptor的免疫細胞的自分泌和旁分泌激活可減少CCI同側(cè)腰椎DRG中的CD3+ T細胞的浸潤[29]。
綜上所述,多模式鎮(zhèn)痛通過抑制CCI大鼠腰椎DRG中Ang Ⅱ/AT2 receptor信號級聯(lián)反應(yīng)及MAPK信號通路的激活,減少了CD3+ T細胞向大鼠腰椎DRG的浸潤,從而緩解大鼠外周神經(jīng)損傷。

