宮頸癌-肺癌雙原發腫瘤并胃轉移一例
陳梅,張昱,李冬梅,張文靜,3
1.昆明理工大學醫學院,云南 昆明 650500;2.云南省第一人民醫院昆明理工大學附屬醫院消化內科,云南 昆明 650032;3.云南省第一人民醫院昆明理工大學附屬醫院腫瘤內科,云南 昆明 650032
肺癌和宮頸癌是女性常見惡性腫瘤,同時患有上述兩者腫瘤的患者比較少見。肺癌和宮頸癌常見轉移部位是局部和遠處淋巴結、骨、肺、肝和腦,胃腸道轉移罕見。現報道一例宮頸癌和肺癌雙原發腫瘤并胃轉移患者的診治過程,并結合國內外文獻對該病例進行回顧性分析,以提高臨床醫生對肺癌胃轉移和肺癌宮頸癌雙原發腫瘤的認識和警覺性。
1 病例簡介
患者,女,44歲,因“不規則陰道流血1個月余”于2019年9月2日就診于云南省第一人民醫院腫瘤內科。現病史:陰道流血量約5 mL/d,余無特殊不適。既往體健,無吸煙、飲酒史,無腫瘤家族史及遺傳史。查體:生命體征平穩,淺表淋巴結無腫大,心肺未見異常,腹平軟,無壓痛及反跳痛,未捫及包塊,肝脾未觸及,雙下肢無浮腫。2019年9月3日盆腔CT:子宮頸前后壁明顯增厚強化,密度不均,最大層面約1.1 cm×2.5 cm,考慮為宮頸癌可能。雙側腹股溝多發淋巴結明顯、增大,左側為甚;腹膜后多發淋巴結明顯;盆壁散在淋巴結明顯,多考慮為轉移可能性大。頭胸及腹部CT未見明顯異常。宮頸取材活檢病理示:鱗狀細胞癌。2019年9月4日開始予白蛋白紫杉醇單周化療同步放療(GTV 55 Gy/25Fx,2.2 Gy/Fx;PTV 50 Gy/25Fx,2 Gy/Fx)。后至外院行后裝治療(具體不詳)。2019年11月13日、12月5日分別行兩個周期TP方案鞏固化療(紫杉醇210 mg,奈達鉑120 mg),出現2度骨髓抑制和1級消化道反應。
2020年12月患者開始出現胸悶、氣促并進行性加重,胸部CT提示:左肺門結構不清,左下肺門周圍見軟組織影,伴左肺上、下葉見滲出、實變病灶,考慮阻塞性肺炎。縱隔、兩側腋窩淋巴結增大,考慮轉移;左側胸膜腔積液。子宮頸擴張,邊緣毛糙,增強掃描不均勻強化,盆底筋膜增厚、毛糙,見少許滲出;雙側腹股溝、雙側盆壁、腹膜后多發淋巴結明顯。2020年12月21日氣管鏡示(圖1A~1F):左肺下葉支氣管不規則腫物突起,管腔狹窄;隆突處可見結節狀突起。取材活檢示(圖1G~1J):(左下葉支氣管)惡性細胞,免疫組化支持非角化型鱗狀細胞癌;P40(+),P63(+),細胞角蛋白7(cytokeratin 7,CK7)(+),甲狀腺轉錄因子-1(thyroid transcription factor-1,TTF-1)(-),天冬氨酸蛋白酶A(aspartic acid protease A,NapsinA)(-),抗原Ki-67(antigen Ki-67,ki-67):+,約60%。結合病史及CT影像學特點,臨床考慮為肺及宮頸雙原發癌。2021年1月11日、2月22日分別予2個周期TP方案化療(紫杉醇230 mg,奈達鉑130 mg),并行胸部病灶及淋巴引流區放療30次(CTV 60 Gy/30Fx,2 Gy/Fx;PGTV 60 Gy/30Fx,2 Gy/Fx)。后未規律返院。

圖1 纖維支氣管鏡檢查及活組織免疫組化
2021年5月患者無明顯誘因出現聲嘶,伴吞咽困難、嘔吐,遂再次入院。完善胃鏡檢查示:胃體多發黏膜下隆起性病變,考慮轉移可能(圖2A~2D),取材活檢示(圖2E~2H):(胃體中段大彎側)咬檢組織,免疫組化結果結合臨床病史支持為轉移性非角化型鱗狀細胞癌;廣譜細胞角蛋白(pan cytokeratin,PCK)(+),CK5/6(+),P40(+),P63(+),低分子細胞角蛋白(low cytokeratin,LCK)(-),癌 胚 抗 原(carcinoembryonic antigen,CEA)(-),人類表皮生長因子受體-2(human epidermal growth factor receptor 2,HER-2)(-)。5月19日復查CT提示:右肺及左肺上葉轉移可能,左肺上葉、右肺下葉背段為新發病灶,頸部、縱隔、腋窩淋巴結轉移,較前增大,左腎上腺軟組織影,右腎上腺結合部低密度影,轉移可能,左腎前間隙結節狀軟組織密度影,直徑2 cm,較前為新發病灶,考慮轉移。肝門區、胃脾韌帶、系膜間、腹膜后、盆腔、右側腹股溝淋巴結顯示,部分增大,轉移可能。子宮頸囊狀影,復發可能。部分胸腰椎椎體、附件、右側部分肋骨、左側肩胛骨崗、左側髂骨、右側頂骨多發骨質破壞,考慮骨轉移,較前為新發。結合臨床表現及檢查結果(圖3),患者考慮為惡性腫瘤廣泛進展,子宮病灶療效評價:疾病穩定(stable disease,SD),肺部病灶部分疾病緩解(partial response,PR)、部分疾病進展(progression disease,PD),多處淋巴結和左腎上腺病灶PD、多發骨轉移灶PD,總體療效評價PD。詳細溝通病情,建議行后線姑息化療,患者及家屬放棄繼續診治后自動出院。
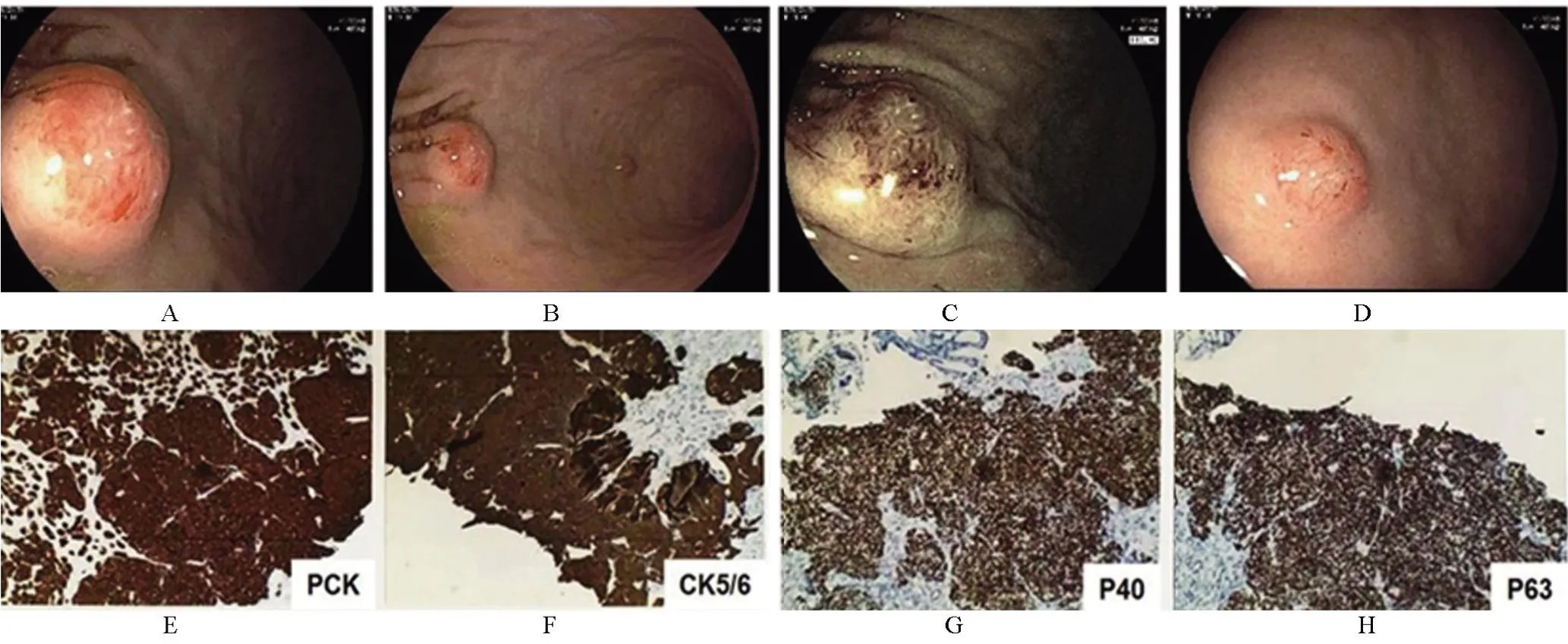
圖2 胃鏡檢查及活組織免疫組化
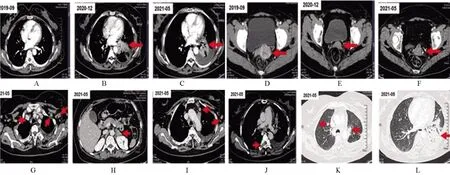
圖3 動態復查CT結果
2 討論
臨床上,惡性腫瘤侵犯胃的病例較為多見,但發生胃轉移者相對少見。歐洲數據顯示,胃轉移癌的原發灶以黑色素瘤、乳腺癌、肺癌居多,美國以肺癌、腸癌居多,日本以肺癌、乳腺癌、食管癌居多[1]。臨床上胃轉移癌診斷困難,原因主要在于:其一,胃腸道轉移患者臨床表現缺乏特異性,難以與消化系統良性疾病相鑒別,尤其開始化療后,臨床醫生多考慮為化療所致的消化道反應而忽略;其二,PET-CT、增強CT對空腔臟器的診斷陽性率不高[2]。本案例為子宮和肺雙原發惡性腫瘤患者,經治后腫瘤廣泛進展,并發現胃多發轉移。結合既往關于胃轉移癌的文獻報道及該患者發病順序及診治史,因此本例患者考慮為肺癌致胃轉移。
肺癌胃腸道轉移發生率為0.19%~5.1%[3];尸檢數據可增高至4.7%~14.0%[4]。文獻對發生胃腸道轉移的原發腫瘤組織病理學類型報道不一,有研究認為鱗狀細胞癌是發生胃轉移最常見的轉移亞型[5],但也有報道認為原發性肺腺癌更為常見,其次是鱗狀細胞癌、小細胞肺癌和多形性癌[6]。肺癌胃腸轉移的機制有三:除了常見的淋巴轉移和血行轉移以外,通過吞咽富含癌細胞的痰液導致種植轉移可能是其第三種途徑,且這種現象在吸煙者受到胃黏膜損傷的情況下更容易發生[7]。免疫組化是目前區分原發性和轉移性胃癌的最可靠方法。常用的肺腺癌標志物為TTF-1、CK7、Napsin A,而p63、CK5/6、CK34βE12/CK903多在肺鱗癌中呈陽性表達[8]。本例患者胃活檢組織免疫組化為p63、CK5/6、PCK、P40陽性,支持鱗癌來源,結合臨床病史,考慮為肺癌胃轉移。
肺癌胃轉移患者預后差,初始診斷后的平均生存時間約3個月[9],與晚期肺癌治療原則一致,全身化療、靶向治療和免疫治療是肺癌胃轉移患者目前最重要、最常見的方法。對于肺癌驅動基因陽性患者,靶向治療為最佳治療手段;驅動基因陰性患者可行全身化療聯合/或免疫治療(根據PD-L1表達水平決定)。然而,有報道指出少數患者化療后出現腫瘤細胞大量壞死,導致胃出血或穿孔[10]。因此,治療方案的選擇需根據患者個體化情況制定,全面評估和衡量利弊,并與患者和家屬充分溝通。對于胃出血或穿孔高危人群來說,姑息性手術后再行化療可能會獲得更有利的結果[11]。AOKAGE等[12]曾報道,兩例接受胃次全切除術的肺多形性癌胃轉移患者未接受任何輔助治療,但生存時間已超過4年。NEMOTO等[3]曾報道一例肺癌胃轉移術后接受免疫治療的患者獲得了1年的生存期。但由于病例數較少,積極手術對患者的長期獲益仍需進一步探索。
本文病例除了為胃轉移癌少見以外,同時還是宮頸癌和肺癌雙原發腫瘤患者,該情況臨床亦為少見。該患者宮頸癌和肺癌病理類型均為鱗癌,免疫組化標記物類似,但結合異時性發病(確診宮頸癌后16個月出現肺部腫瘤)和CT影像學特點,考慮為宮頸癌和肺癌雙原發腫瘤。鑒于紫杉醇類聯合鉑類藥物化療為子宮和肺鱗癌的標準治療方案,給予該患者TP方案聯合放療,但治療結束后3個月即出現了胃轉移,并出現骨及全身多處淋巴結轉移,患者及家屬拒絕治療而出院。
綜上所述,肺癌胃轉移是一種少見的轉移性癌;宮頸癌和肺癌雙原發也較為罕見,其診斷主要依賴于胃鏡活檢病理組織學檢查、原發腫瘤病史,以及雙原發腫瘤發病間隔時間、影像學特點等。對于有胃腸道癥狀的惡性腫瘤患者,需警惕原發性和繼發性胃腸癌的可能性,以提供精準的臨床診斷和治療。

