小反芻獸疫基因工程疫苗的研究進展
郗珊珊,賈偉娟,秦瑤,楚秋娟,李文博,何云江,孟慶磊,陳云嬌,王學理
(1. 內蒙古民族大學動物科技學院,內蒙古 通遼 028000;2. 內蒙古良欣農牧業開發有限公司,內蒙古 赤峰 024000;3. 巴林左旗科技創新和成果轉化中心,內蒙古 赤峰 024000 )
小反芻獸疫(Peste des petits ruminants,PPR)又稱“羊瘟”,是由小反芻獸疫病毒(Peste des petits ruminants virus, PPRV)引起的一種危害嚴重的山羊、綿羊和野生小反芻獸高度接觸性傳染病。PPRV 屬于副黏病毒科(Paramyxoviridae)麻疹病毒屬(Morbillivirus),同屬的成員還包括牛瘟病毒(Rinderpest virus, RPV)、犬瘟熱病毒(Canine distemper vieus, CDV)、海豹瘟病毒(Porpoise distemper virus, PDV)及麻疹病毒(Measles virus,MV)等。PPRV 基因組全長15 948 nt,病毒粒子大多數呈圓形或橢圓形,直徑為130 ~ 390 nm,有囊膜包裹,主要包含N、P、M、F、H、L 六種結構蛋白和C、V 兩種非結構蛋白[1-3],其結構、復制周期及各蛋白功能分別如圖1、圖2、表1 所示。

表1 小反芻獸疫病毒編碼蛋白
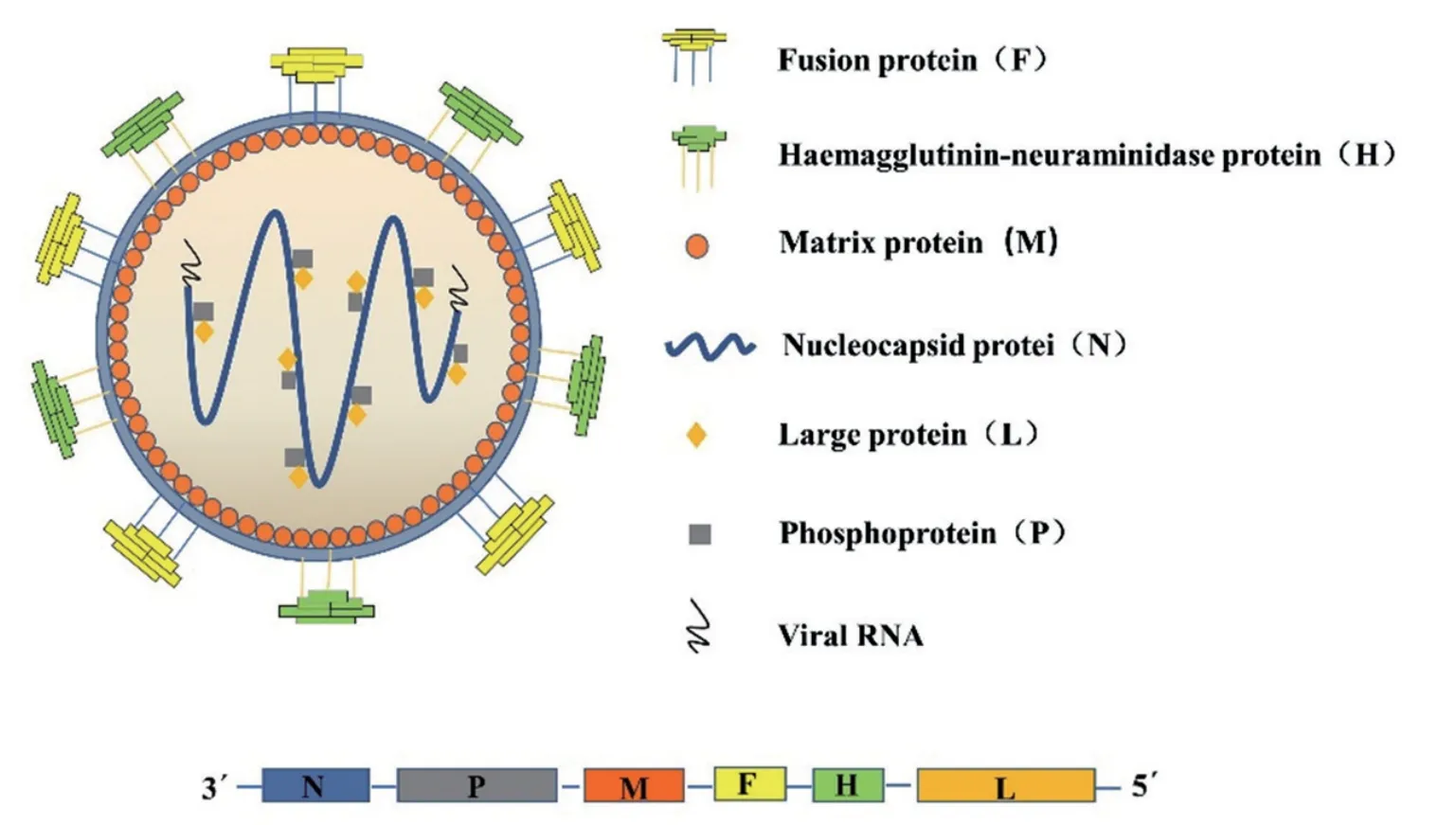
圖1 PPRV 結構示意圖[15]
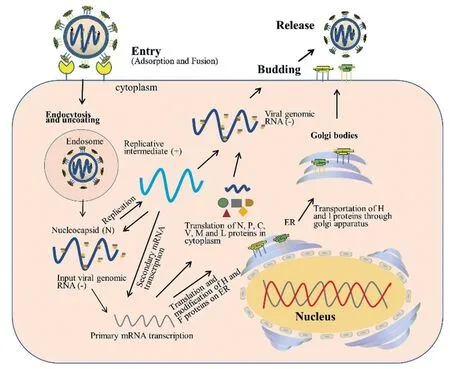
圖2 PPRV 復制周期[16]
根據流行病學調查發現,PPRV 只有一個血清型,可分為4 個系,Ⅰ系主要分布在西非,Ⅱ系在尼日利亞、喀麥隆北部等地大量分布,Ⅲ系主要分布在非洲東部,Ⅳ系主要在中東和西亞地區流行。1942年PPR 首次發現于西非的科特迪瓦,之后擴散到阿拉伯半島、中東、南亞等地,2007年傳入我國西藏阿里地區,2013年后新疆、甘肅、內蒙古等地陸續有該病的報道[4,5]。2015—2019年間,66 國向世界動物衛生組織(World Organization for Animal Health,OIE)報告了12 757 起疫情,亞洲和中東9 582 起,占75.1%;非洲3 166 起,占24.8%;歐洲(保加利亞)9 起,占0.1%。其中貝寧(480 起)、阿富汗(824 起)、伊朗(3 710 起)、科威特(761 起)和土耳其(402 起)這五個國家的PPR 疫情占比48.4%,迫切需要加強對PPR 的預防和控制[6]。PPRV 的潛伏期為2~7 d,以高熱、口腔黏膜糜爛、眼部分泌物增加、白細胞數量減少、腹瀉和呼吸困難為特征。通常在出現發熱癥狀后的4 ~ 6 d 內迅速死亡,有著高發病率(可達100%)和高死亡率(可達90%)。該發病特點給PPRV 的臨床預防、診斷和治療帶來了嚴峻的挑戰,OIE 和糧食及農業組織(Food and Agriculture Organization,FAO)計劃將在2030年前徹底消除PPR[7,8]。
目前該病主要靠疫苗免疫進行預防,科研人員已研發出Nigeria 75/1、Sungri/96、Arasur/87 和Coimbatore/97 四種PPR 同源弱毒苗[9],其中以Nigeria 75/1 和Sungri/96 應用最為廣泛,可對四種譜系的PPRV 產生良好的保護性免疫[10-13]。但是這種疫苗還不能達到區分疫苗毒株和野毒株感染(differentiation of infected versus vaccinated animals, DIVA)以及安全高效的效果,因此新型疫苗的研發顯得尤為重要[14]。隨著生命科學研究的不斷發展,基因工程苗研究也隨之成熟,并且有著與弱毒疫苗相似的效果,有望進行大規模應用。
1 重組亞單位疫苗
F 蛋白和H 蛋白是PPRV 囊膜表面的兩種糖蛋白,均可誘發保護性免疫應答,其中H 蛋白相較F 蛋白能產生更高水平的中和抗體,是宿主免疫應答的主要靶點,因此H 蛋白是目前PPR 亞單位疫苗和重組活載體疫苗的主要免疫性抗原[24]。在研究中可將表達H 和F 蛋白的桿狀病毒用作亞單位疫苗的抗原,它們能引起強烈的中和抗體反應,卻不能對強毒株提供免疫保護,但將桿狀病毒表達的H 蛋白嵌入免疫刺激復合物(ISCOMs)中,就可對強毒攻擊起到較好的保護作用[25]。其中ISCOM 能誘導細胞介導的免疫反應,因此該反應可能是誘導針對PPRV 的保護性免疫反應的主要因素。
目前已有多種原核和真核表達系統用于制備病毒樣顆粒(virus-like particle, VLP),VLP 僅由PPRV 衣殼蛋白組成,缺乏感染性基因組,其結構模擬親本病毒粒子的構象和組織,卻不能在細胞內進行自我復制[26]。桿狀病毒是昆蟲的主要病原體,研究者構建了重組桿狀病毒來共表達PPRV-H、N 和M 蛋白,可使昆蟲細胞膜上的VLP出芽增殖,同時發現這些VLP 還可在小鼠體內誘導大量的病毒特異性中和抗體,這表明基于VLP制成的疫苗具有抗PPRV 的潛力[27,28]。有研究發現,僅M 蛋白的表達就足以組裝和釋放PPRV的VLP,單獨通過F 蛋白的表達也可支持低水平的VLP 裝配,但在不存在M 的情況下未觀察到VLP 的釋放,進一步突顯了M 蛋白作為結構蛋白在VLP 裝配和釋放中的關鍵作用[23]。
利用桿狀病毒在昆蟲細胞中表達VLP 已被證明是疫苗研發的有效策略,Engerix-B,Porcilis和Cervarix 等基于VLP 的疫苗已經獲得商業化許可。基于VLP 制成的疫苗,通常是利用病毒疫苗株序列構建的,然而,由于某些結構蛋白翻譯后糖基化修飾的改變和遺傳物質的缺乏,衍生自疫苗株的VLP 的免疫原性并不總是最佳,需要通過測定進行判斷。Yan 等[29]利用桿狀病毒對PPRVM、H 和F 蛋白表達后,產生了兩種PPRV VLP 候選毒株,分別來自Ⅳ系Tibet/30 毒株和Ⅱ系Nigeria 75/1 疫苗株;使用這些VLP 來免疫小鼠、山羊和綿羊,二次免疫后發現兩種PPRV 的VLP 都能夠在小鼠、山羊和綿羊體內引發體液免疫和細胞免疫反應,與Nigeria 75/1 VLP 相比,Tibet/30毒株的VLP 表現出更大的免疫原性。以上研究表明兩種PPRV VLP 都是控制和根除PPR 的合適候選疫苗株,而Tibet/30 VLP 由于具有更大的免疫原性而成為最有前途的候選疫苗株。
2 活載體疫苗
2.1 痘病毒載體
痘病毒因其基因組容量大、含有大量的非必需基因、可載入大片段的外源基因而被廣泛應用于構建基因載體病毒疫苗。孫一瑞等[30]利用egfp報告基因和gpt篩選基因篩選純化了包含PPRV H 基因的重組綿羊痘病毒(Sheeppox virus,SPV),將其經皮內注射105.5TCID50免疫綿羊,結果顯示該疫苗能夠誘導綿羊產生高滴度的抗PPRV 特異性中和抗體,抗體陽轉率達100%,并且外源H 基因的插入并未影響親本病毒的復制,為研究PPR 新型痘病毒重組疫苗的研制提供了理論依據。Chen 等[31]研究制備了表達PPRV H和F 蛋白的重組羊痘病毒(Capripoxvirus,CPV)rCPV-PPRV-H 和rCPV-PPRV-F,發現相比于rCPV-PPRV-F,rCPV-PPRV-H 能誘導更強的PPRV 中和抗體,首次免疫rCPV-PPRV-H 后,羊群的血清轉化率大于80%,6 個月后進行二次接種,免疫效果更強,可保護山羊免受強毒株攻擊。Chandran 等[32]利用安卡拉病毒(MVA)構建了兩種重組痘病毒MVA-F 和MVA-H,用105空斑形成單位(pfu)的MVA-F 和MVA-H 通過肌肉注射免疫山羊,結果顯示,該疫苗安全性較好,未出現不良反應,即使是免疫4 個月后的山羊依然具有抵抗PPRV 攻擊的能力。痘病毒載體疫苗盡管被發現具有相對的熱穩定性,但并沒有激活最佳的抗體反應,此外,使用痘病毒載體重組疫苗時疫苗接種員的安全性也不容忽略。
2.2 腺病毒載體
腺病毒載體疫苗能誘導T 細胞產生強烈的免疫反應,這種T 細胞反應通常是模擬了病原體誘導的保護性反應,最常用的為人5 型腺病毒(Ad 5)[33]。Ad 5 被認為是一種較好的用于小型反芻動物的重組載體,由于動物對該種載體缺乏先天免疫力,因此可達到更好的免疫效果。
研究發現將PPRV-H 和F 基因插入腺病毒載體構建的Ad-H 和Ad-F 疫苗,對山羊進行單獨免疫和聯合免疫,均可誘導高效抗體和細胞介導免疫應答,但Ad-H 和Ad-F 聯合使用比Ad-H或Ad-F 單獨使用誘導的保護效果更好[34,35]。Holzer 等[36]為了確定表達PPRV-H、F 蛋白的Ad制成疫苗的最低劑量,對東非PPR 常發國家肯尼亞的山羊展開了研究,發現僅需107pfu 的Ad-H或108pfu 的Ad-F 就可保護機體不受野生型PPRV 的攻擊,同時還發現由108pfu(Ad-H+Ad-F)組成的疫苗可能對山羊提供無菌保護,并且聯合使用Ad-H 和Ad-F 比單獨使用Ad-H 具有更強的保護作用。Rojas 等[37]檢測到,在接種重組Ad 5 疫苗和感染PPRV 后觸發的CD4+和CD8+T細胞反應十分相似,在PPRV 強毒株攻擊下可激活Ad 5-F 和Ad 5-H 疫苗誘導的CD4+、CD8+T 記憶細胞分化。這些研究表明使用表達PPRV 基因的重組腺病毒疫苗可在機體受到PPRV 攻擊后,誘導T 細胞大量增殖起到保護作用。
有研究者對表達PPRV-F 和H 蛋白的重組雞痘病毒與Ad 5 載體疫苗進行了免疫效果比較,發現Ad 5 載體疫苗誘導了更高水平的病毒特異性抗體和中和抗體,并激發了更多數量的CD8+T細胞,同時還發現,無論是否添加集落刺激因子或綿羊白細胞介素-2(IL-2),Ad-H 均能在免疫4個月后誘導山羊產生較強的抗體和細胞免疫,并能完全保護山羊免受PPRV 強毒株的攻擊[38,39]。重組腺病毒載體疫苗具有高度免疫原性,可誘導先天性和適應性免疫,是能夠區別自然感染動物與疫苗接種感染動物的疫苗。
3 核酸疫苗
PPR 核酸疫苗是將編碼PPRV 抗原的基因制成疫苗,再接種到動物體內使之可在機體內進行表達,并誘導機體產生抗體,從而起到免疫的效果。核酸苗接種后與自然免疫相似,不存在毒力返強和散毒的風險,是由于在激發機體細胞免疫的同時還激發了體液免疫。Wang 等2013年構建了一種基于西門利克森林病毒(SFV)復制子的自殺DNA 疫苗,并測試了其在小鼠體內誘導免疫原性的能力,首先將克隆的PPRV H 基因插入SFV復制子載體pSCA1 中,再將pSCA1-H 質粒轉染到BHK-21 細胞中,最后通過Western blot 來檢測表達蛋白的抗原性。將pSCA1-H 質粒通過肌肉注射入BALB/c 小鼠體內,共注射3 次,每次間隔兩周,檢測結果表明pSCA1-H 可在BHK-21 細胞中表達H 蛋白,并且可在小鼠體內誘導特異性抗體、中和抗體和淋巴細胞增殖反應[40];2015年又利用同樣的方法對表達PPRV-F 基因構建的pSCA1-F 質粒的抗原性進行了測試,結果表明pSCA1-F 也可在小鼠體內誘導同樣的反應,并且pSCA1-F 在初次免疫小鼠24 h 后,白細胞介素(IL-2、IL-10)含量不斷升高,干擾素(IFN-γ)和腫瘤壞死因子(TNF-α)也從此時開始上升,之后逐漸下降,這種自殺性DNA 疫苗為PPR 新型疫苗的研發提供了新思路[41]。由此可見核酸苗具有同時引起細胞免疫和體液免疫的特性,還具有抗體產生制備周期短、效價高、儲存條件簡單等優點。
4 反向遺傳學技術重組苗
反向遺傳學技術可從遺傳上改變病毒RNA組成,用于添加標記基因(陽性標記疫苗)或刪除抗原成分(陰性標記疫苗),利用這種方法操控PPRV 基因組來引入特異性突變位點,從而為疫苗的研發提供了一種新的思路[42]。有研究者為了從血清學上區分野毒株和疫苗毒株,利用反向遺傳技術建立了帶有綠色熒光蛋白(GFP)標記的PPRV 重組疫苗,同時還構建了表達PPRV-H 和F 基因的山羊痘病毒(Goatpox virus,GPV)活載體苗,這種情況下只需要對PPRV-H 或F 基因進行檢測就可有效區分疫苗株和野毒株,如果在注射過疫苗的動物體中檢測到H 或F 蛋白的抗體,那么證明其感染毒株為野毒株,反之則證明為免疫毒株感染,注射此種疫苗可同時預防PPRV 和SPV 的感染[43]。Muniraju 等[44]通過反向遺傳學技術,利用PPRV Nigeria 75/1 疫苗株研發了一種rPPRV-C77 重組苗,注射山羊后沒有表現出任何不良反應,但是,該疫苗在PPRV 血凝素(H)包膜糖蛋白上缺乏C77 單克隆抗體的結合位點,對此需要進行更深入的研究。使用反向遺傳學方法研發的疫苗的一個潛在問題是,標記蛋白可能會被整合到病毒的包膜中,因此可能會改變宿主的趨向性和致病性。
各疫苗優缺點具體見表2。

表2 幾種疫苗的優缺點
5 展望
動物在接種疫苗后由于接種時間、接種部位、母源抗體及疫苗配制時間等原因會造成不同的免疫效果[45]。經研究發現,90 日齡以上的羊群免疫后抗體合格率和抗體水平最高,具有母源抗體的羔羊100 日齡為最佳免疫時間;頸部皮下注射優于肌肉注射,但兩者均能獲得一定水平的免疫效果。魯立柱等[46]對初免21 d 后羊群進行了第二次免疫,同時監測不同時間血清中抗體濃度,結果顯示,初免21 d 抗體滴度平均可達5.18±2.87;二次免疫后3、7、14、21 d 平均滴度分別為5.65±2.56、6.95±1.82、7.28±1.18、8.12±1.31,呈上升趨勢,試驗表明,對已經有PPR 抗體的羊進行二次免疫可增強免疫效果。嚴斯剛等[47]為測試PPRV 疫苗配置后不同時間接種的免疫效果,將疫苗配置后1、1~2、2~3、5~6 h 分別免疫本地山羊,并在接種后當天和30、120 d 分別測定抗體水平,結果顯示前三組在30 d 和120 d 抗體阻斷率均在85%以上,表明稀釋后的疫苗在3 h 內用完均有良好的免疫效果。
由于內蒙古地區得天獨厚的生態環境和我國畜牧業經濟的發展,蒙東地區肉羊產業發展迅猛,個別養殖企業由于飼養管理體系、防疫體系不健全導致一些羊源病毒性疾病頻繁發生,給個體養殖戶及大型養殖場均造成了一定的經濟損失。但到目前為止,還未研發出一種各方面都完美的疫苗,其中應用最廣泛的傳統弱毒苗和滅活苗無法將接種疫苗的動物與自然感染的動物區分開來,而基因工程苗有實現這一目標的可能。減毒活疫苗免疫效果好卻不耐熱,需要健全的冷鏈運輸系統送到現場,故還需要研發一種熱穩定性疫苗,但技術及基因工程苗在研發上還存在一些問題,需要更深入的探索。此外,還應研發氣霧劑、滴眼液疫苗,為大規模免疫提供方便。防止病毒傳播所需的群體免疫水平為80%,然而,阻止PPR 有效傳播所需的確切群體免疫水平需要進一步研究。綜上所述,新興的PPR 基因工程疫苗和減毒活疫苗在實驗室研究中取得了飛躍性進展,為臨床應用奠定了基礎,但研制安全高效的疫苗仍存在很多問題,如病毒的易變異性、保護性抗原的不確定性、活載體的不穩定性、免疫效果的評價指標不健全等,這將導致未來PPR 疫苗的發展仍然艱辛。

