金藤清痹顆粒通過調(diào)節(jié)免疫微環(huán)境對類風濕關節(jié)炎大鼠的干預作用
唐今揚 周彩云王鑫馬芳潘崢 韓淑花李斌 杜麗妍程國良 房定亞?
(1.中國中醫(yī)科學院西苑醫(yī)院風濕病科, 北京100091; 2.中藥制藥共性技術國家重點實驗室, 山東 臨沂276000)
類風濕關節(jié)炎是一種累及周圍關節(jié)為主的炎癥性自身免疫病,影響全球0.5%~1.0%人口[1],我國大陸地區(qū)發(fā)病率為0.42%[2],是造成人群喪失勞動力和致殘的主要病因之一。類風濕關節(jié)炎的發(fā)病機制涉及多種免疫活性細胞、細胞因子、炎癥介質(zhì)等信號傳導途徑的激活,是一個多因素參與、多通路累及的過程[3?4]。金藤清痹顆粒是中藥六類新藥,具有清熱解毒、活血消腫、通痹止痛等功效,主治類風濕關節(jié)炎活動期,具有抗炎、止痛、解熱和免疫調(diào)節(jié)作用[5]。臨床研究表明,金藤清痹顆粒可以明顯改善活動期類風濕關節(jié)炎患者的臨床癥狀、體征以及各項生化指標,療效確切[6?8],但其作用機制目前尚不明確。本實驗擬通過注射牛Ⅱ型膠原和弗氏不完全佐劑建立膠原誘導型關節(jié)炎(CIA)大鼠模型,評價金藤清痹顆粒對類風濕關節(jié)炎的作用,并探索其對于免疫微環(huán)境的影響,從而為金藤清痹顆粒治療類風濕關節(jié)炎提供實驗基礎。
1 材料與方法
1.1 動物 清潔級Wistar 大鼠,雌雄各半,9 周齡,體質(zhì)量(200±20)g,購自上海杰思捷實驗動物有限公司,實驗動物生產(chǎn)許可證號SCXK(滬)2018?0004。大鼠飼養(yǎng)環(huán)境為室溫20~24 ℃,普通飼料喂養(yǎng),自由飲水和進食,適應性喂養(yǎng)7 d 后開始實驗。
1.2 試劑與藥物 金藤清痹顆粒(國藥準字Z20123065,批號28180031,魯南厚普制藥有限公司)。弗氏不完全佐劑、蘇木素(貨號F5506、H9627,美 國Sigma 司);牛Ⅱ型膠原(批號20021,美 國 Chondrex公司);TRIzol(貨號252250AX,北京艾德萊生物科技有限公司);HiScript Reverse Transcriptase(RNase H)、SYBR Green Master Mix(貨號R101?01/02、Q111?02,南京諾唯贊生物科技股份有限公司);磷酸酶抑制劑、RIPA 裂解液(貨號S1873、BP0013,上海碧云天生物技術有限公司);胞漿胞核蛋白提取試劑盒(貨號KGP150,江蘇凱基生物技術股份有限公司);GAPDH 抗體(貨號AB?P?R 001,杭州賢至生物科技有限公司);LaminB 抗體、HRP 標記羊抗兔二抗(貨號BA1228、BA1054,武漢博士德生物工程有限公司);IκBα 抗體(貨號Bs?1287r,天津速徠生物科技有限公司);p?IκBα(SER32)抗體(貨號2859,美國Cell Signaling Technology 公司);IKKβ 抗體(貨號AF6009,美國Affinity 公司);p65抗體、TLR4抗體(貨號10745?1?AP、19811?1?AP,武漢三鷹生物技術有限公司);ECL底物液(貨號P1050,北京普利萊基因技術有限公司);FITC ANTI?RAT CD4(貨號201505,美國BioLegend 公司);ANTI?MO/RT IL?17A PE(貨號12?7177?81,美國Invitrogen 公司);伊紅Y(水溶性)(貨號71014544,國藥集團化學試劑有限公司)。無水乙醇、二甲苯(貨號 10009218、010023418,國藥集團化學試劑有限公司)。
1.3 儀器 Scientific 8000 型CO2培養(yǎng)箱、ABI7500型實時熒光定量PCR儀,購自美國Thermo Fisher公司;BH2 型熒光顯微鏡,購自日本Olympus 公司;FACSVerse 型流式細胞儀,購自美國BD 公司;imark 酶標儀、電泳儀,購自美國Bio?Rad 公司。
1.4 類風濕關節(jié)炎模型建立 在無菌條件下,利用均質(zhì)儀將牛Ⅱ型膠原和弗氏不完全佐劑按1∶1比例(體積比)充分乳化,形成膠原乳劑,牛Ⅱ型膠原的終質(zhì)量濃度為1 mg/mL。每只大鼠于尾根部、背部多點皮內(nèi)注射0.3 mL 膠原乳劑,正常組大鼠在相同部位注射等體積溶劑,建立膠原誘導型關節(jié)炎(CIA)模型,第7 天后,按照原方法于大鼠尾根部注射0.2 mL 膠原乳劑進行加強免疫1次,正常組注射等體積溶劑,共造模14 d,關節(jié)炎指數(shù)(AI)評分≥4 分視為造模成功。
1.5 分組及給藥 將造模成功的大鼠隨機分為模型組、甲氨蝶呤組、雷公藤多苷組及金藤清痹顆粒低、中、高劑量組,每組10只,另以10 只正常大鼠為正常組。金藤清痹顆粒低、中、高劑量組灌胃給予1.05、2.1、4.2 g/kg 金藤清痹顆粒溶液(0.9%氯化鈉注射液配制),每天3 次;甲氨蝶呤組灌胃給予0.8 mg/kg 甲氨蝶呤片,每4 d 給藥1次,其余時間灌胃給予等量0.9% 氯化鈉注射液;雷公藤多苷組灌胃給予7.875 mg/kg 雷公藤多苷片,該劑量分3 次給予;模型組和正常組灌胃給予等量0.9% 氯化鈉注射液,連續(xù)給藥4 周(15~42 d)。各組存活大鼠均隨機選取6 只進行后續(xù)檢測。
1.6 大鼠四肢關節(jié)腫脹變化的測定 于第0、7、14、21、28、35、42 天檢測各組大鼠左后肢關節(jié)腫脹足底厚度,腫脹度=[(dt-d0)/d0] ×100%,其中d0為造模前的足底厚度,dt為造模后的足底厚度。
1.7 關節(jié)炎指數(shù) 于第0、7、14、21、28、35、42 天對每只大鼠進行關節(jié)炎指數(shù)評分,標準為0分,足底厚度無關節(jié)炎;1分,輕微癥狀,但踝關節(jié)或腕出現(xiàn)紅腫等現(xiàn)象;2分,踝關節(jié)或腕中度紅腫現(xiàn)象;3分,整個爪包括趾(指)在內(nèi)都嚴重紅腫;4分,關節(jié)嚴重腫脹并伴有功能障礙。大鼠四肢分別所得的評分累加起來,即為每只大鼠的關節(jié)炎指數(shù)。
1.8 免疫組化染色檢測巨噬細胞 給藥4 周后(42 d),取大鼠膝關節(jié)滑膜組織,經(jīng)脫水、浸蠟、包埋后切片。組織切片脫蠟后放入0.01 mol/L 枸櫞酸緩沖液中,采用電陶爐加熱對切片進行抗原修復,3%過氧化氫室溫孵育15 min,正常山羊血清室溫封閉30 min,加入一抗后4 ℃濕盒中孵育過夜,PBS 沖洗切片后滴加HRP 標記的山羊抗兔二抗,室溫孵育20 min,按試劑盒說明書進行顯色,復染,梯度乙醇脫水,中性樹膠封片,顯微鏡下觀察并采集圖像。
1.9 流式細胞術檢測Th17、Treg 細胞比例 給藥4 周后(42 d),大鼠腹股溝動脈取血,Percoll 非連續(xù)性密度梯度離心法獲得外周血單核細胞,加入20 ng/mL 丙二醇甲醚醋酸酯、1 μg/mL 鈣離子載體、2 μmol/L 蛋白轉運抑制劑,37 ℃、5% CO2培養(yǎng)箱孵育5 h,PBS 洗滌后重懸,加入一抗(CD4?FITC、CD25?APC)4 ℃避光孵育30 min,加入Fix/Perm Buffer 4 ℃孵育50 min,加入Perm/Wash Buffer 清洗后重懸,加入一抗(FOXP3?PE)4 ℃避光孵育30 min,離心后PBS 重懸,流式儀上機檢測。
1.10 HE 觀察膝關節(jié)滑膜組織病理變化 取“1.8”項下切片,經(jīng)二甲苯和梯度乙醇脫蠟后,放入蘇木素染液中染色5 min,自來水沖洗,放入1%鹽酸乙醇中分化2~5 s,自來水沖洗,放入1%伊紅染液中染色1 min,自來水沖洗30 s,再經(jīng)梯度乙醇和二甲苯脫水,中性樹膠封片,顯微鏡下觀察。從每個高倍視野觀察的炎性細胞浸潤、滑膜組織增生、纖維組織增生3 個方面病理表現(xiàn)進行綜合評判。評分標準為①炎細胞浸潤,無炎性細胞浸潤為0 分;少于20 個為1 分;20~50 個為2 分;大于50 個為3 分。②纖維組織增生,無纖維組織增生為0 分;平均增生少于0.2 個為1 分;0.2~0.4個為2 分;大于0.4 個為3 分。③滑膜細胞增生,滑膜細胞扁平,數(shù)量不多為0 分;滑膜細胞腫脹,密集單層排列為1 分;滑膜細胞腫脹,密集2 層排列為2 分;滑膜細胞腫脹,密集3 層以上排列為3 分。
1.11 Western blot 法檢測膝關節(jié)滑膜組織TLR4、IKKβ、p?IκBα、IκBα、p65 蛋白表達 取大鼠膝關節(jié)滑膜組織,使用RIPA 裂解液(含蛋白酶抑制劑和磷酸酶抑制劑)裂解組織提取蛋白,BCA 試劑盒測定蛋白濃度,SDS?PAGE 凝膠電泳分離蛋白后轉移到PVDF 膜上,經(jīng)封閉液封閉后使用TLR4、IKKβ、p?IκBα、IκBα、p65 一抗孵育,然后使用HRP 結合二抗孵育,最后通過ECL 發(fā)光液顯影并拍照。細胞核p65 蛋白以Lamin B1 為內(nèi)參,其余蛋白以GAPDH 為內(nèi)參,通過分析條帶灰度值,計算目的蛋白相對表達量。
1.12 RT?qPCR 法檢測膝關節(jié)滑膜組織TLR4、IKKβmRNA 表達 取大鼠膝關節(jié)滑膜組織,使用TRIzol 試劑從組織中提取總RNA,紫外分光光度計檢測總RNA 濃度,將RNA 逆轉錄為cDNA,通過ABI 實時熒光定量PCR 儀進行RT?qPCR 實驗,以GAPDH為內(nèi)參,采用2-ΔΔCT法計算TLR4、IKKβ相對mRNA 表達。引物由北京擎科生物科技有限公司合成,TLR4 正向序列5′?TGGTGGCTGTGGAGAC AAAAATGAC?3′,反向序列5′?CTGAAAGGCTTGG GCTTGAATGGAG?3′;IKKβ正向序列5′?CAGAATC CTGACCTGGTCTCGC?3′,反向序列5′?CACAGTCA TCGTAGGGCAACTCATC?3′;GAPDH正向序列5′?ACAGCAACAGGGTGGTGGAC?3′,反向序列5′?TTT GAGGGTGCAGCGAACTT?3′。
1.13 統(tǒng)計學分析 通過SPSS 20.0 軟件進行處理,計量資料以()表示,多組間比較采用方差分析,組間多重比較采用LSD 檢驗;計數(shù)資料采用卡方(χ2)檢驗。P<0.05 為差異有統(tǒng)計學意義。
2 結果
2.1 金藤清痹顆粒對CIA 大鼠左后肢腫脹的影響 如圖1、表1 所示,7、14、21、28、35、42 d時,與正常組比較,模型組大鼠左后肢腫脹度增加(P<0.01);21、28 d時,與模型組比較,金藤清痹顆粒高劑量組、甲氨蝶呤組和雷公藤多苷組大鼠左后肢腫脹度降低(P<0.05,P<0.01);35、42 d時,與模型組比較,各給藥組大鼠左后肢腫脹度均降低(P<0.05,P<0.01)。

圖1 各組大鼠左后肢腫脹情況Fig.1 Left hind limbs swelling in rats of each group
表1 各組大鼠左后肢腫脹度比較(%,,n=10)Tab.1 Comparison of left hind limb swelling degree in rats of each group(%,,n=10)

表1 各組大鼠左后肢腫脹度比較(%,,n=10)Tab.1 Comparison of left hind limb swelling degree in rats of each group(%,,n=10)
注:與正常組比較,??P<0.01;與模型組比較,#P<0.05,##P<0.01。
2.2 金藤清痹顆粒對CIA 大鼠左后肢關節(jié)炎指數(shù)的影響 如表2 所示,與模型組比較,21 d時,金藤清痹顆粒高劑量組和雷公藤多苷組大鼠左后肢關節(jié)炎指數(shù)降低(P<0.05,P<0.01);28、35、42 d時,各給藥組大鼠左后肢關節(jié)炎指數(shù)均降低(P<0.05,P<0.01)。
表2 各組大鼠左后肢關節(jié)炎指數(shù)比較(分,,n=10)Tab.2 Comparison of arthritis severity scale of left hind limb in rats of each group(score,,n=10)
表2 各組大鼠左后肢關節(jié)炎指數(shù)比較(分,,n=10)Tab.2 Comparison of arthritis severity scale of left hind limb in rats of each group(score,,n=10)
注:與模型組比較,#P<0.05,##P<0.01。
2.3 金藤清痹顆粒對大鼠膝關節(jié)滑膜組織病理形態(tài)的影響 如圖2 所示,正常組大鼠滑膜細胞無明顯增生現(xiàn)象,未見炎性細胞浸潤,無血管翳形成;與正常組比較,模型組大鼠滑膜細胞腫脹,密集排列,滑膜細胞增生明顯,細胞間隙可見大量炎性細胞浸潤,滑膜組織有大量血管增生;與模型組比較,金藤清痹顆粒低劑量組大鼠滑膜細胞增生有所下降,有明顯血管增生和炎性細胞浸潤,而金藤清痹顆粒中、高劑量組及甲氨蝶呤組、雷公藤多苷組大鼠滑膜細胞增生有較大程度下降,細胞間可見少量炎性細胞浸潤,纖維組織增生不顯著,滑膜組織中有少量血管增生。如表3 所示,與模型組比較,各給藥組大鼠膝關節(jié)滑膜病理損傷評分均降低(P<0.01),且金藤清痹顆粒的作用呈劑量依賴性。
表3 各組大鼠膝關節(jié)滑膜病理損傷評分比較(分,,n=6)Tab.3 Comparison of pathological damage score of rat knee joint synovium of each group(score,,n=6)

表3 各組大鼠膝關節(jié)滑膜病理損傷評分比較(分,,n=6)Tab.3 Comparison of pathological damage score of rat knee joint synovium of each group(score,,n=6)
注:與正常組比較,??P<0.01;與模型組比較,##P<0.01。
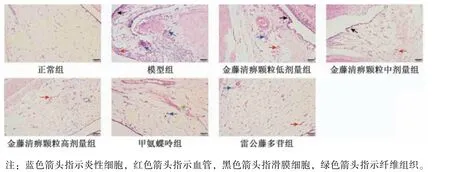
圖2 各組大鼠膝關節(jié)滑膜組織病理形態(tài)(HE,×200)Fig.2 Pathological morphology of rat knee synovial tissue of each group(HE,×200)
2.4 金藤清痹顆粒對大鼠膝關節(jié)滑膜組織巨噬細胞表達的影響 CD68 為巨噬細胞表面分子,巨噬細胞分為M1 型和M2型,CD86 為M1 型巨噬細胞標記物,CD206 為M2 型巨噬細胞標記物。如圖3~5、表4 所示,與正常組比較,模型組大鼠滑膜組織CD68、CD86 表達升高(P<0.01),CD206 表達降低(P<0.01);與模型組比較,各給藥組大鼠滑膜組織CD68、CD86 表達降低(P<0.05,P<0.01),CD206 表達升高(P<0.01),且金藤清痹顆粒的作用呈劑量依賴性。
表4 各組大鼠滑膜組織CD68、CD86、CD206 表達比較(,n=6)Tab.4 Comparison of CD68,CD86 and CD206 expressions in rat synovial tissues of each group(,n=6)
表4 各組大鼠滑膜組織CD68、CD86、CD206 表達比較(,n=6)Tab.4 Comparison of CD68,CD86 and CD206 expressions in rat synovial tissues of each group(,n=6)
注:與正常組比較,??P<0.01;與模型組比較,#P<0.05,##P<0.01。

圖3 各組大鼠滑膜組織CD68 免疫組化染色圖(×400)Fig.3 Immunohistochemical staining of CD68 in rat synovial tissue of each group(×400)
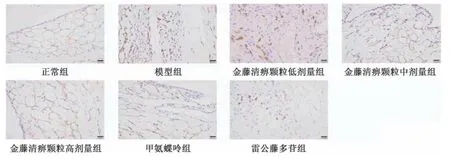
圖4 各組大鼠滑膜組織CD86 免疫組化染色圖(×400)Fig.4 Immunohistochemical staining of CD86 in rat synovial tissue of each group(×400)
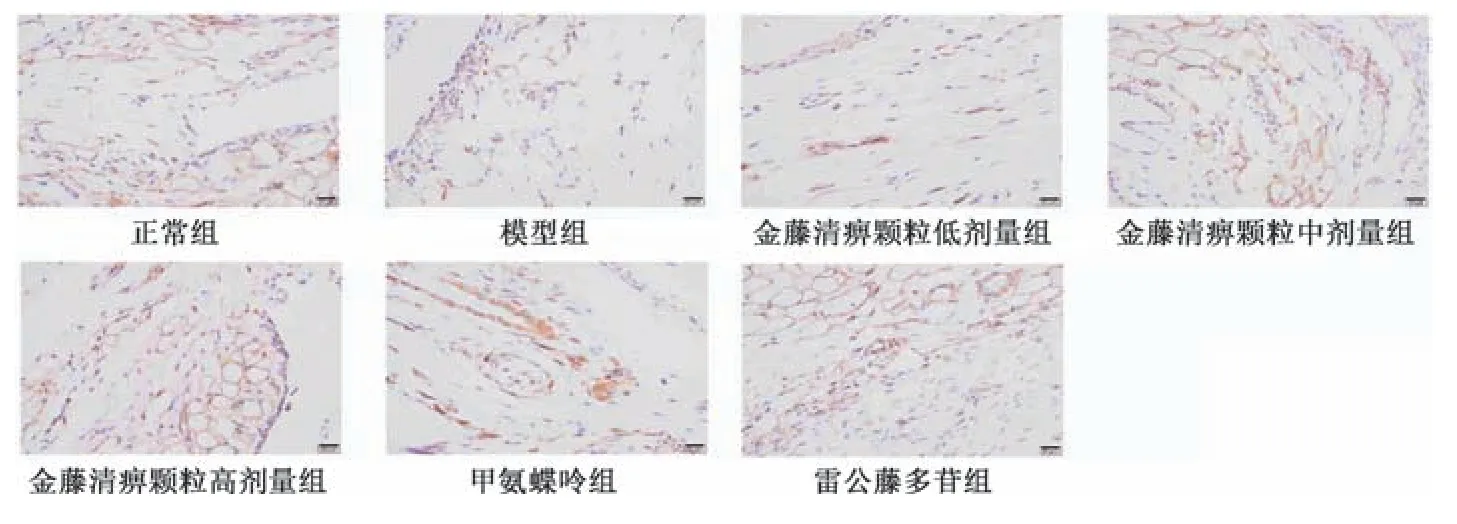
圖5 各組大鼠滑膜組織CD206 免疫組化染色圖(×400)Fig.5 Immunohistochemical staining of CD206 in rat synovial tissue of each group(×400)
2.5 金藤清痹顆粒對大鼠外周血Th17、Treg 細胞比例的影響 如圖6~7、表5 所示,與正常組比較,模型組大鼠外周血Th17 細胞比例、Th17/Treg比例升高(P<0.01),Treg 細胞比例降低(P<0.01);與模型組比較,各給藥組大鼠外周血Th17 細胞比例、Th17/Treg 比例降低(P<0.01),Treg 細胞比例升高(P<0.05,P<0.01),且金藤清痹顆粒的作用呈劑量依賴性。結果表明,造模后大鼠Th17/Treg 比例升高,促進炎癥的發(fā)生;金藤清痹顆粒、甲氨蝶呤和雷公藤多苷均能改善大鼠Th17/Treg 比例,抑制炎癥反應,且高劑量金藤清痹顆粒作用優(yōu)于低、中劑量。

圖6 各組大鼠外周血中Th17 細胞比例Fig.6 Proportions of Th17 cells in rat peripheral blood of each group
表5 各組大鼠外周血中Th17、Treg 細胞比例比較(,n=6)Tab.5 Comparison of the proportions of Th17 and Treg cells in rat peripheral blood of each group(,n=6)
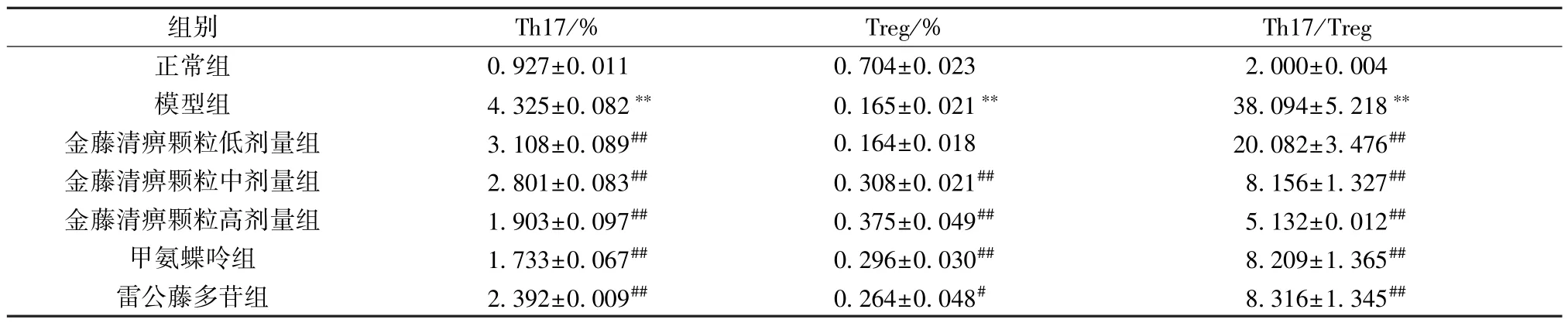
表5 各組大鼠外周血中Th17、Treg 細胞比例比較(,n=6)Tab.5 Comparison of the proportions of Th17 and Treg cells in rat peripheral blood of each group(,n=6)
注:與正常組比較,??P<0.01;與模型組比較,#P<0.05,##P<0.01。

圖7 各組大鼠外周血中Treg 細胞比例Fig.7 Proportions of Tregs in rat peripheral blood of each group
2.6 金藤清痹顆粒對大鼠膝關節(jié)滑膜組織TLR4/NF?κB 信號通路相關蛋白表達的影響 如圖8 所示,與正常組比較,模型組大鼠滑膜組織中TLR4、p?IκBα 和細胞核p65 蛋白表達升高(P<0.01),IKKβ 和胞質(zhì)p65 蛋白表達降低(P<0.01);與模型組比較,各給藥組TLR4、p?IκBα 和細胞核p65蛋白表達降低(P<0.05,P<0.01),IKKβ 和胞質(zhì)p65 蛋白表達升高(P<0.01),且金藤清痹顆粒的作用呈劑量依賴性。

圖8 各組大鼠滑膜組織TLR4/NF?κB 信號通路相關蛋白表達比較(,n=6)Fig.8 Comparison of TLR4/NF?κB signaling pathway related proteins expression in rat synovial tissues of each group(,n=6)
2.7 金藤清痹顆粒對大鼠膝關節(jié)滑膜組織TLR4、IKKβmRNA 表達的影響 如圖9 所示,與正常組比較,模型組大鼠滑膜組織中TLR4 mRNA 表達升高(P<0.01),IKKβmRNA 表達降低(P<0.01);與模型組比較,各給藥組TLR4 mRNA 表達降低(P<0.05,P<0.01),IKKβmRNA 表達升高(P<0.05,P<0.01)。

圖9 各組大鼠滑膜組織TLR4、 IKKβ mRNA 表達比較(,n=6)Fig.9 Comparison of TLR4 and IKKβ mRNA expressions in rat synovial tissues of each group(,n=6)
3 討論
類風濕關節(jié)炎的基本病理改變?yōu)榛ぜ毎錾r里層增厚,多種炎性細胞浸潤,血管形成,侵蝕軟骨與骨組織,最終導致關節(jié)畸形和功能喪失[9]。Ⅱ型膠原誘導性關節(jié)炎模型是類風濕關節(jié)炎基礎研究常用的經(jīng)典動物模型,其關節(jié)癥狀和病理表現(xiàn)與人類的類風濕關節(jié)炎相似。本研究發(fā)現(xiàn),金藤清痹顆粒和甲氨蝶呤以及雷公藤多苷均不同程度減輕了炎性細胞浸潤、滑膜増生、血管新生等類風濕關節(jié)炎病理損傷。
免疫功能紊亂及免疫微環(huán)境的改變是類風濕關節(jié)炎發(fā)生發(fā)展的主要機制和重要環(huán)節(jié)。CD4+T 細胞被認為在類風濕關節(jié)炎發(fā)病過程中起著關鍵性的作用,它至少有4 個不同的亞群,即Th1、Th2、Th17 和Treg 細胞,其中Th1 和Th17 細胞具有促炎作用,而Th2 和Treg 細胞有抑炎作用[10?12]。Th17與Treg 在發(fā)育和功能上相互拮抗,Th17/Treg 之間的平衡在類風濕關節(jié)炎的發(fā)生發(fā)展中發(fā)揮重要作用[13?14],調(diào)控其平衡可成為防治類風濕關節(jié)炎的重要策略[15]。本研究發(fā)現(xiàn),CIA 模型大鼠外周血Th17 比例升高,而Treg 比例降低;金藤清痹顆粒、甲氨蝶呤和雷公藤多苷均能降低Th17 比例并升高Treg 比例,最終降低Th17/Treg 比值。
巨噬細胞來源于骨髓的單核細胞,類風濕關節(jié)炎滑膜中下層巨噬細胞數(shù)量的增加是病情活動的早期特征,且巨噬細胞浸潤程度與關節(jié)侵蝕程度密切相關,從炎癥組織中清除這些巨噬細胞具有潛在的治療作用[16]。同時,巨噬細胞分為M1 型和M2 型2類,M1 型巨噬細胞主要分泌促炎細胞因子,引起關節(jié)損傷;M2 型巨噬細胞釋放抗炎細胞因子,抑制類風濕關節(jié)炎的進展[17]。研究表明,類風濕關節(jié)炎患者存在巨噬細胞活化與M1/M2 比例失衡,外周血呈現(xiàn)M1 和M2 混合型,而關節(jié)腔積液呈現(xiàn)M1 型[18]。本研究發(fā)現(xiàn),CIA 模型大鼠膝關節(jié)滑膜總巨噬細胞及M1 型巨噬細胞增加,而M2 型巨噬細胞減少,M1/M2 巨噬細胞極化狀態(tài)失衡;金藤清痹顆粒、甲氨蝶呤和雷公藤多苷均可以使滑膜總巨噬細胞數(shù)減少,且均能夠調(diào)節(jié)巨噬細胞失衡的極化狀態(tài)趨于正常。
TLR4 是一種模式識別受體,與慢性炎癥、腫瘤及自身免疫性疾病密切相關,NF?κB 是TLR4 下游炎癥信號轉錄因子,主要由p65 和p50 結合形成二聚體或異二聚體,具有明顯的促炎活性[19?20]。IκBα 是IκB 家族中的一員,是NF?κB 的主要抑制劑。當細胞外刺激發(fā)生時,TLR4 信號通路級聯(lián)反應首先激活IKB 激酶復合物,使IKB 發(fā)生磷酸化并降解,從NF?κB 中解離,使p65 活化并從胞質(zhì)轉移到細胞核中,與炎癥基因相結合,啟動炎癥因子轉錄,釋放促炎因子。本研究發(fā)現(xiàn),金藤清痹顆粒、甲氨蝶呤和雷公藤多苷均降低TLR4、p?IκBα和細胞核p65 蛋白表達,升高IKKβ 和胞質(zhì)p65 蛋白表達,降低TLR4 mRNA 表達,并升高IKKβmRNA 表達,說明金藤清痹顆粒能夠抑制TLR4/NF?κB 信號通路轉導,發(fā)揮抗類風濕關節(jié)炎作用。

