基于UPLC-Q-TOF-MS/MS結合網絡藥理學及分子對接研究益母草水提物治療動脈粥樣硬化的作用機制*
李梓寧 ,靳雅 ,李霄 ,張晗 ,張鵬
(1.天津中醫藥大學組分中藥國家重點實驗室,天津 301617;2.方劑學教育部重點實驗室,天津 301617;3.天津中醫藥大學中醫藥研究院,天津 301617)
動脈粥樣硬化(AS)是一種累及大中動脈的血管壁慢性炎癥性疾病,其發病機制復雜,受遺傳因素、環境因素、生活方式等多方面影響[1]。AS是心腦血管疾病與外周血管疾病的共同病理基礎,常導致缺血性心臟病、缺血性中風等疾病的發生。隨著西醫的不斷發展,以他汀類、抗血小板為主的藥物治療,以及以經皮冠狀動脈介入治療為主的外科介入治療手段,在一定程度上減少了AS引發的心腦血管疾病的病死率。然而,他汀類藥物具有一定的引發肌損傷及肝腎損傷的風險,且在他汀的降膽固醇治療達標后,患者仍存在明顯的心血管殘留風險。此外,他汀單藥不能滿足極高危患者的治療需求[2-4]。外科介入手術雖可臨時緩解冠狀動脈管腔狹窄及堵塞,但常易在術后幾月或幾年內出現“支架內再狹窄”情況,并未從根本上解決疾病狀況,且患者術后需終身服藥,增加醫療成本與負擔[5]。因此,尋找可靠、有效、不良反應小的天然藥物來防治AS疾病,一直以來被寄予厚望。
較之單一化學成分或單一作用靶點的藥物而言,中藥具有多成分、多靶點的優勢,在AS的臨床治療方面已取得一定的效果[6]。益母草為唇形科植物益母草Leonurus japonicas Houtt.的新鮮或干燥地上部分,最早收錄于《神農本草經》,被列為上品。其味辛、微苦,性微寒,入心包、肝經,具有活血化瘀、利尿消腫、清熱解毒之效[7]。中醫認為,AS疾病多以“痰、瘀、濁、毒、虛”等為主要病理因素,其“瘀”不僅貫穿其發生、發展始終,又常與痰、濁等相互交結加速疾病進程[8],是臨床防治AS的關鍵之一。益母草雖為治療月經不調、痛經經閉、產后惡露不盡的婦科良藥,但長于活血養血,《本草匯言》云:“益母草,行血養血,性而不傷心血,養血而不滯血,誠為血家之圣藥也”[9]。因此,益母草目前已常用于心腦血管疾病的防治,尤其是復方的組方配伍之中,如冠心康[10]、醒腦治癱膠囊[11]等,取其活血養血、通利脈道之功。現代藥理研究表明,益母草化學成分主要有萜類、生物堿、黃酮類和苯丙素類等,其中萜類成分顯示出抗血栓、血管舒張、抗血小板聚集、抗炎等生物活性作用;生物堿類成分不僅具有抗炎、抗氧化活性,還可調節血管生成過程,并對子宮平滑肌具有雙向收縮調節作用[12]。藥效學研究發現,益母草能通過降低低密度脂蛋白膽固醇、總膽固醇和三酰甘油延緩AS的發展,還可通過減少氧化應激和減少炎癥因子的表達,對腫瘤壞死因子-α(TNF-α)誘導的人臍靜脈內皮細胞炎癥起到保護作用,但缺乏對其機制的研究[13-15]。
網絡藥理學采用現代化的研究方法,將醫學與計算機科學結合在一起,基于“多基因、多靶點、多途徑”的互作網絡,為中藥治療各種疾病的作用靶點和潛在作用機制提供了預測價值[16]。為了更好地探索益母草活性成分治療AS的潛在分子機制,本研究借助超高壓液相色譜串聯四級桿飛行時間質譜聯用(UPLC-Q-TOF-MS/MS)技術、網絡藥理學和分子對接的方法,從化學成分、作用靶點和信號傳導通路多角度對益母草水提物干預AS的作用機制進行系統研究,以期為進一步揭示益母草的藥理作用機制提供理論基礎。
1 儀器與材料
UPLC-Q-TOF-MS/MS儀UPLC Xevo G2-XS QTOF(Waters公司),ACQUITY UPLC HSS T3液相色譜柱(2.1 mm×100 mm,1.8 μm),高速冷凍離心機(賽默飛世爾科技有限公司,貨號:75002440),電熱套(北京中興偉業有限公司,批號:2D4W),旋轉蒸發儀(上海禾汽玻璃儀器有限公司,批號:RE5005BEX),電子天平(賽多利斯科學儀器有限公司,序列號:3137811120),色譜級甲酸(ASC公司),乙腈(Fisher公司),超純水(屈臣氏),益母草藥材2021年購于北京同仁堂,經天津中醫藥大學李天祥教授鑒定為唇形科植物益母草Leonurus japonicas Houtt.地上部分。
2 方法
2.1 益母草水提物的制備及處理 稱取適量益母草飲片加入蒸餾水回流提取3次,每次加入蒸餾水用量分別為10倍量、8倍量、8倍量,分別回流提取30 min、20 min、20 min,煮沸后計時,合并 3 次濾液,旋蒸,減壓濃縮凍干。
2.2 益母草水提物的UPLC-Q-TOF-MS/MS分析 鑒定稱取益母草水提物藥粉適量,采用50%甲醇超聲提取20 min,提取液在轉速13 000 r/min,離心半徑8.6 cm,溫度20℃下離心15 min,取上清液進樣。液相色譜條件流速0.4 mL/min;柱溫35℃;進樣量10 μL;流動相為0.1%甲酸水溶液(A)-乙腈(B),梯度洗脫。洗脫時間見表1。
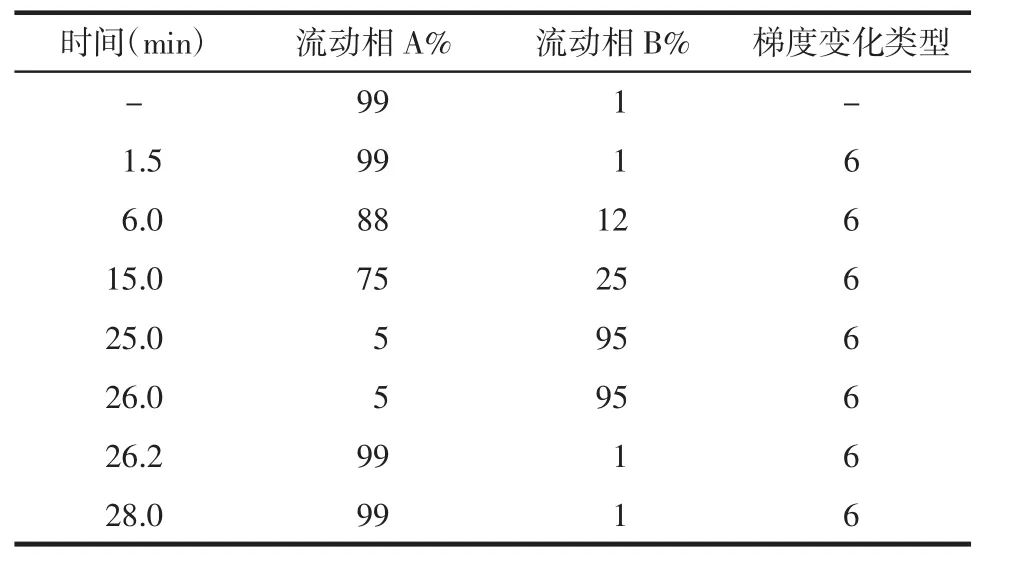
表1 梯度洗脫時間Tab.1 Gradient elution time
2.3 質譜條件 采用電噴霧離子源(ESI),質譜掃描模式采用正、負離子2種掃描模式,毛細管電壓為ESI+3.0 kV/ESI-2.5 kV,錐孔電壓為40 V。離子源溫度110℃,霧化器溫度為450℃,霧化器流速為800 L/h,錐孔氣流量為50 L/h。MSE Continuum掃描模式檢測,質量掃描范圍為m/z 100~1 200,碰撞氣為氬氣,碰撞電壓為 15~30 V、20~40 V、30~50 V,用亮氨酸腦啡肽LE(m/z 556.2677[M+H]+)作為內標進行質量實時校正,體積流量為0.5 μL/min,進樣量10 μL,數據采集軟件為MassLynx 4.2,數據處理軟件為UNIFI 1.9.4。
2.4 藥物活性成分篩選及作用 靶點預測利用有機小分子生物活性數據庫(PubChem數據庫,https://pubchem.ncbi.nlm.nih.gov)收集益母草水提物各成分化學結構。借助SwissADME數據庫(http://www.swissadme.ch),根據益母草水提物各成分的化學結構或SMILES字符,預測其成分的ADME參數、藥代動力學特性、類藥物性質等,采用胃腸道吸收(GI-absorption=high)、 類 藥 性 Druglikeness 中Lipinski、Ghose、Veber、Egan 和 Muegge 為 yes且≥3為篩選標準,確定益母草水提物的主要活性成分。利用 SwissTarget Prediction數據平臺(http://www.swisstargetprediction.ch/),預測益母草水提物主要活性成分的潛在作用靶點。
2.5 疾病潛在作用靶點篩選及藥物-疾病作用 靶點獲取通過 GeneCards(https://www.genecards.org/)、OMIM(https://www.ncbi.nlm.nih.gov/omim)和 DisGeNET(https://www.disgenet.org/search) 等數據庫挖掘與AS相關的靶基因;利用Excel對收集到的疾病靶點進行去重篩選,得到疾病相關的作用靶點。將AS相關的作用靶點映射至益母草水提物活性成分的潛在作用靶點上,借助Draw Venn Diagram在線繪圖工具繪制益母草活性成分潛在作用靶點與AS疾病靶點的Venn圖并得到交集靶點。
2.6 藥物防治疾病的調控網絡構建將AS相關的作用 靶點映射至益母草水提物活性成分的潛在作用靶點上,得到成分-疾病靶點文件。借助Cytoscape 3.7.1軟件進行網絡可視化,構建活性成分-交集靶點調控網絡。
2.7 靶點蛋白互作網絡(PPI)構建及核心靶點選篩 使用STRING數據庫構建益母草抗AS的PPI網絡圖,生物體設置為“Homo”,得到PPI.tsv數據,借助Cytoscape3.7.1軟件繪制并構建“共同作用靶點”的關系網絡,PPI網絡由代表目標蛋白質的節點和代表蛋白質-蛋白質相互作用的邊組成。邊緣的粗細代表組合分數。度是指直接連接到一個節點的其他節點的數量。度數越高,節點越重要。同時利用Cytoscape 3.7.1軟件中 CytoNCA和 BisoGenet對PPI網絡進行拓撲分析,以介度中心性(BC)、對接中心性(CC)、度自由性(DC)和Degree值等為篩選標準,篩選出核心靶點。
2.8 GO和京都基因和基因組百科全書(KEGG)通路富集分析使用 DAVID在線分析軟件將交集靶點進行GO生物過程和KEGG通路富集分析,得到通路富集文件,以P≤0.05為標準篩選通路,使用在線工具微生信進行可視化,得到GO柱狀圖和KEGG氣泡圖。
2.9 分子對接分析 將益母草水提物有效成分與核心蛋白進行分子對接,從Pubchem數據庫(https://pub-chem.ncbi.nlm.nih.gov/)和 Chemspider數據庫(http://www.8chemspider.com/)下載益母草水提物活性成分的SDF格式文件,使用Chem3D軟件轉化為Mol2格式文件。從Protein DataBank數據庫(PDB,https://www.rcsb.org/)獲取 PPI網絡中核心靶點的3D結構的PBD格式文件[白細胞介素(IL)-6(PDB:1ALU);腫瘤壞死因子(TNF,PDB:2E7A);IL-1β(PDB:1LZH);血管內皮生長因子 A(VEGFA)(PDB:1MKK);CASP3(PDB:1NMS);myc(PDB:1NKP);表皮生長因子受體(EGFR,PDB:1XKK);SRC(PDB:1O41);絲裂原活化蛋白激酶 3(MAPK3)(PDB:4QTB);HSP90AA1(PDB:1OSF)],導入 PyMol軟件去除水分子和異質分子。用Auto Dock Tools分子對接模擬軟件對蛋白質進行添加氫原子等操作,再將化學成分和靶點文件均轉化為pdbqt格式的文件,運用Grid模塊設置蛋白原配體為對接盒子中心,利用Auto Dock Vina軟件將受體(靶點)與配體(化學成分)進行半柔性對接,結合能小于0 k J/mol表明受體和配體具有自發結合潛力,結合能小于等于-5.0 kJ/mol說明化學成分與靶點對接效果較好[17]。
3 結果與分析
3.1 藥物活性成分篩選及作用 靶點預測益母草水提物UPLC-Q-TOF-MS/MS鑒定結果得到46個成分,具體信息見表2,正離子及負離子模式圖見圖1。借助SwissADME數據庫,通過ADME篩選標準,得到7個活性成分,分別是益母草堿、益母草叟苷、Leoheteronin C、漢黃芩素、葫蘆巴堿、N,N,N-三甲基-色氨酸和芹菜醇。利用Swiss Target Prediction數據平臺,預測各成分的潛在作用靶點。其中得到13個益母草堿預測靶點,64個益母草叟苷潛在預測靶點,74個Leoheteronin C潛在靶點,103個漢黃芩素潛在靶點,34個葫蘆巴堿潛在靶點,62個N,N,N-三甲基-色氨酸潛在靶點,92個芹菜醇潛在靶點。整合去重后共得到益母草水提物潛在作用靶點357個[1]。
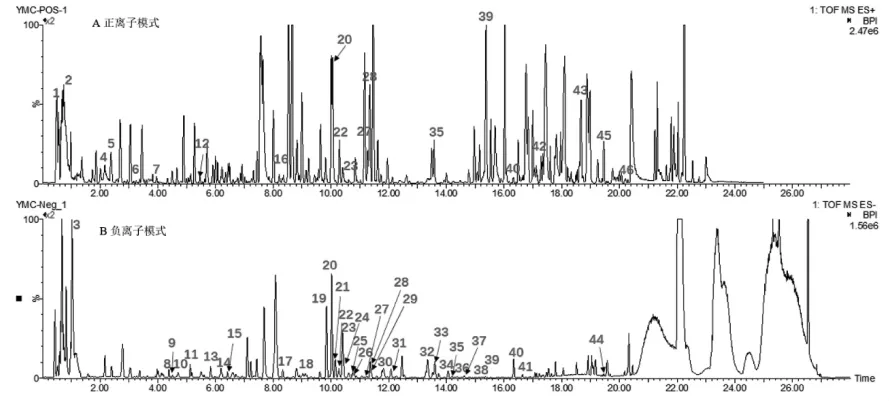
圖1 益母草水提物活性成分正離子(A)和負離子(B)模式質譜離子流圖Fig.1 Positive(A)and negative(B)total ion chromatograms of LHAE active ingredients
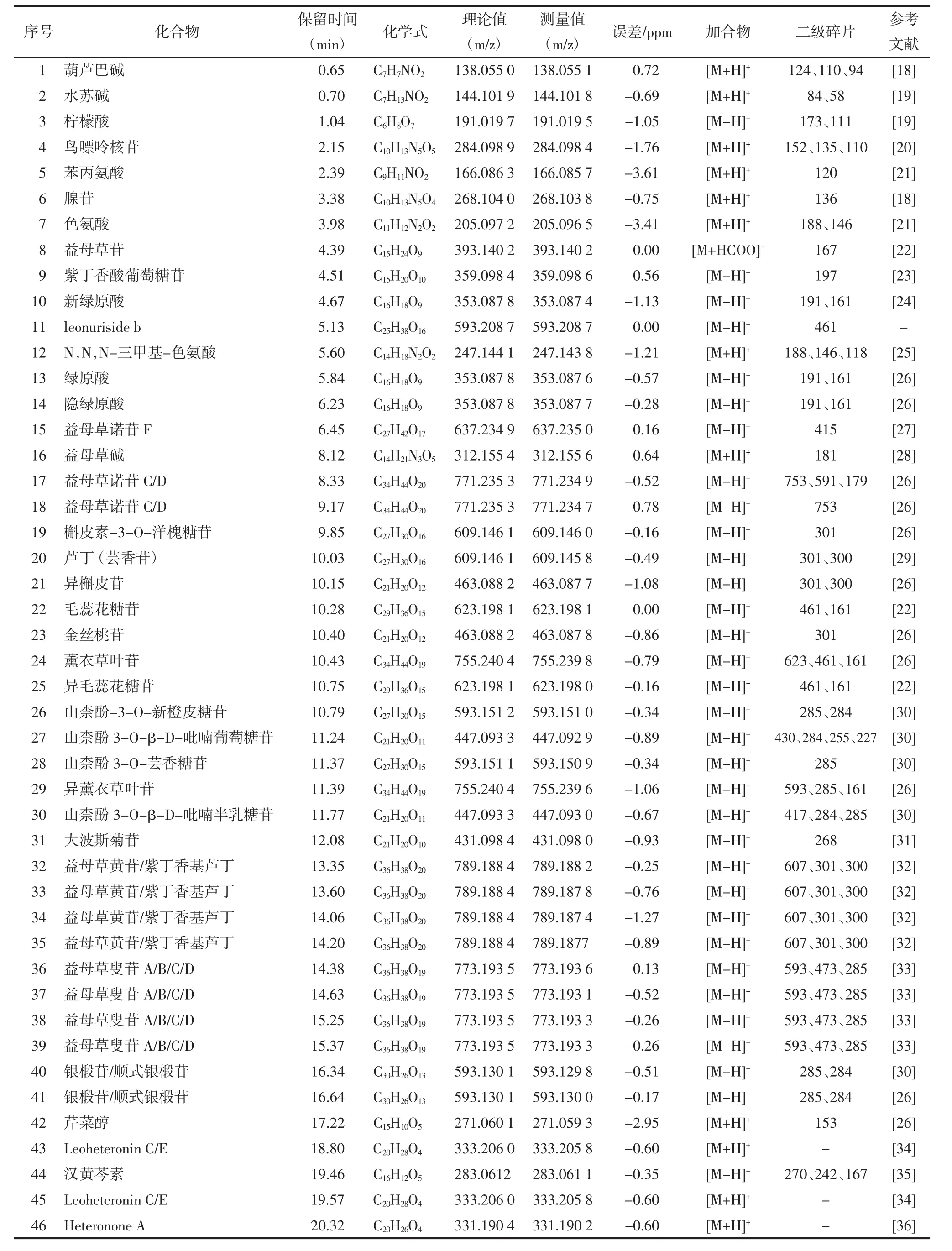
表2 益母草水提物活性成分UPLC-Q-TOF-MS/MS鑒定結果Tab.2 Compounds identified in LHAE active ingredients by UPLC-Q-TOF-MS/MS
3.2 疾病潛在作用靶點篩選及藥物成分-疾病作用靶點獲取 通過GeneCards、OMIM及DisGeNET數據庫分別得到AS相關的疾病基因4 717個、188個、2 044個,整合去重后共得到5 237個疾病基因。隨后與2.3得到的357個益母草成分作用靶點取交集,得到259個交集靶點并繪制Venn圖,見圖2。進一步將交集靶點一一映射至成分潛在作用靶點上,得到藥物成分-疾病靶點文件。
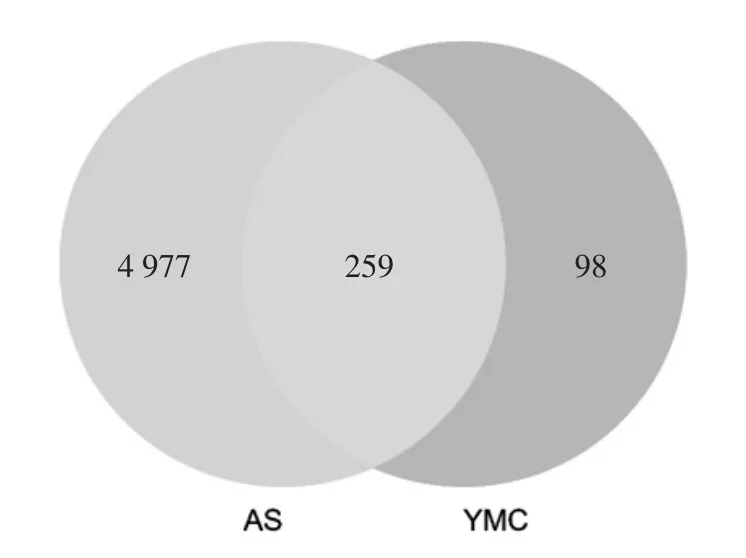
圖2 藥物靶點和疾病靶點VENN圖Fig.2 VENN diagram of drug targets and disease targets
3.3 藥物防治疾病的調控 利用Cytoscape軟件構建“藥物-成分-靶點”網絡,網絡中有7個活性成分,259個靶點,相互作用的邊共349條。見圖3。

圖3 益母草水提物治療AS的“相關活性成分-潛在作用靶點”網絡圖Fig.3 Network of“related active components-potential targets”of LHAE in the treatment of AS
3.4 靶點蛋白互作網絡構建及核心靶點篩選 將得到的259個作用靶點導入STRING數據庫進行PPI分析,利用Cytoscape3.7.1軟件進行可視化處理,同時用軟件中CytoNCA和BisoGenet插件對PPI網絡進行拓撲分析,以 BC、CC、DC、degree值等2倍中位數為篩選標準結果見圖4。并進一步篩選出核心靶點同時對核心靶點構建蛋白互作網絡圖,見圖5。
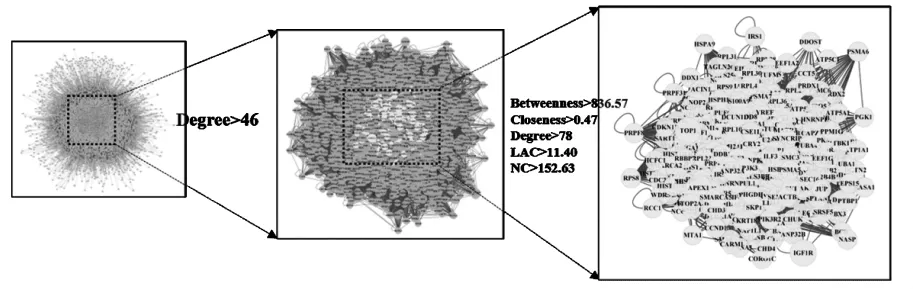
圖4 藥物-疾病靶點篩選策略Fig.4 Screening strategies of drug-disease targets
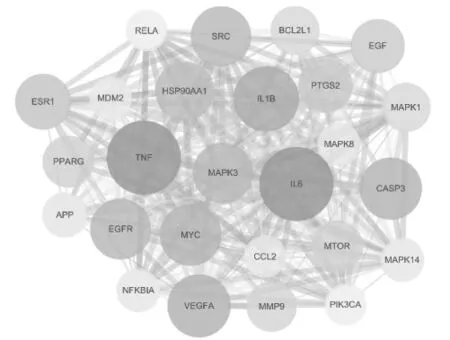
圖5 核心治療靶點蛋白互作關系網絡圖Fig.5 Protein-protein interaction(PPI)network of hit related targets
3.5 “信號通路-靶點”網絡圖 通過DAVID在線分析平臺對作用靶點進行GO功能富集分析(P<0.05),得到 258個 GOTERM-BP-DIRECT條目,259個GOTERM-CC-DIRECT條目,259個GOTERM-MFDIRECT條目,分別取其前10條作圖,通過微生信得到圖6。GO富集分析顯示,益母草防治AS可能涉及:對藥物的反應,對細胞外信號調節激酶ERK1、ERK2級聯正調控、炎癥反應等。
通過DAVID在線分析平臺對作用靶點進行KEGG通路富集分析(P<0.05),共得到240條信號通路,取相關性較高的20條作圖,利用微生信得到圖6。KEGG富集分析顯示,益母草可能通過影響磷酯酰肌醇 3激酶-蛋白激酶 B(PI3K-Akt)、TNF、低氧誘導因子-1(HIF-1)、腎素-血管緊張素系統(Ras)等信號通路發揮防治AS的作用。綜合3.3與3.4的結果,通過Cytoscape軟件對益母草7個核心成分,度值排名靠前的6個核心靶點,以及與其密切相關的15條核心信號通路進行“成分-靶點-通路”網絡圖的構建,見圖7。
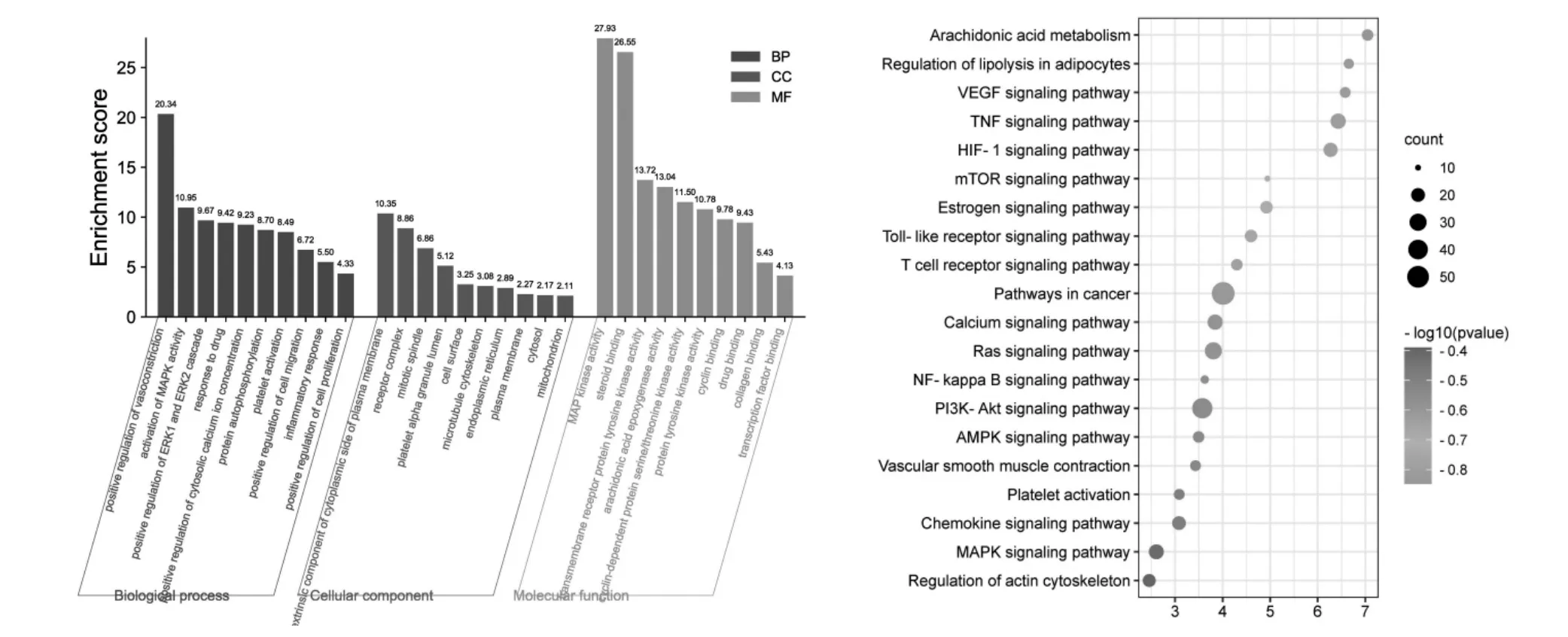
圖6 生物學過程(BP)、細胞成分(CC)、分子功能(MF)及KEGG通路富集結果Fig.6 Biological process(BP),cell component(CC),molecular function(MF)analysis of targets and KEGG pathway enrichment results
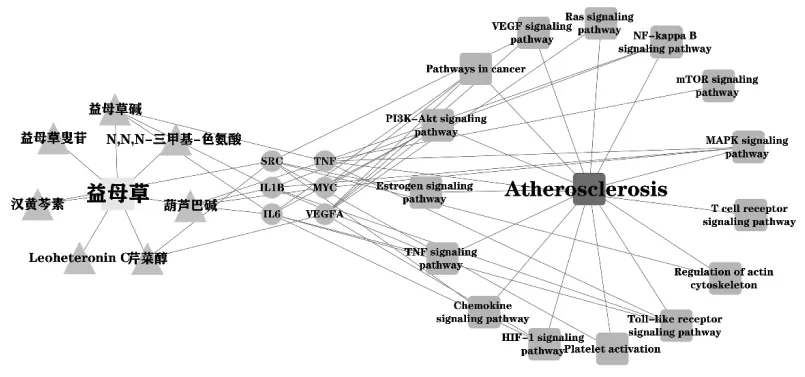
圖7 成分-靶點-通路網絡圖Fig.7 Component-target-pathway interaction network
3.6 分子對接分析 利用Auto Dock軟件對核心藥效成分和核心靶點進行分子對接模擬計算,見表3。對部分結果用Pymol進行可視化分析,見圖8。對接結果顯示,益母草提取物活性成分與AS核心靶點的最低結合能均小于0 kJ/mol,表示預測的成分與靶點可以自發進行結合,其中益母草叟苷、芹菜醇和 Leoheteronin C 與 IL-6、TNF、IL-1β、VEGFA、MYC、SRC點的結合能均小于-5 kJ/mol,說明其與靶點對接效果好[17]。
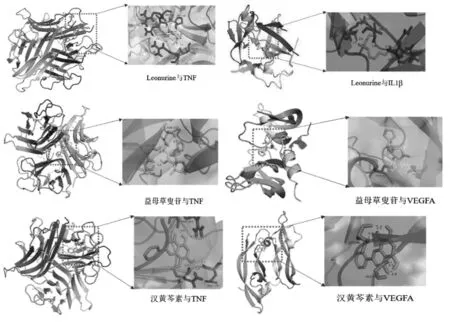
圖8 分子對接模式圖Fig.8 Molecular docking diagram
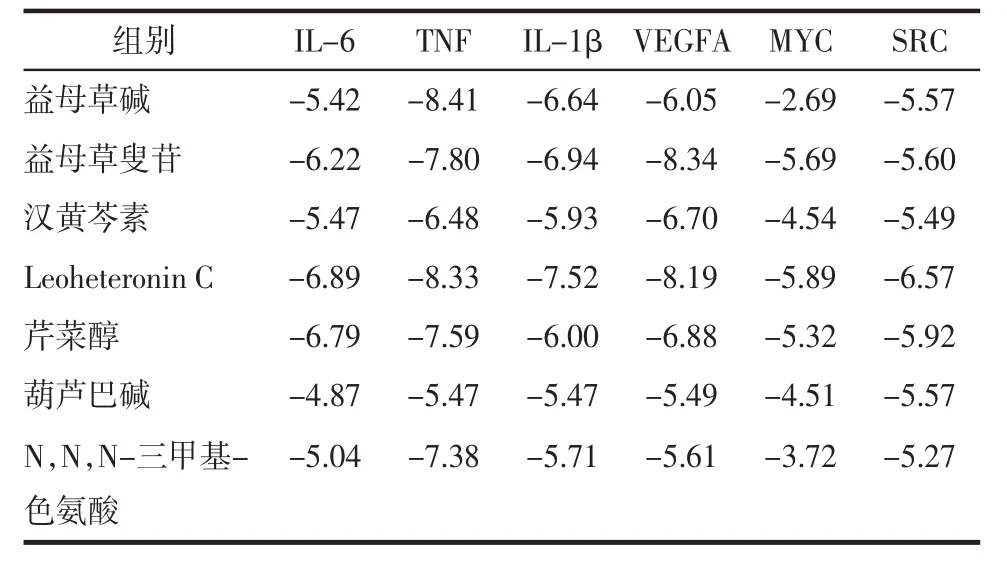
表3 益母草水提物與核心靶點分子對接結合自由能Tab.3 Binding energies of LHAE active ingredients to core targets KJ/mol
4 討論
4.1 益母草治療AS研究基礎 本研究基于UPLC-Q-TOF-MS/MS與網絡藥理學活性成分篩選,發現益母草干預AS的主要活性成分可能是益母草堿、益母草叟苷、漢黃芩素、Leoheteronin C、芹菜醇、葫蘆巴堿、N,N,N-三甲基-色氨酸。研究顯示,益母草堿以劑量依賴性的方式顯著減輕高膽固醇飲食誘導的新西蘭雄兔AS的發展,高劑量益母草堿可升高高密度脂蛋白膽固醇、降低三酰甘油,減少VSMC由收縮表型向合成表型的轉換和遷移,并改善巨噬細胞浸潤,同時抑制血管細胞黏附分子-1(VCAM-1)、TNF-α、IL-6等炎癥因子的水平。此外,益母草堿還可呈劑量依賴性地降低血清和肝臟的脂質過氧化水平[37]。Zhang等[38]從益母草中分離出的益母草叟苷A/B/C/D,在游離脂肪酸誘導的肝癌細胞中均有三酰甘油積聚的抑制作用。Ku等[39]發現漢黃芩素可以有效減少人臍靜脈內皮細胞中由高糖誘導的血管炎癥過程,減少血管通透性、單核細胞黏附、細胞黏附分子的表達,抑制活性氧的生成和核因子-κB(NF-κB)的激活。這些研究提示,益母草堿、益母草叟苷、漢黃芩素等可能是益母草水提物發揮抗AS藥效的主要活性成分。
4.2 靶點分析 通過網絡藥理學成分篩選、靶點預測和網絡分析,可發現占據網絡中心位置的主要為IL-6、TNF、IL-1β、VEGFA、c-myc等靶點,可能是益母草干預冠狀動脈粥樣硬化的關鍵作用靶點。既往研究表明,在AS的發展過程中,IL-6具有影響炎癥細胞的聚集的作用,內皮細胞通過分泌趨化因子和增加細胞間黏附分子-1(ICAM-1)的表達來影響IL-6和可溶性IL-6受體復合物的結合,共同促進白細胞的募集和向內膜遷移。Ha等[40]發現胡枝子提取物可顯著抑制TNF-α誘導的小鼠動脈內膜單核細胞的浸潤、ICAM的表達,以及炎性細胞因子IL-1β、IL-6、TNF-α 和 VCAM1 的表達,從而有效預防早期AS。Zhang等[41]發現TNF-α可能通過增加低密度脂蛋白跨內皮細胞的轉運并促進NF-κB和過氧化物酶體增殖劑激活受體-γ(PPAR-γ)的激活,從而促進低密度脂蛋白在血管壁的滯留,加速AS。斑塊內血管生成是增加斑塊糜爛、破裂風險的重要因素。血管生成由各種生長因子誘導,例如VEGF家族。Mao等[42]發現,高膽固醇血癥增加了炎性細胞因子TNF-α的釋放,然后通過增強VEGFA/VEGFR-2和成纖維細胞生長因子-2(FGF-2)/纖維細胞生長因子受體-1(FGFR-1)表達促進斑塊內血管生成,共同促進高膽固醇新西蘭兔AS病變的不穩定性。血管平滑肌細胞過度遷移與病理性內膜增厚相關,Luo等[43]發現川芎內酯對病理性內膜增厚有保護作用,表現為抑制VSMC在體內和體外的遷移,并與下調c-myc蛋白和基質金屬蛋白酶-2(MMP-2)蛋白的表達有關。可見,網絡藥理學預測的益母草水提物抗AS的關鍵靶點主要與炎癥反應、血管新生及平滑肌細胞的增殖遷移有關,可為后續進一步實驗提供參考。
4.3 生物富集分析 通過GO功能富集分析可知,生物學進程包括對藥物的反應,對ERK1、ERK2級聯正調控、炎癥反應等,主要涉及蛋白酪氨酸激酶活性、類固醇結合藥物結合等方面的功能。通過KEGG富集分析預測,益母草水提物干預AS的信號通路主要是PI3K/Akt信號通路、HIF-1信號通路、腫瘤壞死因子信號通路、Ras信號通路。
PI3K/Akt信號已被證明參與許多生理和病理過程,包括細胞增殖、細胞凋亡、炎癥、缺血性損傷和腫瘤進展[44]。巨噬細胞衍生的泡沫細胞是早期AS病變的主要細胞類型,PI3K/Akt信號通路介導巨噬細胞M1和M2極性改變和凋亡影響AS的各個階段,包括早期病變、斑塊進展和斑塊穩定性[45]。
HIF-1信號通路可通過上調NF-κB、血管內皮生長因子及其受體、活性氧、自由基和一氧化氮合酶(iNOS)的表達,導致內皮細胞功能障礙、增殖、遷移和血管生成,從而促進AS的發展。此外,HIF-1通過促進巨噬細胞M1表型分化和骨橋蛋白、TNF-α、iNOS、IL-6和VEGF的表達,促進巨噬細胞的炎癥和遷移。HIF-1α還通過減少膽固醇外流機制,促進泡沫細胞的形成[46]。Shan等[47]發現HIF-1α參與了缺氧誘導的KLF4表達上調,從而促進了血管平滑肌細胞的遷移,影響血管重塑。
Ras是多種細胞外信號通路的上游。Ras調節的信號通路控制包括增殖、生長和細胞周期進程在內的生物過程。Yu等[48]發現Ras在VSMCs中的作用包括 ERK、FAK、PI3K/Akt的激活、MMPs的分泌以及其他小G蛋白的調節,阿卡波糖對A7r5細胞中Ras的表達有抑制作用,從而減少A7r5細胞的增殖、遷移。Lin等[49]發現哌嗪二酮衍生化合物TW-01能抑制Ras的激活,抑制MAPK及其下游c-fos、c-jun和c-myc mRNA表達,顯著抑制血管平滑肌細胞的增殖以及大鼠頸總動脈球囊損傷后內膜增生。
5 結語
本研究基于UPLC-Q-TOF-MS/MS技術定性表征益母草水提物的化學成分,并結合網絡藥理學、分子對接篩選并驗證其主要活性成分的作用靶點,初步探討了益母草水提物治療AS的潛在作用機制。結果表明,益母草水提物可能通過調控IL-6、TNF、IL-1β、VEGFA 和 c-myc等核心靶點及 PI3K/Akt信號通路、TNF信號通路、HIF-1信號通路發揮治療AS作用。本研究為進一步闡明益母草水提物治療AS機制提供了一定的研究方向和數據支持,但存在以下不足:1)僅對益母草水提物化學成分進行了定性分析,并未進行定量分析。2)通過網絡藥理學及分子對接研究得到的僅是預測性結果,益母草提取物及其活性成分防治AS的確切作用與機制仍需進一步實驗研究驗證。