曲妥珠單抗聯合常規化療對HER2陽性晚期乳腺癌患者外周血T淋巴細胞亞群及生存率的影響
吳景艷,謝菲菲
1河南科技大學第一附屬醫院臨床試驗病房,洛陽 471000;2焦作市第二人民醫院婦產科,焦作 454150
乳腺癌是多發于中老年女性群體的惡性腫瘤之一,約占女性全部惡性腫瘤的10%,居女性惡性腫瘤發病率首位[1]。多數患者早期無典型癥狀,首次確診時已為晚期,從而失去手術根治的最佳時機,臨床多以化療為主要治療手段[2],常用化療方案為吉西他濱(gemcitabine,GEM)聯合卡培他濱(capecitabiue,CAP),但該方案不良反應發生風險高,且成本較高[3-4]。隨著乳腺癌生物學水平研究的不斷深入,分子靶向治療因可直接作用于腫瘤細胞的特定位點、對正常細胞的損傷較小而為臨床治療乳腺癌提供了新的治療選擇[5-6]。曲妥珠單抗是治療HER2陽性乳腺癌的1代單克隆抗體,可靶向作用于HER2而滅殺腫瘤細胞[7]。基于此,本研究擬探究曲妥珠單抗聯合常規化療對HER2陽性晚期乳腺癌患者的療效,現報道如下。
1 資料與方法
1.1 一般資料
選取2017年3月~2019年3月本院收治的78例晚期乳腺癌患者為研究對象,依據隨機數字表法分為對照組和觀察組,每組39例。對照組:年齡43~66歲,平均年齡(54.51±5.86)歲;病程 1~4年,平均病程(3.06±0.64)年;腫瘤轉移( tumor node metastasis,TNM)分期:Ⅲ期24例,Ⅳ期15例。觀察組:年齡40~69歲,平均年齡(53.81±7.75)歲;病程1~5年,平均病程(3.19±0.77)年;TNM分期:Ⅲ期28例,Ⅳ期11例。兩組一般資料比較無統計學差異(P>0.05),具有可比性。本研究經本院醫學倫理委員會批準(倫理批號:hnfsyy20170158),患者或家屬均簽署知情同意書。
納入標準:①符合《中國抗癌協會乳腺癌診治指南與規范》(2015版)[8]相關診斷標準,確診為乳腺癌者。②TNM分期為Ⅲ~Ⅳ期者。③HER2陽性者。④女性,年齡為40~70歲者。
排除標準:①合并心、肝、腎臟器功能嚴重障礙者。②患血液系統或免疫系統疾病者。③對研究藥物過敏者。④同時接受其他研究試驗者。⑤預計生存期少于6個月者。⑥依從性較差、中途退出研究者。
1.2 治療方法
對照組給予GEM聯合CAP治療:注射用鹽酸吉西他濱[連云港杰瑞藥業有限公司,國藥準字H20123362,規格0.2g(按C9H11F2N3O4計)]靜脈滴注,劑量為1000mg/m2,于第1天、第8天用藥;第1天、第14天給予卡培他濱片(江蘇恒瑞醫藥股份有限公司,國藥準字H20133365,規格0.5g)口服,劑量為2000mg/m2。21天為1個治療周期,共治療2個周期。
觀察組在對照組治療基礎上加用注射用曲妥珠單抗(上海復宏漢霖生物醫藥有限公司,國藥準字S20200019,規格150mg/瓶),靜脈滴注,首次治療劑量為8mg/kg,第2次治療降低劑量為6mg/kg,后期保持此劑量直至治療結束,每周治療1次,共治療 2 個月[7]。
1.3 觀察指標
①T淋巴細胞亞群。于治療前后采集患者空腹靜脈血5ml,采用DT5-3低速臺式離心機(河北醫眾醫療器械有限公司,d=10cm)以2500r/min離心10min,分離上清液置于-80℃條件下保存。采用FACSCalibur流式細胞分析儀(美國BD公司)測定CD3+、CD4+、CD8+、CD4+/CD8+水平。②腫瘤標記物。取上述分離血清,運用酶聯免疫吸附法測定血清中癌相關糖蛋白抗原(cancer-associated glycoprotein antigen,CA153)、組織多肽特異性抗原(tissue polypeptide specific antigen,TPS)、癌胚抗原(carcinoembryonic antigen,CEA)水平。③臨床療效。治療結束后采用《實體瘤療效評價標準》(1.1版)[9]評估兩組疾病控制率。其中,腫瘤完全消失為完全緩解,腫瘤體積縮小50%及以上為部分緩解,腫瘤體積縮小50%以下或增加25%以下為穩定,腫瘤體積增加25%及以上或出現新病灶為進展。疾病控制率=(完全緩解+部分緩解)例數/總例數×100%。④生存率。隨訪3年,截止時間為2022年3月31日,記錄所有患者的生存情況。⑤不良反應發生情況。觀察兩組治療期間出現的不良反應,包括惡心嘔吐、貧血、肝功能異常、心臟毒性等。
1.4 統計學方法
2 結果
2.1 T淋巴細胞亞群
治療前,兩組CD3+、CD4+、CD8+、CD4+/CD8+等T淋巴細胞亞群水平比較無統計學差異(P>0.05);治療后,兩組CD8+水平無明顯變化(P>0.05),CD3+、CD4+、CD4+/CD8+均降低,但觀察組高于對照組(P<0.05)。見表1。
表1 兩組T淋巴細胞亞群水平比較 n=39, x±s

表1 兩組T淋巴細胞亞群水平比較 n=39, x±s
與同組治療前比較,a:P<0.05。下同
CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治療前 治療后 治療前 治療后 治療前 治療后 治療前 治療后觀察組60.51±10.26 48.49±6.34a36.54±5.53 31.24±4.75a31.37±5.28 30.64±4.12 1.16±0.23 1.02±0.24a對照組61.03±12.74 39.27±7.55a36.12±5.75 25.45±4.28a31.46±6.46 30.29±5.88 1.15±0.25 0.84±0.22a t值 0.336 5.840 0.329 5.091 0.067 0.304 0.184 3.453 P值 0.738 0.000 0.743 0.000 0.946 0.762 0.855 0.001組別
2.3 腫瘤標記物
治療前,兩組CA153、TPS、CEA水平比較無統計學差異(P>0.05);治療后,兩組CA153、TPS、CEA水平均降低,且觀察組低于對照組(P<0.05)。見表2。
表2 兩組腫瘤標記物水平比較 n=39, x±s

表2 兩組腫瘤標記物水平比較 n=39, x±s
CA153(IU/ml) TPS(IU/ml) CEA(μg/L)治療前 治療后 治療前 治療后 治療前 治療后觀察組 70.64±10.15 34.33±8.23a 450.85±70.24 272.47±48.36a 9.84±2.51 5.11±1.21a對照組 70.66±8.12 51.61±11.21a 451.08±68.21 361.02±50.24a 9.76±2.46 7.86±2.02a t值 0.010 7.760 0.015 7.930 0.142 7.293 P值 0.992 0.000 0.988 0.000 0.887 0.000組別
2.4 臨床療效
觀察組的疾病控制率(89.74%)高于對照組(69.23%,χ2=5.032,P<0.05)。見表3。
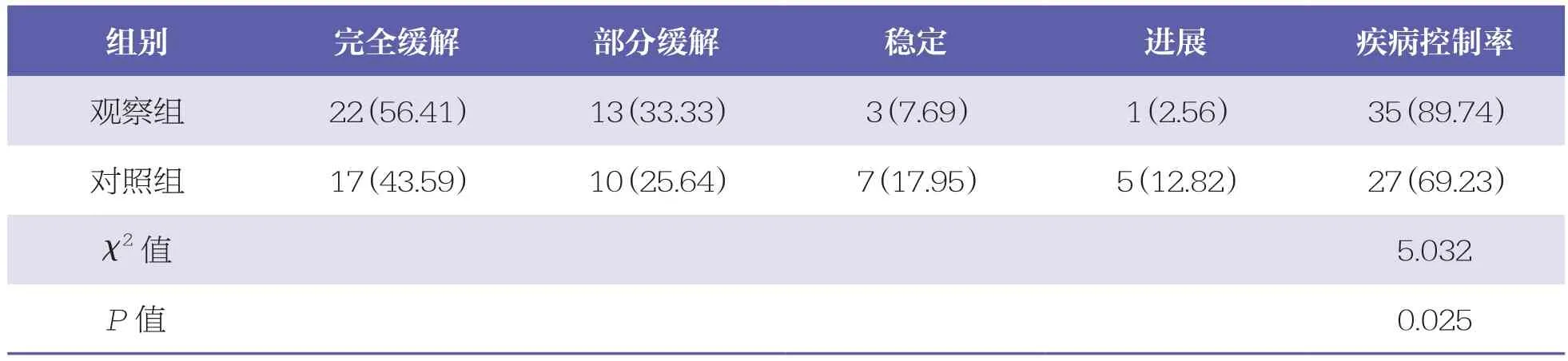
表3 兩組臨床療效比較 n=39,n(%)
2.5 生存率
觀察組的1年、2年、3年生存率均高于對照組(P<0.05)。見表4。
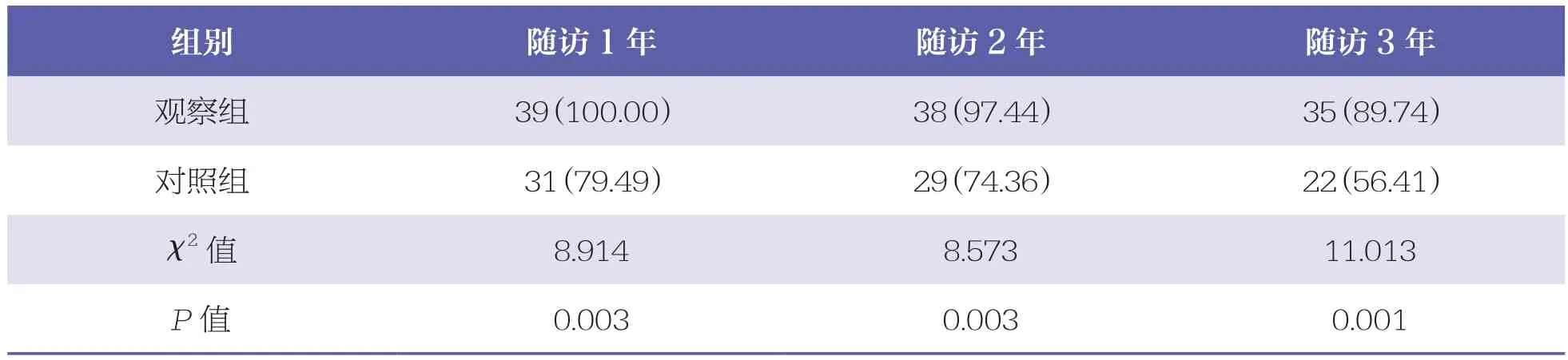
表4 兩組生存率比較 n=39,n(%)
2.6 不良反應發生率
治療期間,兩組均發生惡心嘔吐、貧血、肝功能異常、心臟毒性等不良反應,但兩組比較無統計學差異(P>0.05),且經對癥處理后均緩解。見表5。

表5 兩組不良反應發生率比較 n=39,n(%)
3 討論
晚期乳腺癌通常具有惡性程度高、進展速度快、病死率較高等特點。對于HER2陽性晚期乳腺癌患者,其腫瘤增殖率、轉移率、病死率更高,因此受到臨床高度重視[10-11]。現階段,多種化療方案對乳腺癌腫瘤細胞均具有較強的殺傷力,可延長晚期乳腺癌患者的生存期,但化療通常是全身性的,且在殺死腫瘤細胞的同時會對機體正常細胞造成不同程度損傷,導致機體免疫功能下降,影響療效及生存率[12-13]。因此,臨床開始傾向于結合靶向藥物治療以減輕化療對機體免疫功能的損傷。曲妥珠單抗對HER2具有較高的靶向性,已成為治療乳腺癌的首選靶向藥物。已有多項研究證實,曲妥珠單抗可有效延長HER2陽性乳腺癌患者的生存期,減輕不良反應[14];曲妥珠單抗術前輔助治療可有效改善HER2陽性乳腺癌患者的病灶組織相關指標、減少術后腫瘤復發轉移[15]。但關于曲妥珠單抗聯合GEM、CAP化療對乳腺癌患者的效果及安全性如何,尚缺乏研究考察。
本研究考察了曲妥珠單抗聯合GEM、CAP化療對晚期乳腺癌患者T淋巴細胞亞群、生存率及安全性的影響。研究結果顯示,治療后兩組CD3+、CD4+、CD4+/CD8+水平均降低,但觀察組各指標水平高于對照組,提示化療可影響患者免疫功能,但曲妥珠單抗可減輕這種影響,與文獻報道一致[16]。分析原因可能是曲妥珠單抗可靶向結合HER2而滅殺腫瘤細胞,而對HER2以外的組織細胞損傷較少,因此對免疫功能的影響較小。腫瘤標記物是腫瘤細胞發生、發展、浸潤、轉移過程中分泌的活性物質,其水平異常升高能夠反映腫瘤的進展。CA153、TPS、CEA是臨床判斷乳腺癌腫瘤細胞增殖活性、臨床療效及預后的常用指標。本研究中,治療后兩組CA153、TPS、CEA水平均降低,且觀察組低于對照組,而疾病控制率及1年、2年、3年生存率均高于對照組,表明曲妥珠單抗聯合常規化療方案療效較佳,可有效降低腫瘤標記物水平、提高患者生存率、改善預后,與既往研究結果一致[17],有較高的臨床價值。此外,兩組均發生惡心嘔吐、貧血、肝功能異常、心臟毒性等不良反應,但兩組比較無統計學差異,且經對癥處理后均緩解,表明在常規化療方案基礎上應用曲妥珠單抗安全性較高。
綜上所述,在常規化療基礎上應用曲妥珠單抗治療能有效提高晚期HER2陽性乳腺癌患者的臨床療效,可在一定程度上改善患者免疫功能、降低腫瘤標記物水平、提高患者的疾病控制率及生存率,且安全性較高。但由于本研究樣本數量及隨訪時間有限,并未對患者的5年甚至更遠期生存率進行探究,后續仍需通過大量大樣本、前瞻性研究進一步證實。

