術前超聲微血流分級預測肝細胞癌微血管侵犯的價值
馬國杰 方晶晶 楊現奎 賀曉
腫瘤物理消融方式及外科手術雖能延長HCC患者生存時間,但復發風險較高,且與腫瘤大小、腫瘤病理分級、手術方式、微血管侵犯(MVI)等因素有關;尤其是MVI,已被證實是HCC復發轉移的危險因素[1]。有研究表明,影像學及AFP聯合檢測已成為術前無創評估HCC患者MVI的有效手段[2]。但既往研究大多致力于探索腫瘤數量、大小、邊緣狀態、包膜完整度等影像學特征在HCC患者MVI預測方面的意義,關于術前超聲微血流分級對HCC患者MVI的預測效能尚不明確。因此,本研究初步探究術前超聲微血流分級預測HCC患者MVI的價值。
資料與方法
一、一般資料
納入2018年8月至2021年8月鶴煤總醫院收治的HCC患者138例,根據手術病理結果將患者分為有MVI組60例和無MVI組78例。獲院倫理委員會審核。納入標準:①診斷符合《原發性肝癌診療規范(2017年版)》[3];②術前7 d內行常規超聲檢查,超聲檢查及術中標本均未發現肉眼可見的血管內癌栓;③Child-Pugh A級128例,B級10例。排除標準:復發性腫瘤;多發性腫瘤;Child-Pugh C級;既往接受過肝動脈化療栓塞、放療等干預。
二、方法
選擇彩色多普勒超聲診斷儀(PHILIPS EPIQ7C)。常規超聲檢查記錄腫瘤大小、數目、低回聲暈環、內部回聲情況。選取病灶最大切面行微血流成像檢查,并存儲靜態圖像及動態圖像5~10 s。超聲對比劑選擇SonoVue(意大利Bracco),機械指數低于0.1,動態范圍維持50~60 dB,注射對比劑時啟動計時器。超聲微血流成像觀察肝腫瘤血管分級及肝腫瘤血管分布情況。采用Alder-score定量評價方式行肝腫瘤血管分級,0級:腫塊內未出現血流信號;Ⅰ級:腫塊內見細短棒狀或點狀血管1或2個;Ⅱ級:腫塊內見點狀血管3或4個,或1支較長血管(其長超過或接近腫塊半徑)穿入病灶;Ⅲ級:腫塊內見點狀血管5個以上,或有2支較長血管。肝腫瘤血管分布包括中央血流、周邊血流及混合血流(中央及周邊血流)。超聲造影觀察瘤周強化、腫瘤邊緣、廓清時相情況及始增、達峰和廓清時間。顯微鏡下于血管腔內(被內皮細胞襯覆)發現癌細胞巢團視為MVI,按照MVI程度分為有MVI組和無MVI組,M1[MVI不超過5個,且在近癌旁肝組織區域(不超過1 cm)發生]和M2[MVI超過5個,或在遠癌旁肝組織區域(超過1 cm)發生]視為有MVI組,M0(未見MVI)視為無MVI組[4]。
免疫熒光法(試劑盒由安徽省易豐合醫療科技有限公司提供)測定AFP。
三、統計學方法
結 果
一、兩組臨床特征比較
結果有MVI組血清AFP水平≥400 μg/L占比較無MVI組更高(P<0.05),見表1。
二、兩組影像學特征比較
結果有MVI組腫瘤>5 cm、微血流分級為Ⅲ級、腫瘤邊緣不光滑和瘤周強化的占比顯著高于無MVI組(P<0.05),見表2,圖1。

表1 兩組臨床特征比較[例(%)]
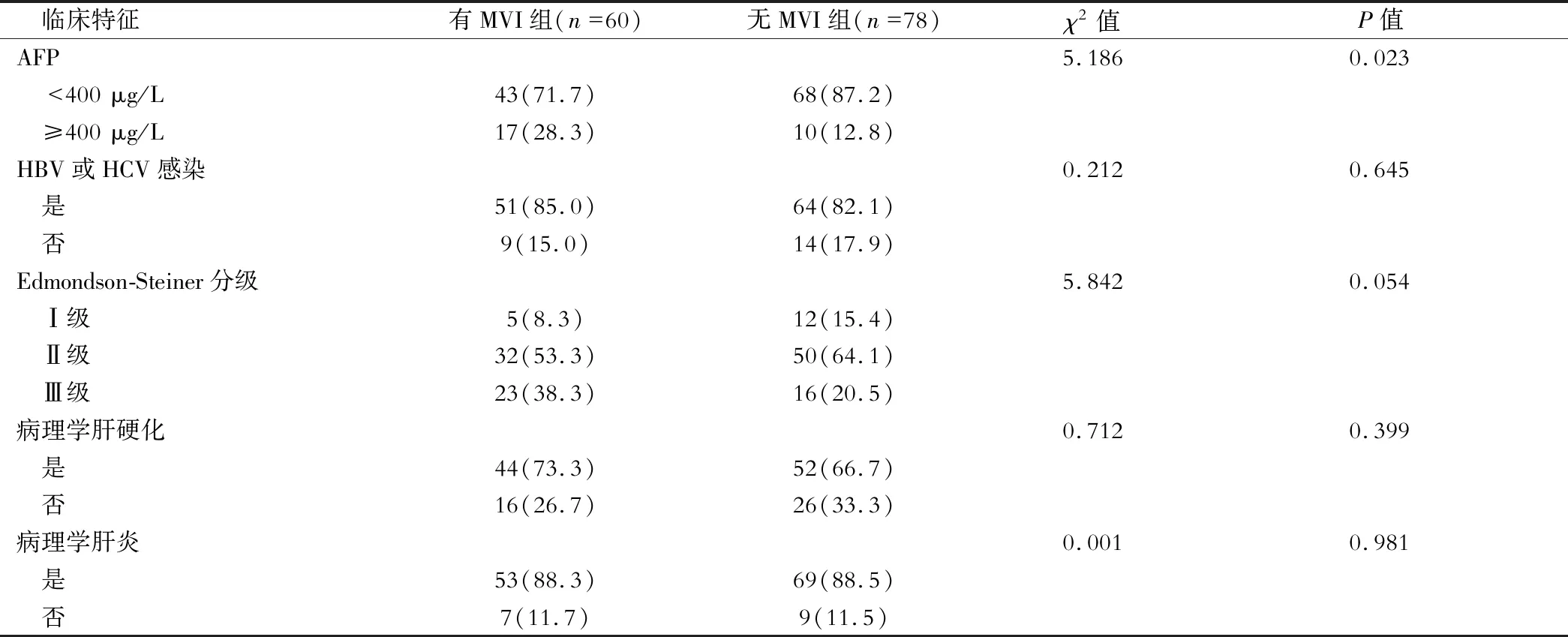
續表1
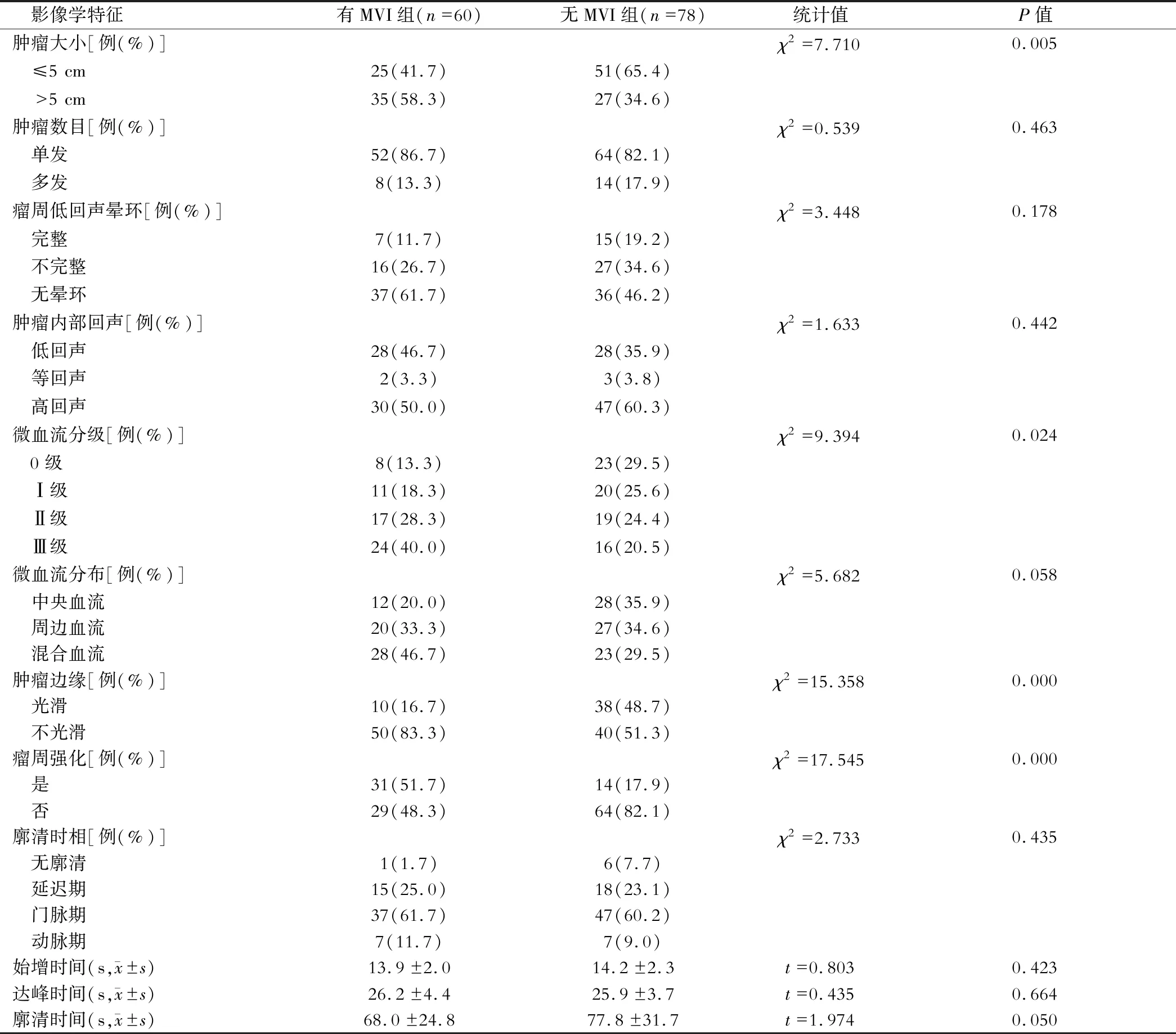
表2 兩組影像學特征比較
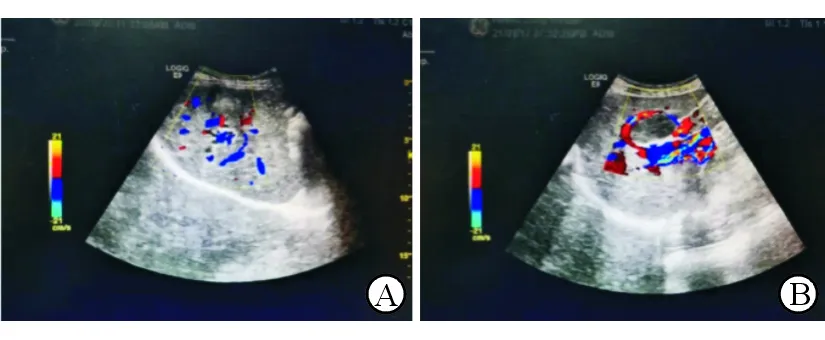
A:79歲女性HCC患者,既往有消化道腫瘤病史,肝臟彩超檢查顯示肝右葉見不均質中等回聲,周邊低回聲暈環繞,內部及周邊出現條狀及點狀血流信號;B:58歲男性HCC患者,既往有乙型肝炎病史,肝臟彩超檢查顯示肝右葉可見不均質低回聲,周邊可見環狀血流信號
三、多因素分析
血清AFP水平、腫瘤大小、微血流分級、腫瘤邊緣不光滑和瘤周強化是HCC患者MVI的獨立預測因素(P<0.05),見表3。
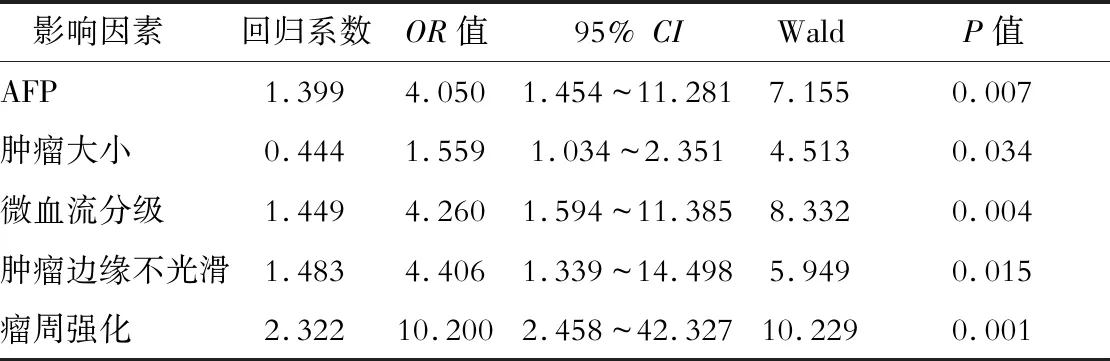
表3 多因素分析HCC患者MVI的影響因素
四、血清AFP水平聯合影像學特征預測MVI的效能分析
血清AFP水平聯合影像學特征(包括腫瘤大小、微血流分級、腫瘤邊緣不光滑和瘤周強化)預測MVI的AUC為0.954(95%CI=0.912~0.996,P<0.01),約登指數、敏感度、特異度和準確度分別為0.907、93.3%、97.4%和95.7%。
討 論
研究表明,MVI與HCC患者不良預后(復發風險增加、遠期生存率下降)密切相關[5],是HCC患者術后轉移復發的危險因素[6]。HCC患者MVI發生率高達15.0%~57.1%,與診斷標準、標本取材等有關[7]。本研究中,138例HCC患者中有60例出現MVI,發生率為43.5%,與報道結論吻合。雖然既往研究表明,部分CT及MRI征象對MVI有預測價值,但僅有腫瘤直徑、包膜類型、結節類型是普遍認可的征象,這些征象單獨應用預測效能并不高[8]。
本研究中,AFP≥400 μg/L是患者出現MVI的獨立危險因素,與李文萃等[9]報道結論相似。血清AFP水平能反映HCC惡性程度,其水平越高,腫瘤分化程度及惡性程度越高,侵襲性越強,MVI風險越高。本研究中,腫瘤大小是MVI發生的獨立危險因素,與張菊珍等[10]報道結論一致。胡月雷等[11]的研究結果也顯示,腫瘤直徑>5.0 cm是MVI出現的獨立預測因素。腫瘤直徑越大,周邊肝組織越多,微血管數量也相應增加,MVI風險也越大。但童林等[12]發現腫瘤大小并不是MVI出現的危險因素,可能與樣本量大小等因素有關。
本研究結果顯示,微血流分級為Ⅲ級是MVI出現的獨立危險因素,與Matsumoto等[13]報道結論一致。Reginelli等[14]也指出,超聲微血流成像中血流高分級是MVI出現的風險因子。超聲微血流成像中血流分級數增加的機制可能反映了存在MVI的HCC患者血供動態灌注變化。通常腫瘤周圍微小癌栓會阻塞微小門靜脈分支,導致局部門靜脈供血缺少或減少,引發動脈代償性灌注,故超聲微血流成像中表現為血流分級數增加。
本研究結果顯示,瘤周強化是MVI出現的危險因素,提示超聲造影瘤周強化對HCC患者MVI具有預測意義。研究表明,瘤周強化對MVI具有重要的預測作用[15]。腫瘤周圍區域門靜脈分支遭侵犯時,因癌栓阻塞作用會導致門靜脈灌注減少,促使肝動脈灌注增加,瘤周血流呈高灌注狀態,故表現為瘤周高增強區。可見,動脈期瘤周強化屬于腫瘤周圍血流動力學改變結果,往往提示代償性肝動脈高灌注。腫瘤邊緣不光滑是腫瘤向外突破包膜并侵入非腫瘤性肝實質的結果,朱永健等[16]報道邊緣不光滑對預測MVI有重要價值。本研究結果顯示,腫瘤邊緣不光滑是MVI出現的危險因素,與上述報道吻合。出現MVI時,腫瘤邊緣組織可能受到侵犯,因此會導致腫瘤邊緣不光滑。可見,腫瘤邊緣不光滑往往預示腫瘤具有侵襲性生物學行為,故可用于術前提示存在MVI。
HCC患者AFP、腫瘤大小、腫瘤邊緣不光滑、瘤周強化、超聲微血流成像的血流分級與MVI的內在關系較為復雜,任何一個單一因素預測HCC患者MVI較為困難。本研究將術前超聲腫瘤>5 cm、微血流分級為Ⅲ級、腫瘤邊緣不光滑、瘤周強化與血清AFP≥400 μg/L相結合,聯合預測HCC患者MVI,發現其敏感度和特異度分別為93.3%和97.4%,提示聯合預測效能較高。
綜上所述,除血清AFP水平、腫瘤大小、腫瘤邊緣不光滑和瘤周強化外,術前超聲微血流分級對預測HCC患者MVI也有一定價值,上述指標聯合檢測可提高預測效能。但本研究未分析術前超聲微血流分級對HCC患者預后的預測價值,今后應繼續深入探究。
利益沖突聲明:所有作者均聲明不存在利益沖突。

