多參數磁共振在乳腺非腫塊性強化病變病理性質及分子亞型中評估作用探究
秦小雪,席佳佳,徐 佳
(東部戰區總醫院秦淮醫療區影像科,江蘇 南京 210000)
乳腺非腫塊性強化(Non mass enhancement of breast,NME)指乳腺內無腫塊強化特征,病灶內夾雜脂肪、乳腺腺體等成分,致使強化影無連續的一種乳腺病變,NME由于無明顯占位效應、邊界不清晰,臨床診斷時難以準確鑒別其良惡性,從而延誤最佳治療時機,因此,盡早定性診斷及明確其分子亞型至關重要[1,2]。以往臨床常采用超聲、鉬靶等進行檢查,雖可有效顯示病灶形態結構等病理信息,但診斷靈敏度偏低,存在一定局限性[3]。磁共振(MRI)成像目前已廣泛應用與乳腺疾病檢查中,其中動態增強磁共振成像(DCE-MRI)可清晰顯示乳腺病灶血管通透性、血管密度等信息,通過觀察增強后病灶特征,可有效明確病灶良惡性[4];磁共振彌散加權成像(DWI)為一種可檢測病灶組織內水分子擴散運動的檢查方案,可通過獲取表觀擴散系數(ADC)分析乳腺病灶的性質[5]。國內外多篇報道均證實DCE-MRI、DWI檢查對乳腺癌具有較高的鑒別診斷價值,但關于多參數MRI對NME良惡性及分子亞型的研究較為有限,基于此,本研究試分析多參數MRI在NME病變病理性質及分子亞型中評估作用。
1 資料與方法
1.1一般資料:選取2018年1月至2021年12月258例NME患者,根據病理結果分為惡性組(n=168)、良性組(n=90),兩組基線資料比較見表1。
1.2納入及排除標準:納入標準:①均經臨床檢查確診為NME;②惡性組均經臨床病理檢查證實為惡性NME;③可接受DWI、DCE-MRI檢查;④均為初次確診;⑤知曉本研究,并簽訂知情承諾書。排除標準:①合并其他乳腺疾病;②臨床資料不完整;③合并DWI、DCE-MRI檢查禁忌癥;④合并精神障礙無法配合檢查者;⑤合并腎、肝、凝血功能障礙;⑥既往存在手術、放化療史者;⑦合并其他惡性腫瘤。
1.3剔除標準及處理方法:剔除標準:①研究中發現不符合納入標準者;②經臨床確診后不接受治療方案者;③自愿退出研究者;④檢查過程出現意外情況,無法繼續檢查者;⑤影像出現較大偽影對診斷造成干擾者。剔除處理:剔除后根據例數采用1∶1原則重新納入符合上述納入標準NME患者。
1.4方法:均采用美國GE HDXT型3.0T超導磁共振掃描儀進行檢查,所有檢查操作及影像分析均有同兩名具有豐富經驗的影像學醫師進行,當意見不一時經商討后統一結論。
1.4.1MRI檢查:選用8通道相控陣乳腺線圈,引導患者處俯臥位,常規定位后,行平掃,3D擾相快速梯度回波T1WI橫軸位掃描參數:TR=600ms,TE=7.9ms,層間距為1mm,層厚為4.0mm,矩陣為320×256mm,激勵次數(NEX)為1;脂肪抑制T2WI橫軸位掃描參數:TR=820ms,TE=35ms,層間距為1mm,層厚為4.0mm,矩陣為320×192mm,NEX為2;平掃完成后行DWI檢查,掃描參數:TR=600ms,TE=69.9ms,層間距為1mm,層厚為4.0mm,矩陣為128×128mm,選取擴散系數b=0、1000s/mm2采用脂肪抑制技術進行分析處理,獲取對應表觀擴散系數(ADC);DCE-MRI掃描參數:TR/TE=4.3/2.1ms,層厚為1.4mm,反轉角度為14度,層間距為1mm,矩陣為416×320mm,NEX為1,先進行蒙片掃描,掃描后由手臂靜脈采用高壓注射器注入Gd-DTPA對比劑18mL,注射速率2.5mL/s,注射后給予等量、等速生理鹽水,采集連續5個周期增強圖像,得出動態增強-信號強度曲線(Time-intensity curve,TIC),分析病灶內部強化特點、分布特點及TIC類型。
1.4.2TIC分型標準:參照Kuhl等[6]提出的標準進行分型,其中Ⅰ型:TIC曲線信號強度呈持續緩慢升高,但無顯著峰值;Ⅱ型:表現為明顯早期強化,但信號強度上下浮動不超過10%,呈維持平臺水平;Ⅲ型:表現為明顯早期增強上升,2~4min內達到峰值,但中后期增強顯著降低,且下浮超過10%。
1.4.3NME分子亞型標準:參照St.Gallen國際乳腺癌會議[7]經免疫組化獲取的雌激素受體(ER)、孕激素受體(PR)、細胞周期調節蛋白Ki-67以及人類表皮生長因子受體-2(HER-2)表達情況分為Luminal A型(ER/PR+、HER-2-、Ki-67<20%)、Luminal B型(ER/PR+、HER-2-、Ki-67≥20%)、HER-2型(ER-、PR-、HER-2-)、三陰型(TNBC)(ER-、PR-、HER-2-)。
1.5觀察指標:①比較惡性組、良性組多參數磁共振檢測結果,包括內部強化特點(簇狀、集叢樣、不均勻、均勻)、分布特點(局灶、彌漫、多區域、區域、導管、節段)、TIC分型、ADC值及瘤周水腫。②分析多參數磁共振鑒別NME病理性質的診斷價值。③比較惡性NME不同分子亞型患者多參數磁共振檢測結果。
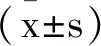
2 結 果
2.1兩組基線資料比較:258例NME患者,90例為良性(包括囊性增生病6例,腺病64例,導管內乳溝狀瘤20例),168例為惡性(包括浸潤性導管癌64例,導管內乳頭狀癌58例,導管內原位癌33例,小葉癌13例)。惡性組基線資料與良性組比較,差異無統計學意義(P>0.05)。見表1。

表1 兩組基線資料對比n(%)
2.2兩組多參數磁共振檢測比較:惡性組內部強化簇狀、節段樣分布、瘤周水腫患者多于良性組,ADC值低于良性組(P<0.05)。見表2、圖1、2。
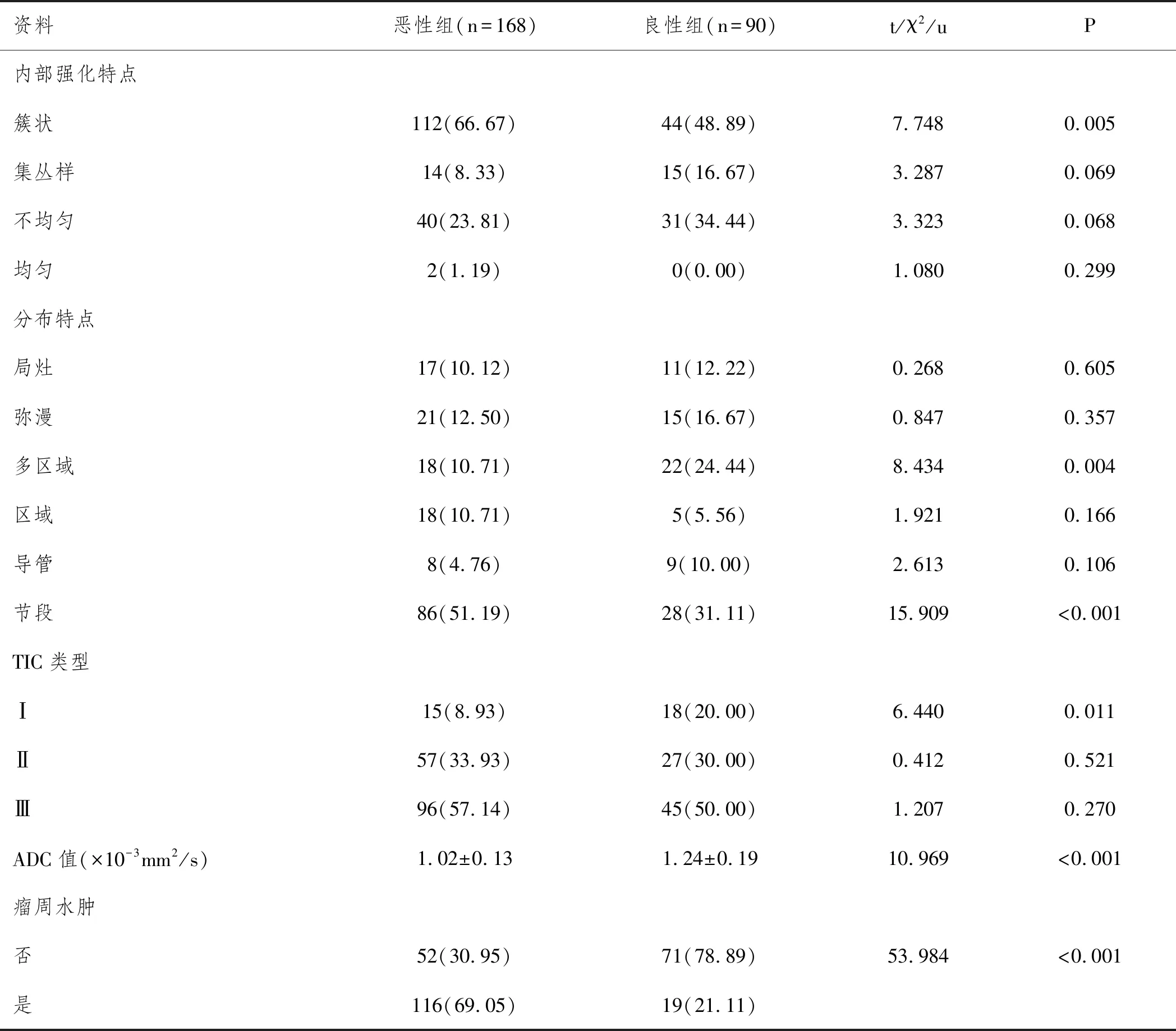
表2 兩組多參數磁共振檢測結果對比n(%)

圖1 惡性組MRI圖片
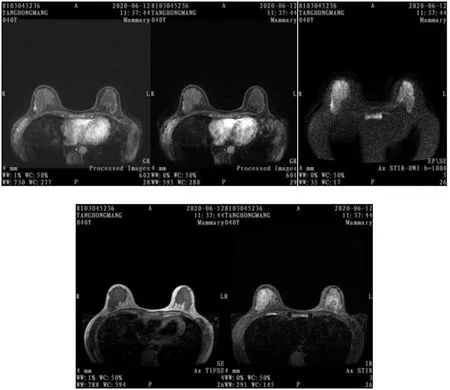
圖2 良性組MRI圖片
2.3多參數磁共振鑒別NME病理性質效能:繪制ROC曲線顯示,內部強化簇狀、節段樣分布、ADC值、瘤周水腫聯合診斷AUC大于任一單一參數,見圖3、表3。

表3 多參數磁共振鑒別NME病理性質效能ROC分析結果
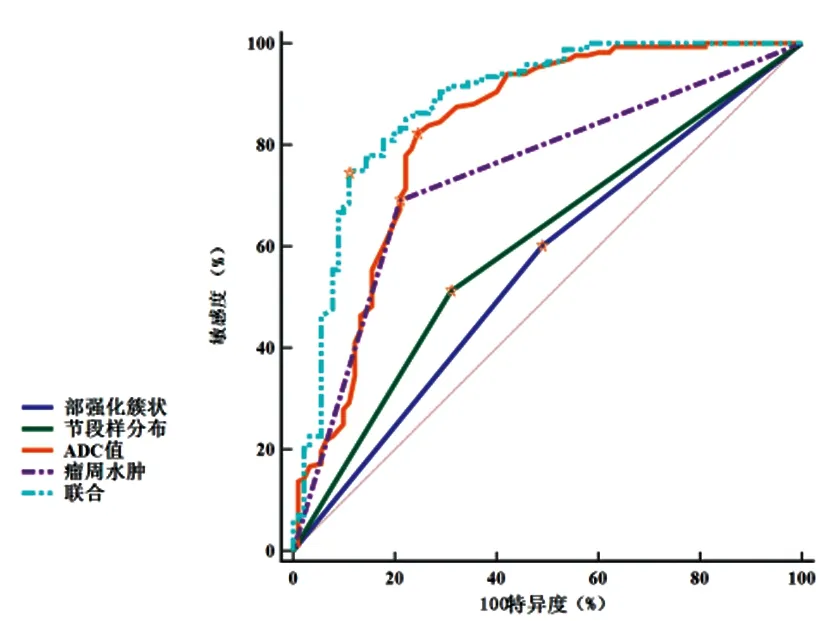
圖3 多參數磁共振鑒別NME病理性質ROC曲線
2.4惡性NME不同分子亞型患者多參數磁共振比較:HER-2型ADC值高于Luminal A型、Luminal B型、TNBC型(P<0.05);HER-2型、TNBC型瘤周水腫患者多于Luminal A型、Luminal B型(P<0.05)。見表4。

表4 惡性NME不同分子亞型患者多參數磁共振比較
3 討 論
NME為乳腺MRI檢查中較為特殊的一種類型,常規平掃T1WI、T2WI序列難以準確鑒別診斷其良惡性,對臨床治療方案的選擇及預后評估造成一定影響,以往臨床針對NME常采用超聲、鉬靶進行檢查,但篩查效果一般[8,9]。隨著MRI技術不斷發展,DWI及DCE-MRI檢查逐漸應用于乳腺疾病診斷中,有助于臨床鑒別其良惡性[10]。
DCE-MRI檢查可有效觀察病灶組織的滲透性、血管密度、完整性等病理信息[11]。本研究經DCE-MRI檢查顯示,惡性組內部強化簇狀、節段樣分布患者多于良性組,對于惡性NME診斷AUC分別為0.556、0.600,具有一定診斷價值。結合馬德晶、李艷玲等[12,13]學者研究分析其原因在于,DCE-MRI通過連續、重復、快速的成像方法,對比分析增強前后病灶組織影像,有效顯示微循環功能參數,根據參數變化分析對比劑在病灶中的分布情況,進而鑒別良惡性,相較于常規MRI,DCE-MRI還可反映其生理性變化特征,更加有助于鑒別良惡性[14];于洪偉等[15]研究顯示,以穿刺活檢結果為“金標準”,DCE-MRI檢查對惡性NME診斷準確率為93.17%,進一步證實DCE-MRI檢查對NME良惡性的鑒別診斷價值;本研究結果與其結果類似,進一步證實其診斷價值。此外,本研究還發現,良惡性組TIC分型比較無顯著差異,表明TIC對于NME良惡性鑒別診斷無意義,其原因可能在于,NME乳腺中包含脂肪組織及正常腺體,內部非完全病灶成分,對TIC反映病灶血流動力學造成一定影像,且NME內部血管較少,血管化程度不同,因此,TIC在NME中呈多樣化表現,難以區分其良惡性。
DWI檢查可通過測定與含水量相關的組織分子水平,反映病變組織形態學結構及細胞膜完整性等參數。本研究結果顯示,惡性組ADC值低于良性組,對NME良惡性診斷AUC為0.823。分析ADC值在惡性NME降低的原因在于,惡性NME病灶組織細胞繁殖旺盛,細胞外容積降低,且細胞生物膜的限制及大分子物質對水的吸附效果增強,致使病灶組織內水分子運動受限;徐琳等學者以ADC=1.05×10-3mm2/s為診斷閾值對NME進行良惡性鑒別,其診斷符合率可達88.75%,進一步證實DWI檢查對NME良惡性的診斷價值。臨床可通過多參數聯合診斷鑒別NME良惡性,以提高診斷準確率。本研究還發現,HER-2型ADC值高于Luminal A型、B型、TNBC型(P<0.05);HER-2型、TNBC型瘤周水腫患者多于Luminal A型、B型,且HER-2型、TNBC型NME更易出現瘤周水腫。楊成等學者研究表明,DWI檢查ADC值用于乳腺癌分子亞型、預后評估中具有一定價值,本研究與其結果類似,證實ADC值可用于NME分子亞型評估中。
綜上所述,多參數磁共振對于鑒別診斷NME良惡性具有較高價值,臨床可通過多參數磁共振進行早期定性診斷及分子亞型分型,以制定相應治療方案。

