氮添加對青藏高原高寒沼澤草甸土壤細菌群落的影響
曾紅麗,白 煒,房佳辰,徐 磊,商光烈
(蘭州交通大學 環境與市政工程學院,蘭州 730070)
由于工業生產、畜牧業發展及氮肥施用等,大氣氮沉降量大幅提高[1]。在過去的100多年間(1860—1995),全球氮沉降量增加近3倍,預計到2050年將達到2×1011kg·a-1[2]。中國2010年氮沉降量高達21.1 kg·hm-2·a-1[3],是全球高氮沉降區域之一。大氣氮沉降水平的持續升高引發了諸多生態環境問題,如土壤酸化[4]、改變土壤原有的氮磷平衡[5]、降低生物多樣性和凋落物分解[6]等,驅動了生態系統結構和功能的改變。草地是中國面積最大的陸地生態系統[7],具有碳氮循環、水土保持和氣候調節等生態服務功能[8-9],且大部分位于生態脆弱帶上。在草地生態系統中,土壤養分相對貧乏,氮是主要的限制因素,即使是較低水平的長期氮沉降,也可能對該生態系統帶來負面影響[10],進而影響到土壤微生物特征及土壤氮轉化,在對全球變化敏感的高寒地區更是如此。因此,有關氮沉降對高寒草地土壤微生物的影響引發了研究者的廣泛關注,逐漸成為生態學領域的研究熱點。
土壤微生物是土壤系統中的重要組成部分,在凋落物分解和氮素轉化中起著極其重要的作用[11]。氮沉降增加會引起土壤p H、氮有效性、C/N和根系生物量等發生改變[12-13],進一步影響土壤微生物數量、群落組成和土壤呼吸[14]。王長庭等[15]對海北高寒沼澤化草甸的氮添加處理發現,氮添加對細菌豐富度的影響存在土層梯度效應,氮添加增加了0~10 cm土層土壤細菌PLFAs豐富度,在10~20 cm土層表現為降低。楊越[16]通過對海北高寒草地生態系統的氮添加研究發現,氮添加沒有明顯改變土壤微生物群落結構。徐潤宏等[17]發現,在青藏高原高寒濕地進行氮添加試驗,顯著改變了細菌和真菌的相對豐度。氮添加對土壤微生物的影響由于受眾多因子的影響,不同研究之間氮添加時間、土壤水熱條件、海拔梯度以及植被類型等因素存在差異,并且生態系統功能和過程對氮沉降增加通常呈現非線性變化[18],使得研究結果存在很大的不確定性。
青藏高原是世界上中低緯度地區海拔最高、面積最大的多年凍土分布區[19],該地區草地面積約為1.65×106km2[20],是研究高寒草地生態系統格局與過程的天然實驗室。高寒沼澤草甸作為高寒生態系統主要的草地類型之一,對氮添加極其敏感[21]。土壤細菌作為土壤環境中大量存在的微生物,對氮沉降的響應更加明顯[22]。因此,本研究以青藏高原高寒沼澤草甸為研究對象,以外源氮素添加的方式模擬自然氮沉降,運用高通量測序技術,分析不同土壤深度(0~10 cm、10~20 cm、20~30 cm)細菌群落結構及多樣性對氮添加的響應特征,并通過相關性分析闡明土壤理化指標對細菌群落的調控作用,以期為氮沉降增加背景下的土壤養分循環和高寒生態區保護提供理論依據。
1 材料與方法
1.1 研究區概況
研究區位于青藏高原風火山地區,海拔4 610~5 323 m,屬于北麓河流域,年均氣溫為-5.3℃,年平均地溫為-1.5~4.0℃。地下埋藏著50~120 m多年凍土,凍土活動層為0.8~2.5 m[23]。年均降水量為269.7 mm,年均蒸發量1 477.9 mm。高寒沼澤草甸是該地區典型的草地類型之一,主要分布于山間盆地、蝶形洼地和平緩灘地等處。5月至9月為植被生長季,優勢物種為藏嵩草(Kobresia tibetica),伴生種有青藏苔草(Carex atrofusca)和矮火絨草(Leontopodium nanum)等[24]。草群覆蓋度達85%以上[25]。
1.2 試驗設計
2015年5月在風火山高寒沼澤草甸圍欄樣地 內(34°43′57.5″N,92°53′22.5″E,海 拔4 759 m)設置氮添加試驗小區,采用完全隨機區組設計,共設置3個氮添加水平:對照(CK,0 g·m-2·a-1)、低氮(N1,5 g·m-2·a-1)和高氮(N2,10 g·m-2·a-1)。每個處理3個重復,共計9個1 m×1 m的小區,小區間設2 m作為緩沖帶。以NH4NO3(分析純)為氮源,每年的氮添加量平均分為4次施入,分別于每年的6月至9月(每月1次)添加。每次施氮時按照不同施氮水平,稱取相應量的NH4NO3,溶解于200 m L水中,用噴霧器均勻噴灑,在CK噴灑相同體積的水。
1.3 研究方法
1.3.1 土壤樣品 采集于2019年9月采集土壤樣品。每個小區取5個點作為重復,除去地表凋落物后,使用滅菌后的不銹鋼土鉆采集0~10 cm、10~20 cm和20~30 cm土層的土樣,同一土層5個點的土樣混合,組成1個混合土樣。去除石塊、植物根系等雜物后,各土樣均分為3份:一份自然風干后用來測定土壤理化性質;一份鮮樣在4℃的條件下儲存,用于土壤微生物量碳、氮測定;一份鮮樣于-80℃的條件下儲存,用于細菌測序分析。
樣品以氮添加水平為前綴,土層為后綴進行標記(0~10 cm用a表示,10~20 cm用b表示,20~30 cm用c表示,如CK.a代表對照0~10 cm土樣)。
1.3.2 土壤理化性質及微生物量碳氮的測定p H用PHS-3C型酸度計測定;土壤含水量(SWC)采用恒重法測定;全氮(TN)采用半微量凱氏定氮法測定;有機碳(SOC)采用重鉻酸鉀容量法-外加熱法測定;土壤銨態氮(NH+4-N)和硝態氮(NO-3-N)的測定均用氯化鉀浸提后采用Smart Chen 200(AMS-Systea,Rome,Italy)元素分析儀測定;微生物量碳(MBC)和微生物量氮(MBN)均采用氯仿熏蒸浸提法測定。
1.3.3 DNA提取和高通量測序 采用Magnetic Soil And Stool DNA Kit試劑盒(TIANGEN BIOTECH,北京)提取土樣基因組DNA,提取后用10 g·L-1的瓊脂糖凝膠電泳檢測DNA質量。
選用 帶 有Barcode信 息 的 引 物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)對 細 菌16S r DNA的V3~V4區進行擴增。高保真酶PhusionHigh-Fidelity PCR Master Mix with GC Buffer(New England Biolabs,美國)用于PCR擴增。30μL PCR反應體系為:15μL Phusion Master Mix(2×),引物Primer(2μmol·L-1)各1.5μL,DNA模板(1 ng·μL-1)10μL,超純水2μL。PCR反應條件為:98℃預變性1 min;98℃變 性10 s,50℃退 火30 s,72℃延 伸30 s,進行30個循環;72℃延伸5 min。使用20 g·L-1的瓊脂糖凝膠對PCR產物進行電泳檢測回收,用GeneJET膠回收試劑盒(Thermo Scientific,美國)進行純化。使用TruSeq DNA PCRFree Library Preparation Kit建庫試劑盒構建文庫,構建好的文庫經過Qubit定量和文庫檢測合格后,使用NovaSeq6000測序平臺(諾禾致源生物信息科技有限公司,北京)進行上機測序。
使用FLASH(V1.2.7)對每個樣本的reads進行拼接,過濾處理,進一步去除嵌合體序列后得到有效數據。利用Uparse軟件(v7.0.1001)以97%的相似性將序列聚類成為OTUs。用Mothur方法對OTUs代表序列進行物種注釋,與SILVA132的SSUr RNA數據庫進行比對,獲得各OTU的分類學信息。
1.4 數據處理
用Excel 2016對數據進行初步整理,并繪圖做進一步分析。使用R(Version 2.15.3)軟件的vegan軟件包,基于Bray-Curtis距離算法,繪制NMDS圖分析不同樣本間的差異程度。使用Qiime軟件(Version 1.9.1)計算Shannon、Simpson和Chao1等指數。運用SPSS 21.0軟件進行方差分析(One-way ANOVA)和相關性分析。
2 結果與分析
2.1 氮添加對土壤理化性質的影響
高寒沼澤草甸各處理土壤理化性質如圖1所示。土壤p H為8.05~8.20,在各處理中均表現為隨著土壤深度的增加而增加,N2處理與CK在0~10 cm土層存在顯著差異(P<0.05)。N1和N2處理土壤NH+4-N相比對照,在0~10 cm和10~20 cm土層均顯著降低(P<0.05)。N1處理土壤NO-3-N相比對照,在0~10 cm和10~20 cm土層顯著降低,N2處理土壤NO-3-N在10~20 cm土層相比對照顯著降低(P<0.05)。N1和N2處理均顯著降低0~10 cm和10~20 cm土層SOC(P<0.05),且10~20 cm和20~30 cm土層N1處理SOC含量 最 低。N1處 理TN相比對照,在10~20 cm土層顯著降低,N2處理TN在0~10 cm土層相比對照顯著降低(P<0.05)。N2處理SWC相比對照,在0~10 cm和10~20 cm土 層 均 顯 著 降 低,N1處 理SWC相比對照,在10~20 cm土層顯著降低(P<0.05)。以上結果表明,氮添加對土壤理化性質影響明顯。

圖1 不同處理下土壤理化性質Fig.1 Physicochemical characteristic of soil under different treatments
2.2 氮添加對土壤微生物量碳氮的影響
由圖2可知,MBC在表層取得最大值,相比對照,N1處理顯著增加10~20 cm和20~30 cm土層MBC,N2處理MBC相比對照,在10~20 cm土層顯著增加(P<0.05)。N1處理MBN在10~20 cm和20~30 cm土層相比對照顯著降低(P<0.05),N2處理MBN相比對照,在各土層均無顯著性差異。表明隨著氮添加量的增加,微生物量碳呈增加趨勢,微生物量氮則表現為先降低后增加的趨勢。

圖2 不同處理下土壤微生物量碳氮Fig.2 Soil microbial biomass carbon and nitrogen under different treatments
2.3 氮添加對土壤細菌物種組成的影響
通過高通量測序共得到544 463條優質序列,序列長度為414~421 bp,對聚類后的3種氮添加處理土壤樣品OTU依次進行不同等級信息分析,共得到54個門、62個綱、126個目、225個科、489個屬。
土壤細菌優勢菌群為變形菌門(Proteobacteria,41.136%~51.099%)、酸桿菌門(Acidobacteria,14.606%~24.105%)、放線菌門(Actinobacteria,7.726%~13.603%)、芽單胞菌門(Gemmatimonadetes,4.341%~9.868%)和厚壁菌門(Firmicutes,1.811%~11.977%)(圖3)。變形菌門相對豐度在CK.a取得最大值51.099,氮添加處理下相對豐度相比對照,呈先降低后升高趨勢。N1和N2處理酸桿菌門相對豐度相比CK,在0~10 cm和10~20 cm土層均增加,在20~30 cm土層均減少。N1和N2處理放線菌門相對豐度,在0~10 cm和10~20 cm土層相比CK均減少。N1和N2處理厚壁菌門,相比對照,其相對豐度在0~10 cm土層增加,10~20 cm土層減少。氮添加后各土層芽單胞菌門相對豐度表現為增加趨勢。

圖3 不同處理下土壤細菌門水平相對豐度Fig.3 Relative abundance of soil bacterial phyla under different treatments
科水平土壤細菌相對豐度對氮添加的響應分析結果表明(圖4),相比對照,N1和N2處理梨單孢菌科相對豐度在0~10 cm和10~20 cm土層呈增加趨勢,在20~30 cm土層呈降低趨勢。N1和N2處理亞硝化單胞菌科相對豐度相比對照,在0~10 cm土層均降低,在10~20 cm和20~30 cm土層均增加。相比對照,氮添加處理使各土層芽單胞菌科相對豐度均表現為增加趨勢。20~30 cm土層Unidentified_Deltaproteobacteria相對豐度在N1和N2處理下,相比對照有明顯的增加。氮添加條件下,Unidentified_Rhodospirillales的相對豐度相比對照,在0~10 cm土層均增加,在10~20 cm土層和20~30 cm土層均減小。氮添加處理后,鞘脂單胞菌科、Unidentified_Rhizobiales和嗜氫菌科的相對豐度在各土層均降低。N1和N2處理鏈球菌科相對豐度相比對照,在10~20 cm土層和20~30 cm土層均明顯減小。相比對照,N1和N2處理葡萄球菌科相對豐度在10~20 cm土層均減少。表明氮添加對科水平優勢細菌相對豐度影響較大。
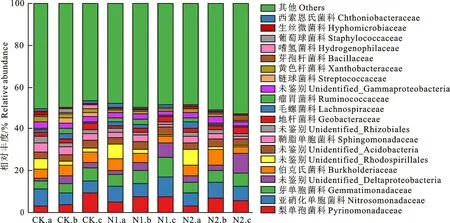
圖4 不同處理下土壤細菌科水平相對豐度Fig.4 Relative abundance of soil bacterial family levels under different treatments
2.4 氮添加對土壤細菌群落結構的影響
由NMDS分析結果可以看出(圖5),低氮添加對土壤細菌群落結構的影響大于高氮添加,但N1和N2處理均沒有顯著影響土壤細菌群落結構。圖中N1.b和N2.b距離較近,說明這兩個樣點的物種組成較為相似。

圖5 土壤細菌的NMDS分析Fig.5 Soil bacterial community structure under different treatments
2.5 氮添加對土壤細菌α多樣性的影響
不同氮添加處理測序樣品OTUs數量為2 018~2 378,測序覆蓋率在0.99以上。對土壤細菌α多樣性指數進行分析(表1),各土層N1和N2處理Shannon指數相比對照,均表現為降低趨勢,且 在N2.b和N2.c處 顯 著 降 低(P<0.05)。N1和N2處理Simpson指數相比對照,整體也表現為降低趨勢,且在N1.c和N2.c處顯著降低(P<0.05)。Chao1指數為2 056.150~2 413.727,最大值在N1.b處取得,相比對照,N1和N2處理土壤細菌豐富度指數(Chao1,Ace)整體呈降低趨勢,其中,N2.b處兩種豐富度指數顯著降低(P<0.05)。表明氮添加能抑制細菌群落多樣性,但整體差異不顯著。

表1 不同處理下土壤細菌α多樣性指數Table 1 Alpha diversity indexes of soil bacterial under different treatments
2.6 土壤細菌與土壤理化性質及微生物量碳氮之間的關系
由相關性分析結果可知(表2),Ace指數和Chao1指數均與NH+4-N顯著正相關(P<0.05)。Shannon指數與NH+4-N和SWC顯著正相關(P<0.05),與p H顯著負相關(P<0.05)。表明NH+4-N、p H和SWC是影響細菌多樣性的關鍵土壤因子。
進一步分析土壤因子對細菌優勢菌門的影響(表2),變形菌門與p H負相關(P<0.05),與MBC、MBN、NO-3-N、SOC、TN和SWC極顯著正相關或顯著正相關(P<0.01或P<0.05)。酸桿菌門與p H呈正相關(P<0.05),與NH+4-N、NO-3-N和SWC極顯著負相關(P<0.01)。放線菌門與NH+4-N顯著正相關(P<0.05)。芽單胞菌門與MBN、NO-3-N、SOC、TN和SWC均顯著負相關(P<0.05)。
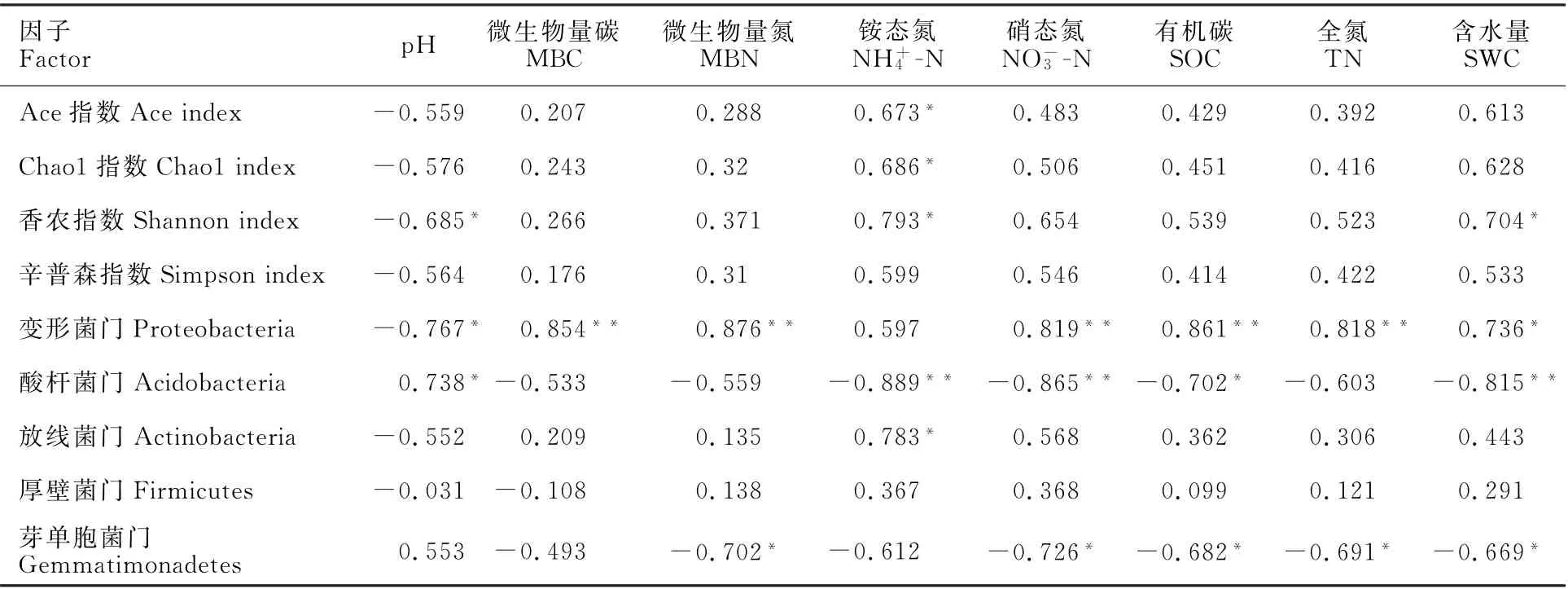
表2 土壤因子與細菌的相關性Table 2 Correlation analysis between soil factors andbacterial community
3 討論
3.1 氮添加對細菌群落結構的影響
本研究對青藏高原高寒沼澤草甸進行氮添加處理,NMDS分析結果表明,氮添加沒有對土壤細菌群落結構產生顯著性影響,可能是因為本研究氮添加試驗時間和氮添加量尚未達到明顯改變細菌群落結構的閾值。變形菌門、酸桿菌門、放線菌門、厚壁菌門和芽單胞菌門是該地區土壤細菌主要菌群。各優勢菌群相對豐度對氮添加表現出不同的響應趨勢。本研究樣地變形菌門在土壤細菌當中占比最高,其相對豐度在各土層隨著施氮濃度的增加,均表現為先降低后升高趨勢,表明氮添加對變形菌門的影響存在閾值限制,與李成一等[26]的研究結果相似。N1和N2處理酸桿菌門相對豐度相比對照,在0~10 cm土層和10~20 cm土層均增加,可能是由于該細菌屬于寡營養類群,9月為植物生長枯黃期,氮添加使植物生長期延長,植物對養分的需求增加[21],微生物的養分獲取受到限制,從而促進了該菌群的生長。研究認為放線菌屬于富營養型細菌[27],能夠降解纖維素和幾丁質,產生種類繁多的胞外酶和次生代謝產物[28],是土壤養分供給的來源之一。氮添加使各土層放線菌門相對豐度表現為降低趨勢,可能與本研究中氮添加條件下,土壤銨態氮和硝態氮有效性降低有關。氮添加增加各土層芽單胞菌門相對豐度,表明氮添加會促進芽單胞菌門的生長。氮添加后0~10 cm土層厚壁菌門相對豐度相比對照增加,而在10~20 cm土層相比對照減少,這可能與厚壁菌門屬于固氮菌,氮添加引起各土層土壤氮含量發生改變有關。
3.2 氮添加對細菌群落多樣性的影響
土壤微生物多樣性是土壤生物多樣性的重要組成部分,可指示土壤生態功能變化。氮添加可通過改變土壤環境條件(如土壤氮有效性和酸化)影響細菌多樣性[29]。微生物多樣性的降低會影響土壤氮循環[30],進一步影響生態環境穩定性。有研究表明施氮會直接影響土壤細菌豐富度[27]。楊越[16]以青藏高原高寒草地生態系統為研究對象,發現氮添加對土壤細菌多樣性未產生顯著影響。李成一等[26]以三江源區高寒草甸為研究對象,發現隨氮添加量的增大,多樣性指數呈先降低后增高趨勢。本研究發現,氮添加處理下Shannon和Simpson指數均下降,N2處理Shannon指數在10~20 cm和20~30 cm土層相比對照明顯降低,N1和N2處理Simpson指數相比對照,在20~30 cm土層顯著降低。氮添加后Chao1和Ace指數也呈降低趨勢,且N2處理兩種豐富度指數在10~20 cm土層處顯著降低。徐潤宏等[17]的研究也表明,氮添加降低了高寒地區土壤細菌Simpson和Chao1指數,與本研究結論相似。說明氮添加影響了土壤細菌群落組成,降低了高寒沼澤草甸土壤細菌多樣性。原因可能是高寒沼澤草甸土壤貧瘠,氮素匱乏,氮添加促進了地表植被生長[25],大部分土壤養分被植物所吸收,細菌用于自身生長繁殖的養分受到限制,抑制了細菌多樣性。也可能是細菌類群競爭排斥的結果,即一些細菌對氮誘導的環境脅迫具有高度的適應能力[31],氮添加促進了這類細菌的迅速生長,改變了土壤原有細菌組成,影響細菌多樣性。
3.3 氮添加條件下土壤因子對細菌群落的影響
土壤理化性質是影響細菌群落的重要因素。細菌菌群由于自身結構和功能的差異,對不同環境適應能力及養分需求有所不同,土壤p H、有機碳和含水量等升高或降低,會引起細菌群落組成和多樣性的改變,土壤細菌群落結構的變化也會反過來影響土壤養分的有效性。本研究相關性分析表明,p H、NH+4-N和SWC是影響細菌群落多樣性的關鍵環境因子,NO-3-N、SOC、SWC和MBN分別與特定細菌門顯著相關。程亮等[32]在青藏高原地區的研究表明,土壤含水量和有機碳含量是影響細菌群落分布的主要環境因子,與本研究結果相似。劉紅梅等[33]和楊山等[34]的研究中也有類似發現。Rousk等[35]研究發現土壤p H是影響細菌生長的主要因素。土壤p H的變化會影響微生物酶活性和碳氮元素利用率,改變微生物代謝功能[36],影響草地土壤細菌的多樣性。但較高的土壤p H具有一定的酸緩沖能力,對氮添加引起的土壤酸化具有較強的抵抗力,使得土壤p H對氮輸入的響應較小[37],對細菌的影響減弱。碳是微生物生長的必需元素,土壤有機碳含量被認為是土壤細菌動態的主要決定因素[38],通常認為土壤有機碳含量與細菌存在顯著相關性。有研究發現,氮添加對土壤有機碳含量的影響存在閾值限制[16],與該研究結果類似,本研究中N1處理有機碳含量最低。這可能是因為氮添加促進了地表植被的生長,植物吸收土壤中的養分用于自身生長繁殖,低氮添加可能導致有機碳輸出大于輸入,使得土壤有機碳含量低于對照。當氮添加超過一定水平時,歸還到土壤中的養分和凋落物量增加,有機碳含量較低,氮添加時升高。微生物量氮作為土壤有機質中最活躍的組分,對環境變化非常敏感,本研究發現微生物量氮隨氮添加水平的升高表現為先降低后增加趨勢,單文俊等[39]對長白山白樺山楊天然次生林土壤微生物量對氮添加的響應研究中也有類似發現。可能是因為低氮添加時,微生物在與植被競爭養分中處于劣勢,微生物的生長受到抑制,微生物量氮降低,高氮添加增加了土壤中可利用氮含量,緩解了微生物與植被之間的養分競爭[4],微生物量氮增加。土壤銨態氮和硝態氮有效性會導致細菌豐富度發生變化[27]。土壤水分的變化則會導致土壤中的氧含量發生改變,進而影響細菌的分布[40]。除土壤理化性質外,根系分泌物、土壤酶和土壤團聚體也會影響細菌群落,因此,開展植被、細菌和土壤環境間的耦合關系研究,可以更好地了解氮添加對細菌群落的影響機制。
4 結論
通過對青藏高原高寒沼澤草甸土壤細菌群落對氮添加的響應研究,得出以下結論:氮添加對土壤優勢菌群相對豐度均有不同程度的影響,但沒有顯著改變土壤細菌群落結構;氮添加抑制了土壤細菌多樣性指數;土壤銨態氮、硝態氮、有機碳和含水量是影響細菌群落變化的關鍵土壤因子。長期氮添加可能會對青藏高原高寒沼澤草甸土壤細菌群落產生持續性影響,并對生態系統的穩定性構成嚴重威脅。因此,本研究區氮添加試驗對土壤細菌的影響研究還需持續進行,以期為氮沉降增加影響下,高寒草地生態系統生物多樣性維持機制提供理論依據。

