異澤蘭黃素通過DCST1-AS1/miR-138-5p對胰腺癌細胞SW-1990的影響
程德剛 李福昌 任剛
中藥是一種強有效的輔助治療手段,可用于臨床治療胰腺癌,其作用機制有待更深入的研究[1]。異澤蘭黃素是從菊科蒿屬植物中分離的一種黃酮苷元,具有抗炎,抗氧化,抗腫瘤等多種藥理活性[2,3],可抑制miR-21的表達,通過激活AKT通路誘導腎癌786-O細胞凋亡[4],可通過靶向Akt /GSK3β和MAPK/ERK信號級聯反應來抑制食管癌TE1細胞增殖[5],可通過抑制ERK通路抑制肝癌細胞SK-HEP-1增殖以及促進其凋亡[6]。然而異澤蘭黃素對胰腺癌細胞SW-1990生物學行為的影響及機制尚不清楚。研究報道miR-138-5p上調可抑制胰腺癌細胞的增殖和轉移[7]。lncRNA MCM3AP-AS1通過調節miR-138-5p促進胰腺癌細胞的生長和遷移[8]。生物學軟件預測發現miR-138-5p與lncRNA DCST1-AS1有結合位點,DCST1-AS1可促進膠質母細胞瘤細胞的增殖[9]。抑制DCST1-AS1可通過增加miR-874-3p表達抑制子宮頸癌細胞的增殖,遷移和侵襲[10]。因此,本實驗旨在研究異澤蘭黃素對胰腺癌細胞SW-1990生物學行為的影響及機制是否與DCST1-AS1和miR-138-5p有關。
1 材料與方法
1.1 實驗材料 胰腺癌細胞SW-1990(美國ATCC);RPMI-1640完全培養基(武漢Procell);異澤蘭黃素(HPLC≥98%,滁州仕諾達生物);CCK-8試劑盒(武漢博士德生物);吉薩姆染色液(上海鈺博生物);Transwell小室、基質膠(美國康寧);Annexin V-FITC/PI凋亡檢測試劑盒、蛋白提取試劑盒(上海貝博生物);熒光定量PCR試劑盒(德國Qiagen);雙熒光素酶報告基因檢測試劑盒(上海碧云天)。
1.2 細胞處理與分組 胰腺癌細胞SW-1990用RPMI-1640完全培養基培養,取對數生長期細胞,分別用2.5 μmol/L、10 μmol/L、40 μmol/L異澤蘭黃素處理,記為異澤蘭黃素2.5、10、40 μmol/L組,常規培養的細胞作為對照組;將DCST1-AS1抑制表達載體及陰性對照轉染至SW-1990細胞,記為si-DCST1-AS1組、si-NC組;將DCST1-AS1過表達載體染至SW-1990細胞后用40 μmol/L異澤蘭黃素處理,記為異澤蘭黃素+pcDNA-DCST1-AS1組。
1.3 CCK-8檢測細胞活性 各組細胞培養48 h,每孔加入10 μl CCK-8試劑,孵育2 h,酶標儀檢測450 nm波長處的吸光度值(OD)。
1.4 平板克隆形成實驗檢測集落形成數 將各組細胞消化后以適宜濃度接種于6孔板中,約培養2周有肉眼可見克隆時停止培養,吸去培養液后用PBS將細胞洗滌2遍,甲醇固定,吉姆薩染色 30 min,干燥后在光學顯微鏡下計數>50個細胞的集落。
1.5 Transwell檢測細胞遷移和侵襲 用無血清培養液饑餓細胞12 h,然后制備細胞懸液;將200 μl細胞懸液加入 Transwell 上室,下室加入600 μl含血清培養液,常規培養24 h,取出Transwell小室,棄去孔中培養液,用PBS洗2遍,用棉簽輕輕擦掉上層未遷移細胞,甲醛固定30 min,將小室適當風干;用0.1%結晶紫染色30 min,用PBS洗3遍;風干后倍顯微鏡下隨機選取5個視野觀察,記數。侵襲實驗:基質膠稀釋后平鋪于 Transwell 上室,凝固后同遷移操作。
1.6 流式細胞術檢測細胞凋亡 收集各組細胞,用預冷的PBS漂洗2次,加入結合緩沖液重懸,加入10 μl的Annexin V-FITC,再加入5 μl的PI,混勻避光孵育10 min;上流式細胞儀檢測細胞凋亡率。
1.7 Western blot法檢測蛋白表達 提取細胞總蛋白,進行SDS-PAGE電泳分離蛋白,轉膜、封閉,加入Cleaved-caspase3一抗(1∶500)于4℃孵育過夜,倒掉一抗,洗膜,加入HRP標記的二抗(1∶3 000),室溫搖床孵育2 h,洗膜,顯影,分析蛋白條帶灰度值。
1.8 實時熒光定量PCR(RT-qPCR)檢測DCST1-AS1和miR-138-5p的表達水平 提取各組細胞總RNA,合成cDNA,按照熒光定量PCR試劑盒說明進行PCR,相對表達量用2-△△Ct法計算。分別以GAPDH和U6為內參,DCST1-AS1上游引物序列:5’-CGGTTTTCTCCTCA
GCTTTG-3’,下游引物序列:5’-CCCATGTTTGGGGAT
AGATG-3’;GAPDH上游引物序列:5’-ATTCCATGGC
ACCGTCAAGGCTGA-3’,下游引物序列:5’-TTCTCCA
TGGTGGTGAAGACGCCA-3’;miR-138-5p上游引物序列:5’-TGCAATGGGTTTGGCGTAGAAC-3’,下游引物序列:5’-CCAGTGCCGCAGGGTAGGT-3’;U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’。
1.9 雙熒光素酶報告實驗 將DCST1-AS1野生型和突變型熒光素酶載體分別與miR-NC或miR-138-5p共轉染至SW-1990細胞,按照試劑盒說明檢測SW-1990細胞的熒光素酶活性。

2 結果
2.1 異澤蘭黃素對SW-1990增殖凋亡遷移侵襲的影響 與對照組比較,異澤蘭黃素2.5、10、40 μmol/L組SW-1990細胞活性降低,集落形成數、遷移和侵襲細胞數減少,細胞凋亡率及Cleaved-caspase3表達水平升高,呈濃度依賴性,差異有統計學意義(P<0.05)。見圖1,表1。

圖1 異澤蘭黃素誘導SW-1990凋亡;A 異澤蘭黃素誘導SW-1990凋亡;B 異澤蘭黃素促進SW-1990中Cleaved-caspase3蛋白的表達(1 對照組;2 異澤蘭黃素2.5 μmol/L組;3 異澤蘭黃素10 μmol/L組;4 異澤蘭黃素40 μmol/L組)

表1 異澤蘭黃素抑制SW-1990增殖遷移侵襲誘導凋亡
2.2 異澤蘭黃素對SW-1990中DCST1-AS1、miR-138-5p表達的影響 與對照組比較,異澤蘭黃素2.5、10、40 μmol/L組SW-1990細胞中DCST1-AS1表達水平降低,miR-138-5p表達水平升高,呈濃度依賴性(P<0.05)。見表2。

表2 異澤蘭黃素對SW-1990中DCST1-AS1、miR-138-5p表達的檢測
2.3 DCST1-AS1靶向miR-138-5p Starbase預測顯示DCST1-AS1和miR-138-5p有互補序列;wt-DCST1-AS1與miR-138-5p共轉染的細胞熒光素酶活性低于wt-DCST1-AS1與miR-NC共轉染的細胞(P<0.05);而mut-DCST1-AS1與miR-138-5p或miR-NC共轉染的細胞熒光素酶活性無差異(P>0.05)。見圖2,表3。
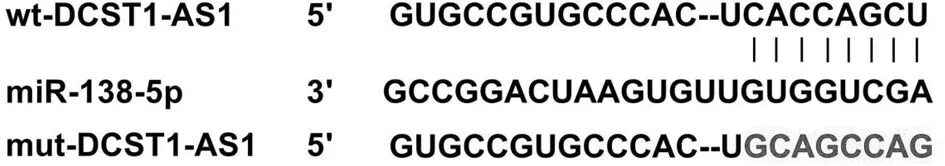
圖2 DCST1-AS1和miR-138-5p的互補序列
2.4 沉默DCST1-AS1對SW-1990增殖凋亡遷移侵襲的影響 與si-NC組比較,si-DCST1-AS1組DCST1-AS1表達水平降低,miR-138-5p表達水平升高,SW-1990細胞活性降低,集落形成數、遷移和侵襲細胞數減少,細胞凋亡率及Cleaved-caspase3表達水平升高(P<0.05)。見圖3,表4。

表3 雙熒光素酶報告實驗
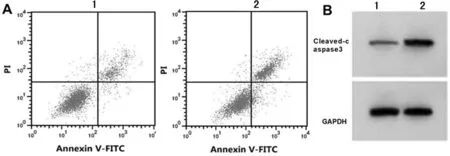
圖3 沉默DCST1-AS1誘導SW-1990凋亡;A 沉默DCST1-AS1誘導SW-1990凋亡;B 沉默DCST1-AS1促進SW-1990中Cleaved-caspase3蛋白的表達(1 si-NC組;2 si-DCST1-AS1組)
2.5 過表達DCST1-AS1對異澤蘭黃素處理的SW-1990增殖、凋亡、遷移侵襲的影響 與異澤蘭黃素組相比,異澤蘭黃素+pcDNA-DCST1-AS1組DCST1-AS1表達水平升高,miR-138-5p表達水平降低,SW-1990細胞活性升高,集落形成數、遷移和侵襲細胞數增加,細胞凋亡率及Cleaved-caspase3表達水平降低,差異均有統計學意義(P<0.05)。上述指標在對照組與異澤蘭黃素組間亦均有差異(P<0.05)。見圖4,表5。

表4 沉默DCST1-AS1抑制SW-1990增殖遷移侵襲誘導凋亡

圖4 過表達DCST1-AS1可逆轉異澤蘭黃素對SW-1990凋亡的誘導作用;A 過表達DCST1-AS1可逆轉異澤蘭黃素對SW-1990凋亡的誘導作用;B 過表達DCST1-AS1可逆轉異澤蘭黃素對SW-1990中Cleaved-caspase3表達的促進作用(1 對照組;2 異澤蘭黃素組;3 異澤蘭黃素+pcDNA-DCST1-AS1組)

表5 過表達DCST1-AS1可逆轉異澤蘭黃素對SW-1990增殖、遷移、侵襲、凋亡的作用
3 討論
黃酮類化合物具有抗氧化性,抗病毒,抗腫瘤等多種生物活性,開發抗腫瘤的含黃酮類中藥對治療各種癌癥具有重要意義[11]。異澤蘭黃素作為一種重要的黃酮類活性成分,研究報道異澤蘭黃素通過促進HeLa和Caski宮頸癌細胞株的凋亡和細胞周期阻滯來抑制增殖[12]。異澤蘭黃素可促進上皮性卵巢癌的細胞凋亡[13],可抑制神經膠質瘤的增殖,遷移和侵襲[14],可通過調節PTEN和NF-κB信號傳導抑制前列腺癌細胞的增殖和遷移[15]。本實驗用不同濃度的異澤蘭黃素的處理胰腺癌細胞SW-1990,結果顯示,SW-1990細胞的活性降低,集落形成數、遷移和侵襲細胞數減少,細胞凋亡率及Cleaved-caspase3表達水平升高,呈濃度依賴性;表明異澤蘭黃素可濃度依賴性的抑制SW-1990細胞增殖、遷移和侵襲,促進細胞凋亡。
研究報道DCST1-AS1通過靶向miR-605-3p來調節胃癌細胞的增殖,遷移,侵襲和凋亡[16]。DCST1-AS1通過AKT/mTOR信號通路加速肝癌細胞的增殖,轉移和自噬[17]。本實驗結果顯示,沉默DCST1-AS1后,SW-1990細胞活性降低,集落形成數、遷移和侵襲細胞數減少,細胞凋亡率及Cleaved-caspase3表達水平升高;表明沉默DCST1-AS1可抑制SW-1990細胞增殖、遷移和侵襲,促進細胞凋亡;提示DCST1-AS1在胰腺癌中作用與在其他癌癥中相似。且本實驗發現DCST1-AS1靶向調控miR-138-5p;而上調miR-138-5p水平可抑制胰腺癌細胞增殖,遷移和侵襲[18]。提示,DCST1-AS1可通過調控miR-138-5p影響胰腺癌細胞生物學行為。此外,本實驗發現異澤蘭黃素可降低DCST1-AS1表達水平降低,提高miR-138-5p表達水平;而過表達DCST1-AS1可逆轉異澤蘭黃素對SW-1990細胞的作用。
綜上所述,異澤蘭黃素通過調控DCST1-AS1/miR-138-5p軸抑制胰腺癌細胞SW-1990的惡性生物學行為。

