CRISPR-Cas9技術(shù)修飾乳酸桿菌的研究進(jìn)展
余詠詩(shī),劉 輝,2,
(1.佛山科學(xué)技術(shù)學(xué)院食品科學(xué)與工程學(xué)院,廣東佛山 528225;2.佛山科學(xué)技術(shù)學(xué)院醫(yī)學(xué)院,廣東佛山 528000)
幾個(gè)世紀(jì)以來(lái),乳酸桿菌作為一種能發(fā)酵食物的益生菌,已成為開(kāi)發(fā)食品配方和益生菌產(chǎn)品最常用的微生物之一。隨著對(duì)乳酸桿菌研究的不斷深入,乳酸桿菌的生理機(jī)制和生物特性被廣泛開(kāi)發(fā)與利用。通過(guò)對(duì)乳酸桿菌的基因進(jìn)行修飾,從而開(kāi)發(fā)出具有更優(yōu)良性質(zhì)的可用于食品、藥物生產(chǎn)的新型乳酸桿菌,是目前研究的熱點(diǎn)之一。因此,高效的基因修飾技術(shù)是必不可缺的工具。
近年來(lái),CRISPR-Cas9技術(shù)以效率高、簡(jiǎn)便、成本低等特點(diǎn)在農(nóng)業(yè)、醫(yī)療藥物等領(lǐng)域中大放異彩。但美中不足的是,該技術(shù)的效率、精確性還有待提高,同時(shí)消費(fèi)者和工業(yè)界對(duì)轉(zhuǎn)基因產(chǎn)物的安全性也持有懷疑的態(tài)度,因此經(jīng)過(guò)基因修飾的產(chǎn)物會(huì)受到嚴(yán)格的監(jiān)管。但從科學(xué)的角度來(lái)看,基因編輯的轉(zhuǎn)基因乳酸桿菌是很有潛力的,且國(guó)內(nèi)外也已經(jīng)允許了一部分應(yīng)用CRISPR-Cas9技術(shù)編輯植物的使用。因此,利用CRISPR-Cas9技術(shù)對(duì)乳酸桿菌進(jìn)行改造是一個(gè)值得關(guān)注的研究方向。
目前,CRISPR-Cas9技術(shù)在乳酸桿菌中的應(yīng)用較少。現(xiàn)有研究主要集中在對(duì)乳酸桿菌自身CRISPRCas系統(tǒng)的分析和研究,而對(duì)乳酸桿菌原位基因修飾的研究報(bào)道并不多見(jiàn)。與傳統(tǒng)的菌株改良方法相比,CRISPR-Cas9技術(shù)可極大地提高乳酸桿菌靶向位點(diǎn)的正確性并做到無(wú)痕基因組修飾,通過(guò)此技術(shù)獲得的菌株甚至有可能比通過(guò)傳統(tǒng)的隨機(jī)誘變方法獲得的菌株更為安全。隨著基因編輯技術(shù)的逐漸成熟,以及大眾接受程度的增加,CRISPR-Cas9技術(shù)編輯過(guò)的乳酸桿菌將會(huì)廣泛地應(yīng)用到人體健康、食品工業(yè)等領(lǐng)域。本文對(duì)部分乳酸桿菌和CRISPR-Cas9技術(shù)進(jìn)行介紹,對(duì)CRISPR-Cas9技術(shù)在乳酸桿菌中的應(yīng)用與存在的問(wèn)題進(jìn)行綜述,并展望未來(lái)CRISPRCas9技術(shù)運(yùn)用到乳酸桿菌的發(fā)展趨勢(shì),期望為國(guó)內(nèi)乳酸桿菌生物工程化的研究與開(kāi)發(fā)提供一些思路。
1 乳酸桿菌的概述
乳酸菌(Lactic acid bacteria,LAB)是指能利用可發(fā)酵碳水化合物并產(chǎn)生大量乳酸的一類無(wú)芽孢、革蘭氏染色陽(yáng)性細(xì)菌。這類細(xì)菌是一種分布極為廣泛、具有豐富多樣化的物種,以桿菌或球菌為主。乳酸菌至少包括18個(gè)屬,由200多種已被正式認(rèn)可的物種和亞種組成,其中乳酸桿菌()最為重要。乳酸桿菌不僅是人類體內(nèi)的共生菌之一,而且在人類健康和食品工業(yè)等方面也起到了不可或缺的作用。
早在公元3世紀(jì),乳酸桿菌就已經(jīng)開(kāi)始被人類用于發(fā)酵食物,而對(duì)乳酸桿菌長(zhǎng)期的研究和應(yīng)用早已證明了一些乳酸桿菌是安全的、具有多種功能作用的益生菌,因此它們也被廣泛應(yīng)用于保健食品,促進(jìn)人體健康。其中,最典型的是乳酸桿菌可以防治乳糖不耐癥(喝鮮奶時(shí)出現(xiàn)的腹脹、腹瀉等癥狀),因?yàn)槿樘菚?huì)被乳酸桿菌產(chǎn)生的乳糖酶所降解形成更容易吸收的小分子狀態(tài),使得乳糖不耐受患者可以接受乳制品。同時(shí),乳酸桿菌可以增加腸道有益菌群,改善人體胃腸道功能,恢復(fù)人體腸道內(nèi)的菌群平衡,形成抗菌生物屏障,維護(hù)人體健康。此外,乳酸桿菌可抑制脂肪酸的吸收,進(jìn)而減少體脂增加。Jang等利用動(dòng)物喂養(yǎng)實(shí)驗(yàn)的方法分別對(duì)小鼠進(jìn)行口服灌胃鼠李糖乳桿菌和生理鹽水的處理,以評(píng)估鼠李糖乳桿菌()對(duì)肝臟脂質(zhì)積聚和造成肥胖的慢性作用,結(jié)果表明口服鼠李糖乳桿菌的小鼠腸道顯著減少了對(duì)脂肪酸的吸收。
乳酸桿菌不僅對(duì)人體有著許多有益的功能,同時(shí)也是食品工業(yè)中的重要菌種,能賦予食品獨(dú)特的風(fēng)味以及改善食品的品質(zhì)和營(yíng)養(yǎng)成分。唐立偉等研究了鼠李糖乳桿菌()、瑞士乳桿菌()、副干酪乳桿菌()等四種典型的乳酸桿菌在乳品發(fā)酵過(guò)程中的pH、酸度變化、貨架期內(nèi)的活菌數(shù)變化及耐胃酸的能力,結(jié)果表明發(fā)酵乳產(chǎn)酸快但貨架期短,而和的發(fā)酵乳貨架期穩(wěn)定性優(yōu)良。此外,乳酸桿菌在養(yǎng)殖業(yè)中也發(fā)揮了重要作用,唾液乳桿菌()可以改善雞的生長(zhǎng)性能,有效增加體重和免疫器官的相對(duì)重量,而且還可減輕熱應(yīng)激引起的器官損傷以及增強(qiáng)傳染性法氏囊病(Infectious bursal disease virus, IBDV)疫苗免疫后的免疫應(yīng)答。
上述研究結(jié)果表明,乳酸桿菌不僅能促進(jìn)人體健康,在發(fā)酵食品中的工業(yè)應(yīng)用和養(yǎng)殖業(yè)等領(lǐng)域同樣也占據(jù)著非常重要的地位。表1列出了一些乳酸桿菌的代表菌種及其在食品加工中的應(yīng)用。
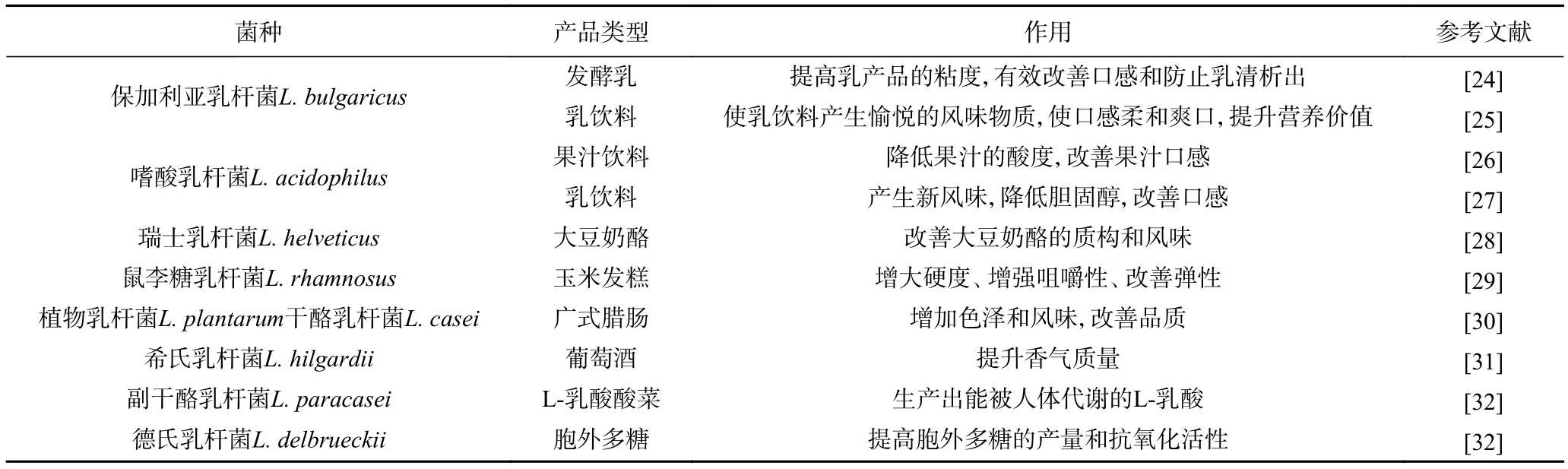
表1 部分乳酸桿菌的菌種及其在食品加工中的應(yīng)用Table 1 Some Lactobacillus strains and their application in food processing
2 CRISPR-Cas9技術(shù)的發(fā)現(xiàn)及作用機(jī)制
基因編輯是能精確插入、刪除、替換生物體中含有遺傳信息的基因序列的新興技術(shù),而CRISPR-Cas9是繼鋅指核酸酶技術(shù)(Zinc-finger nuclease,ZFNs)、轉(zhuǎn)錄激活因子樣效應(yīng)物核酸酶技術(shù)(Transcription activator-like effector nuclease,TALENs)等基因編輯技術(shù)推出后的第三代基因編輯技術(shù)。短短幾年內(nèi),CRISPR-Cas9技術(shù)風(fēng)靡全球,成為現(xiàn)有基因編輯和基因修飾里面效率最高、最簡(jiǎn)便、成本最低、最容易上手的技術(shù)之一,也是當(dāng)今最主流的基因編輯系統(tǒng)。前兩代基因編輯技術(shù)都需要構(gòu)建結(jié)合蛋白和Fok I核酸內(nèi)切酶的結(jié)構(gòu)域組成的復(fù)雜系統(tǒng)。ZFNs作為第一代基因編輯技術(shù),鋅指蛋白能識(shí)別特定的3個(gè)連續(xù)堿基對(duì),由Fok I核酸內(nèi)切酶的結(jié)構(gòu)域負(fù)責(zé)切割DNA,其設(shè)計(jì)依賴上下游序列,脫靶率高,具有細(xì)胞毒性,且這項(xiàng)技術(shù)專利被美國(guó)Sangamo壟斷,因此自問(wèn)世以來(lái)無(wú)大規(guī)模應(yīng)用。第二代的TALENs與ZFNs類似,TALENs由TALE基序串聯(lián)成決定靶向性的DNA識(shí)別模塊,一個(gè)TALE基序識(shí)別一個(gè)堿基對(duì),特異性高,細(xì)胞毒性比ZFNs低。但TALENs存在較多的重復(fù)序列,需要大量測(cè)序工作,且模塊組裝過(guò)程繁瑣。而CRISPR-Cas9技術(shù)除了靶向精準(zhǔn)、脫靶率低、細(xì)胞毒性低等特點(diǎn)外,另一個(gè)顯著優(yōu)勢(shì)是它能夠同時(shí)編輯多個(gè)基因,利用多個(gè)gRNAs靶向不同的基因,為復(fù)雜的多基因編輯研究開(kāi)辟了新的可能性。
CRISPR是1987年由石野良純等在大腸桿菌()基因組中意外發(fā)現(xiàn)的一系列串聯(lián)重復(fù)DNA片段,這些片段含29個(gè)保守堿基且被另一段含32個(gè)堿基的可變序列隔開(kāi),但當(dāng)時(shí)對(duì)這種結(jié)構(gòu)的生物學(xué)功能不得而知。九十年代,隨著研究者在多種細(xì)菌和古細(xì)菌基因組中都發(fā)現(xiàn)了這種特殊的重復(fù)片段,因此在2000年將其統(tǒng)稱為短規(guī)律性間隔重復(fù)(Short regularly spaced repeat, SRSR)序列。直到2002年,Jansen等對(duì)這種特殊結(jié)構(gòu)進(jìn)行深入研究后,正式將這種結(jié)構(gòu)命名為成簇規(guī)律性間隔短回文(Clustered regularly interspaced short palindromic repeats,CRISPR)序列。隨后研究者陸續(xù)發(fā)現(xiàn)許多與CRISPR序列功能相關(guān)聯(lián)的基因,并將其統(tǒng)稱為CRISPR-相關(guān)因子(CRISPR-associated,Cas)。最初對(duì)于CRISPR-Cas功能的假設(shè)是其可能參與細(xì)胞的DNA限制性保護(hù)和復(fù)制子分配等過(guò)程。然而在2005年,有研究者提出CRISPR-Cas是一種適應(yīng)性免疫系統(tǒng)的假說(shuō),且這個(gè)假說(shuō)在2007年成功被Barrangou等驗(yàn)證。Barrangou等發(fā)現(xiàn)這個(gè)系統(tǒng)可以將新的噬菌體DNA整合到CRISPR陣列中,這使它們被同樣的病毒再次入侵時(shí)細(xì)菌就有了抗性,使其免遭攻擊。Bolotin等在研究嗜熱鏈球菌()的基因組時(shí),發(fā)現(xiàn)了一個(gè)不尋常的CRISPR基因座。盡管這個(gè)CRISPR陣列與先前報(bào)道的系統(tǒng)相似,但它不僅缺少一些已知的Cas基因,又包含新的Cas基因,包括編碼大分子蛋白質(zhì)的基因。Bolotin等預(yù)測(cè)該基因表達(dá)的蛋白具有核酸酶活性,這個(gè)基因就是Cas9。自此,對(duì)CRISPR-Cas9系統(tǒng)相關(guān)的研究開(kāi)始增加。
目前,CRISPR-Cas系統(tǒng)被分為I、II和III型三種主要類型,而 CRISPR-Cas9屬于 II型系統(tǒng)。CRISPR-Cas9系統(tǒng)在適應(yīng)性免疫時(shí)遵循著三個(gè)步驟:間隔序列的獲取,crRNA的形成與干擾(圖1)。具體步驟表現(xiàn)為當(dāng)外源病毒或質(zhì)粒DNA進(jìn)入細(xì)胞時(shí),細(xì)胞通過(guò)專門的Cas蛋白將外源DNA序列剪成小片段并整合到連續(xù)的DNA片段中,形成一個(gè)新的CRISPR間隔序列。然后這個(gè)新的間隔序列被轉(zhuǎn)錄成CRISPR RNA前體(Pre-crRNA)和反式激活RNA(Trans-activating RNA,tracrRNA),然后在核糖核酸酶 III(Ribonuclease III,RNaseIII)的作用下形成成熟的crRNA。最后crRNA協(xié)同tracrRNA通過(guò)特異性的方式引導(dǎo)Cas9蛋白去切割入侵的目標(biāo)DNA以達(dá)到免疫干擾的效果。在Cas9蛋白被證實(shí)能對(duì)特定的DNA進(jìn)行靶向斷裂后,Jinek等的研究指出,可以將CRISPR-Cas9系統(tǒng)中的crRNA和tracrRNA融合在一起,形成一個(gè)單一的合成導(dǎo)向RNA,即單導(dǎo)向 RNA(Single-guide RNA,sgRNA),進(jìn)一步簡(jiǎn)化了系統(tǒng),為CRISPR-Cas9技術(shù)廣泛應(yīng)用于基因靶向和基因編輯奠定了基礎(chǔ)。之后陸續(xù)有研究者將這種技術(shù)應(yīng)用于基因編輯技術(shù)。總的來(lái)說(shuō),CRISPR-Cas9技術(shù)由于具有實(shí)驗(yàn)簡(jiǎn)單,操作容易,用時(shí)短等優(yōu)勢(shì),已經(jīng)被研究者們廣泛應(yīng)用在植物、小鼠和人類細(xì)胞中,并進(jìn)行了臨床試驗(yàn)。
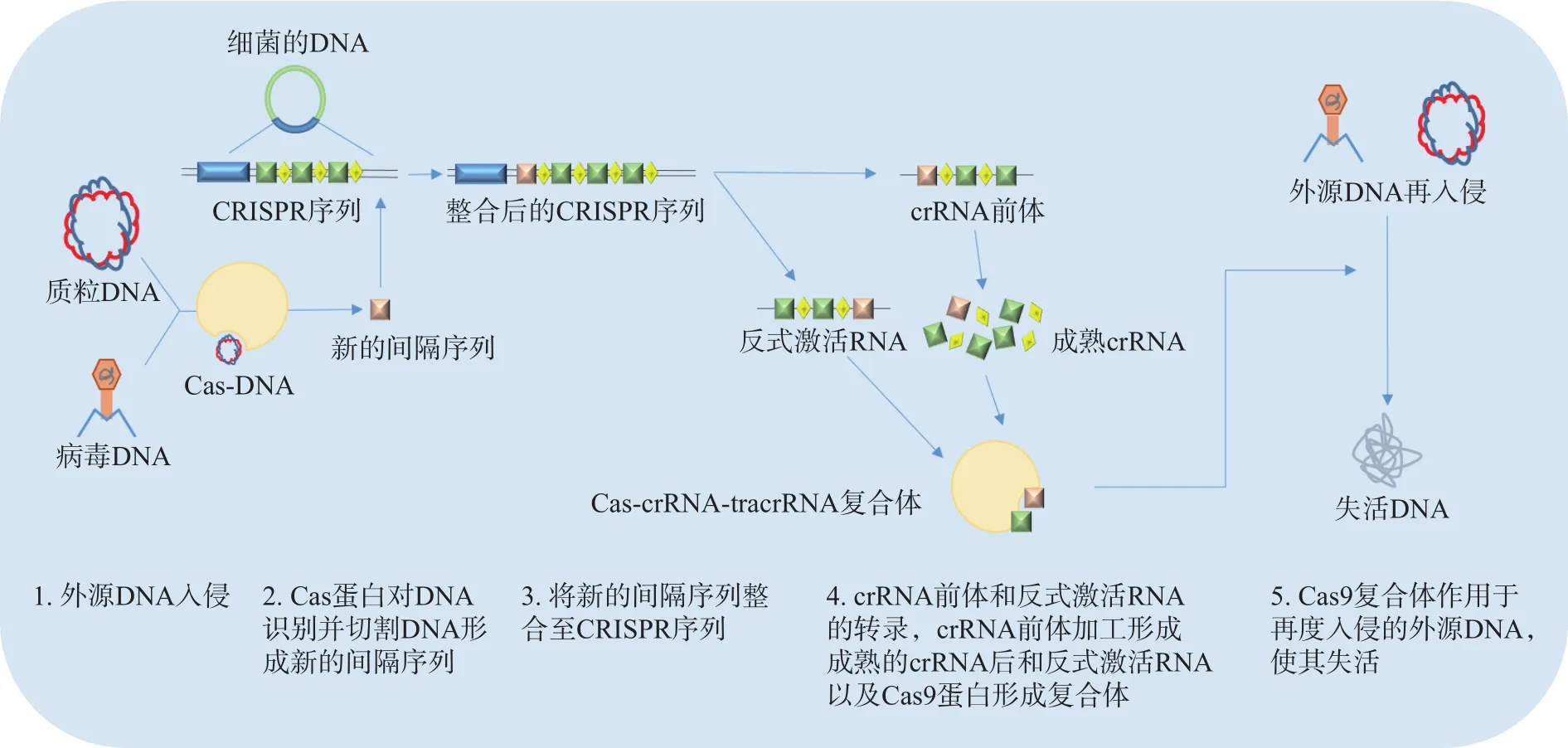
圖1 CRISPR-Cas9系統(tǒng)適應(yīng)性免疫的簡(jiǎn)化步驟Fig.1 Simplified steps for adaptive immunity of CRISPR-Cas9 system
3 CRISPR-Cas9技術(shù)應(yīng)用于乳酸桿菌基因的編輯
3.1 CRISPR-Cas9技術(shù)改造乳酸桿菌
多年來(lái),乳酸桿菌早已被用作為微生物工廠,用于生產(chǎn)各種蛋白質(zhì)和代謝產(chǎn)物以及生物催化劑。通過(guò)CRISPR-Cas9基因編輯技術(shù)去打造更優(yōu)質(zhì)的菌種,其目的在于改良乳酸桿菌的性狀、提升產(chǎn)物的質(zhì)和量,或者降低乳酸桿菌釋放污染物和有害物污染環(huán)境的風(fēng)險(xiǎn)。
利用CRISPR-Cas9技術(shù)可以把乳酸桿菌打造成具有優(yōu)良性狀的菌株。Goh 等將細(xì)胞表面相關(guān)的果糖糖苷酶基因敲入無(wú)法代謝低聚果糖(Fructooligosaccharide,F(xiàn)OS)的中,重組菌株能在含有FOS的mMRS培養(yǎng)基中生長(zhǎng),這表明了重組菌株擁有了對(duì)果糖的代謝能力。CRISPR-Cas9系統(tǒng)還可以被編輯成選擇性地靶向乳酸桿菌中的抗生素耐藥基因,Hidalgo-Cantabrana等利用CRISPR-Cas9技術(shù)敲掉乳酸桿菌的與抗生素耐藥性有關(guān)的基因,從而減少和轉(zhuǎn)移了乳酸桿菌的抗生素耐藥性。
在食品工業(yè)中,乳酸桿菌常常被用于生產(chǎn)胞外多糖(Exopolysaccharides,EPS),EPS 由于可賦予發(fā)酵乳制品特殊的質(zhì)構(gòu)和風(fēng)味,從而廣泛用于食品的增稠、穩(wěn)定、乳化、膠凝及持水。為了進(jìn)一步利用乳酸桿菌生產(chǎn)EPS的能力,有必要對(duì)其結(jié)構(gòu)與功能基因進(jìn)行深入了解以達(dá)到優(yōu)化生產(chǎn)的目的。Song等使用CRIPSR-Cas9技術(shù)對(duì)的EPS生物合成基因進(jìn)行了敲除,研究結(jié)果表明敲除后菌株的EPS產(chǎn)量明顯降低。Mayer等鑒定出約翰遜氏乳桿菌()中的一種假定基因細(xì)菌烯醇糖基轉(zhuǎn)移酶(FI9785-242,242)對(duì)EPS-1的合成很重要,在FI9785基因組中利用CRISPR-Cas9技術(shù)敲除基因以構(gòu)建菌株Δ242,而菌株Δ242細(xì)胞沉淀和上清液中均未檢測(cè)到EPS-1。Dertli等研究報(bào)道指出,F(xiàn)I9785 能夠產(chǎn)生兩種不同的EPS,分別是EPS-1和EPS-2,該研究進(jìn)一步鑒定出了與EPS合成相關(guān)的基因簇,而其中的基因是合成EPS-1和EPS-2的關(guān)鍵基因。這些或許是乳酸桿菌EPS生物合成的機(jī)制的一部分,為利用CRISPR-Cas9技術(shù)構(gòu)建菌體外生產(chǎn)合成EPS提供了一個(gè)新的思路。Zhou等采用CRISPR-Cas9技術(shù)對(duì)進(jìn)行了無(wú)縫基因組編輯,設(shè)計(jì)并構(gòu)建了可以產(chǎn)生n-乙酰氨基葡萄糖的菌株,在未引入外源標(biāo)記基因和質(zhì)粒的情況下,最終菌株的生產(chǎn)n-乙酰氨基葡萄糖的量為797.3 mg/L。Dato等研究表明釀酒酵母()腺苷甲硫氨酸同工酶 2(S-adenosylmethionine2,SAM2)的表達(dá)量與L-乳酸的合成量相關(guān),利用CRISPR-Cas9技術(shù)除掉菌株的基因后,菌株的乳酸產(chǎn)量比正常菌株平均增加了5.4%,并且敲除掉基因基本不會(huì)影響菌株的活力。總的來(lái)說(shuō),通過(guò)對(duì)乳酸桿菌生產(chǎn)代謝產(chǎn)物的基因結(jié)構(gòu)運(yùn)用生物工程的方法進(jìn)行優(yōu)化,是一種非常有效且具有前景的策略手段。
除產(chǎn)生有益物質(zhì)外,乳酸桿菌也會(huì)產(chǎn)生一些對(duì)人體有害的物質(zhì),例如D-乳酸。因?yàn)槿撕蛣?dòng)物體內(nèi)并不存在D-乳酸脫氫酶,因此不能分解代謝D-乳酸,人體攝入過(guò)多D-乳酸會(huì)導(dǎo)致出現(xiàn)代謝紊亂,甚至中毒的癥狀。通常來(lái)說(shuō),乳酸桿菌會(huì)同時(shí)產(chǎn)生兩種乳酸,分別是L-乳酸和D-乳酸,而調(diào)控生產(chǎn)這兩種乳酸的關(guān)鍵基因是一個(gè)D-乳酸脫氫酶基因和 L-乳酸脫氫酶基因。研究表明,通過(guò)CRISPR-Cas9技術(shù)敲除或替換掉是降低乳酸桿菌生產(chǎn)D-乳酸的一種有效方法。張一凡通過(guò)CRISPR-Cas9技術(shù)構(gòu)建了一株被敲除掉基因、過(guò)表達(dá)L-乳酸脫氫酶的突變菌株,發(fā)現(xiàn)突變菌株產(chǎn)生L-乳酸的產(chǎn)量提高了16.3%,光學(xué)純度也由95.2%提升至99.0%,大大提高了高純度L-乳酸的產(chǎn)量,降低了D-乳酸的生成。上述的研究表明利用CRISPR-Cas9技術(shù)可有效降低乳酸桿菌中對(duì)人體有害物質(zhì)的產(chǎn)生。
盡管D-乳酸對(duì)人體有害,但不能否認(rèn)它在生物可降解塑料工業(yè)中的價(jià)值。隨著基因編輯技術(shù)的進(jìn)步,通過(guò)基因工程打造合適的乳酸桿菌用于生產(chǎn)D-乳酸在近幾年也成為了研究熱點(diǎn)之一。Huang等研究表明的同源基因和在過(guò)表達(dá)的情況下能讓菌株生產(chǎn)更多D-乳酸。Assavasirijinda等將的基因通過(guò)CRISPR-Cas9技術(shù)導(dǎo)入工程化的嗜堿芽孢桿菌()菌株,并通過(guò)破壞負(fù)責(zé)合成胞外多糖的關(guān)鍵基因,以增加產(chǎn)量并簡(jiǎn)化下游生產(chǎn)過(guò)程。Ozaki等通過(guò)CRISPR-Cas9基因組編輯技術(shù)將中的基因?qū)胫晾蹙屏阎辰湍福ǎ⑼ㄟ^(guò)CRISPR基因敲除破壞了菌株中競(jìng)爭(zhēng)D-乳酸合成相關(guān)的丙酮酸脫氫酶的基因和和編碼L-乳酸的基因,顯著促進(jìn)了菌株利用葡萄糖轉(zhuǎn)化生成D-乳酸的效率。
近年來(lái),基于CRISPR-Cas9技術(shù)去修飾編輯菌株,改善其性狀、將其改造作為“生產(chǎn)工廠”來(lái)產(chǎn)生所需物質(zhì)的報(bào)道越來(lái)越多。而乳酸桿菌作為一種公認(rèn)的益生菌,利用CRISPR-Cas9技術(shù)對(duì)其合理化改造將會(huì)是未來(lái)的研究的主要的方向。
3.2 CRISPR-Cas9技術(shù)應(yīng)用于乳酸桿菌基因編輯存在的問(wèn)題
大多數(shù)天然的乳酸桿菌都屬于“公認(rèn)安全”標(biāo)準(zhǔn)(Generally recognized as safe,GRAS)的范疇,因此,這類乳酸桿菌在食品工業(yè)、醫(yī)藥等方面已經(jīng)被廣泛運(yùn)用。但目前還沒(méi)有轉(zhuǎn)基因乳酸桿菌被美國(guó)食品藥品監(jiān)督管理局認(rèn)定為GRAS,主要是因?yàn)槿樗釛U菌基因組被改造后,其遺傳的穩(wěn)定性、對(duì)人體潛在的安全性尚未得知,且現(xiàn)有的基因編輯技術(shù)依然存在問(wèn)題缺陷,如目標(biāo)損壞、脫靶編輯、低效率等問(wèn)題,即使是目前最先進(jìn)的第三代基因編輯技術(shù)CRISPR-Cas9也不能保證每次都能完美地打造出產(chǎn)品。
如何提高準(zhǔn)確率,避免脫靶是目前基因編輯技術(shù)面臨的最大挑戰(zhàn)。雖然CRISPR-Cas9相較于ZFNs和TALENs技術(shù)對(duì)靶向基因操作更加簡(jiǎn)單便捷,CRISPR-Cas9只需要將引導(dǎo)RNA序列與特定的靶區(qū)匹配,就可以將Cas酶引導(dǎo)到該位點(diǎn),引入雙鏈斷裂,但同樣存在脫靶的風(fēng)險(xiǎn),影響基因編輯成功率。在利用CRISPR-Cas9打造乳酸桿菌時(shí),可能會(huì)發(fā)生靶向位點(diǎn)的大量缺失、基因組重排列、切割位點(diǎn)遠(yuǎn)端病變等脫靶效應(yīng),從而使乳酸桿菌產(chǎn)生有害物質(zhì)或造成乳酸桿菌的死亡,甚至?xí)蛟斐梢环N有害的微生物。而當(dāng)這些有害物質(zhì)或者重組的有害微生物沒(méi)有及時(shí)處理,被意外或人為地釋放到自然界中,有可能會(huì)打破生態(tài)平衡,最終對(duì)人類造成嚴(yán)重的威脅。其中一個(gè)影響脫靶的重要原因是CRISPR-Cas9系統(tǒng)依賴于內(nèi)源性DNA修復(fù)因子不能被有效地控制,也不能預(yù)測(cè)該因子產(chǎn)生的錯(cuò)誤。為了解決缺乏穩(wěn)健的DNA修復(fù)機(jī)制的問(wèn)題,Goh等在乳酸桿菌中的非同源性末端接合(Non-homologous end joining,NHEJ)的DNA損傷修復(fù)機(jī)制中,利用化膿性鏈球菌()的切口酶變體Cas9在嗜酸乳桿菌()中進(jìn)行靶向基因刪除和插入,從而減少因?yàn)殡p鏈斷裂引起的死亡。盡管現(xiàn)在已有科學(xué)家研究開(kāi)發(fā)出緩解脫靶問(wèn)題的方法,但是造成脫靶有著許多因素的影響,如細(xì)胞類型、CRISPRCas9組件的表達(dá)水平、傳遞方法等,一個(gè)因素或多個(gè)因素共同影響都會(huì)導(dǎo)致脫靶。目前,CRISPR-Cas9系統(tǒng)號(hào)稱能實(shí)現(xiàn)多個(gè)基因的編輯,但在大規(guī)模地打造乳酸桿菌的過(guò)程中,其精確性、效率仍然有上升的空間。Leenay等在中使用CRISPRCas9技術(shù)進(jìn)行基因編輯,但多次編輯同一位點(diǎn)并不總是成功的,編輯的結(jié)果也會(huì)因運(yùn)用的方法和打造的菌株種類而產(chǎn)生差異。總的來(lái)說(shuō),有效地解決脫靶問(wèn)題,同時(shí)提高基因編輯的效率和精確性,是研究者們目前亟待解決的問(wèn)題。
CRISPR-Cas9技術(shù)修飾乳酸桿菌仍需要面對(duì)許多挑戰(zhàn),且該技術(shù)的有些機(jī)制人類尚未完全掌握,如潛在靶位點(diǎn)識(shí)別機(jī)制和原間隔序列鄰近基(Protospacer-adjacent motif,PAM)依賴的基礎(chǔ)等。盡管目前從科學(xué)的角度看,轉(zhuǎn)基因乳酸桿菌有著更加合理、優(yōu)良的性狀,能成為代謝產(chǎn)物的生產(chǎn)工廠,但人們依然對(duì)轉(zhuǎn)基因乳酸桿菌聞之色變,認(rèn)為其已被基因操控,對(duì)人體產(chǎn)生的風(fēng)險(xiǎn)是一個(gè)未知數(shù)。因此,在廣泛應(yīng)用轉(zhuǎn)基因乳酸桿菌之前,政府和科學(xué)家們都要進(jìn)行批判性的風(fēng)險(xiǎn)評(píng)估。隨著CRISPR-Cas9技術(shù)地不斷發(fā)展,科學(xué)家們需要不斷地研究克服技術(shù)缺陷,這將會(huì)打造出更加穩(wěn)定的轉(zhuǎn)基因乳酸桿菌。
3.3 CRISPR-Cas9技術(shù)應(yīng)用于乳酸桿菌未來(lái)展望
3.3.1 改善乳酸桿菌的抗脅迫性 乳酸桿菌被廣泛地應(yīng)用于食品工業(yè)的過(guò)程中,需要面對(duì)在生產(chǎn)、儲(chǔ)存和分配過(guò)程中所形成的物理、化學(xué)多種脅迫,影響乳酸桿菌發(fā)揮生理功能。乳酸桿菌作為發(fā)酵劑在發(fā)酵過(guò)程中,其穩(wěn)定性影響著發(fā)酵工藝,而作為益生菌被人體食用后,則需要在對(duì)腸道的惡劣條件中存活才能發(fā)揮其活性。因此,運(yùn)用CRISPR-Cas9技術(shù)對(duì)乳酸桿菌的基因進(jìn)行改造,使乳酸桿菌具有更強(qiáng)的穩(wěn)定性,從而適應(yīng)不同條件的生存環(huán)境。
乳酸桿菌在工業(yè)發(fā)酵時(shí)自身會(huì)產(chǎn)生有機(jī)酸,常常面臨酸脅迫,導(dǎo)致乳酸桿菌的細(xì)胞活力和發(fā)酵產(chǎn)量降低。谷氨酸脫羧酶(The glutamate decarboxylase,GAD)系統(tǒng)是乳酸桿菌最重要的抗酸系統(tǒng)之一。正因?yàn)镚AD的抗酸能力的存在,乳酸桿菌才能在酸脅迫環(huán)境下抑制雜菌生長(zhǎng)的同時(shí)自身也能夠正常發(fā)酵生長(zhǎng)。Gong等在研究短乳桿菌()的GAD系統(tǒng)時(shí),發(fā)現(xiàn)的GAD系統(tǒng)中潛在的轉(zhuǎn)錄調(diào)節(jié)基因所表達(dá)的GadR蛋白一旦失活,會(huì)極大地降低制藥工業(yè)中的一種重要化合物—-氨基丁酸(Gamma-aminobutyric acid,GABA)的產(chǎn)生,同時(shí)也降低了的耐酸性。該研究表明GadR是調(diào)控的耐酸性和GABA合成的正反饋調(diào)節(jié)劑。可以預(yù)想的是,通過(guò)CRISPR-Cas9構(gòu)建高表達(dá)GadR的乳酸桿菌是增強(qiáng)菌種抗酸性及工業(yè)化規(guī)模生產(chǎn)GABA的有效方法。Gong等研究表明中的氮代謝全局性轉(zhuǎn)錄調(diào)控蛋白基因表達(dá)的GlnR蛋白能夠影響細(xì)菌的抗酸性和GABA的產(chǎn)生。該研究證實(shí)了GlnR是一種負(fù)調(diào)控GAD表達(dá)的蛋白,能夠降低細(xì)菌的抗酸性和GABA的轉(zhuǎn)化合成。因此,通過(guò)CRISPR-Cas9技術(shù)敲除掉基因也是一種增強(qiáng)菌株抗脅迫能力的有效方法。
溫度也是影響乳酸桿菌活性的重要條件之一。在食品工業(yè)中,為了保持食品的安全衛(wèi)生,發(fā)酵食品常常需要經(jīng)過(guò)加熱、巴氏消毒法進(jìn)行殺菌,這也導(dǎo)致乳酸桿菌的數(shù)量和細(xì)胞活力急速下降,因此提高乳酸桿菌的抗熱性在食品生產(chǎn)加工中尤為重要。熱休克反應(yīng)(Heat shock response,HSR)是乳酸桿菌面對(duì)熱壓力產(chǎn)生的防御適應(yīng)反應(yīng),誘導(dǎo)熱休克蛋白(Heat shock proteins,HSPs)的基因表達(dá),形成如小熱休克蛋白、Clp ATP酶等幫助受損細(xì)胞蛋白重新折疊的分子蛋白和ClpP、FtsH等來(lái)降解不可逆轉(zhuǎn)的受損蛋白質(zhì)的蛋白酶,從而改善乳酸桿菌對(duì)外界熱變化的適應(yīng)性。Chastanet等證實(shí),HSP中的基因和基因受到三級(jí)應(yīng)激基因阻遏物CtsR和HrcA的雙重調(diào)控作用。當(dāng)發(fā)生熱休克反應(yīng),HrcA會(huì)失活,同時(shí)CtsR調(diào)控ClpEP復(fù)合物進(jìn)行表達(dá),進(jìn)而ClpEP復(fù)合物把CtsR降解。因CtsR是一種高度保守的轉(zhuǎn)錄抑制因子,當(dāng)CtsR被降解后,其控制Clp ATP酶才能全部表達(dá)來(lái)提高乳酸桿菌對(duì)熱的適應(yīng)性。Desmond等對(duì)的操縱子進(jìn)行PCR擴(kuò)增誘導(dǎo)表達(dá),當(dāng)重組菌株受到熱應(yīng)激時(shí),生產(chǎn)過(guò)量GroESL蛋白,大大提高耐熱性。因此,可以通過(guò)CRISPR-Cas9技術(shù)修飾HSPs相關(guān)基因,增強(qiáng)對(duì)HSPs的誘導(dǎo),從而使乳酸桿菌能在高溫下保持活性。
在食品加工中改善乳酸桿菌的抗脅迫性是非常有必要的。在外界的壓力下,乳酸桿菌的抗脅迫性越強(qiáng),就越能在食品加工中保持細(xì)胞活性,從而在開(kāi)發(fā)的產(chǎn)品中展現(xiàn)出其獨(dú)特的生理功能。
3.3.2 利用CRISPR-Cas9技術(shù)增強(qiáng)乳酸桿菌的抗菌活性 乳酸桿菌被廣泛用于食品和制藥工業(yè)中,很大原因是乳酸桿菌具有良好的抗菌活性,而乳酸桿菌的抗菌機(jī)制很復(fù)雜,其中很重要的一個(gè)方面則是能產(chǎn)生細(xì)菌素。細(xì)菌素是核糖體合成的蛋白質(zhì)或短肽鏈,具有一定的抗菌活性,可以通過(guò)與特定的表面受體相互作用導(dǎo)致細(xì)胞的破裂,從而抑制特定的或有著相關(guān)結(jié)構(gòu)的菌株的生長(zhǎng),因此可被食品工業(yè)用于生物防腐。
目前研究最多且應(yīng)用最廣泛的乳酸鏈球菌細(xì)菌素(Nisin,亦稱乳鏈菌肽)被認(rèn)為是食品和制藥工業(yè)中用于防止食物變質(zhì)和雜菌污染生長(zhǎng)的重要化合物。近年來(lái),隨著對(duì)細(xì)菌素研究的深入,通過(guò)生物工程的方法對(duì)Nisin進(jìn)行編輯修飾的研究越來(lái)越多。Reiners等對(duì)乳酸乳球菌()的Nisin的基因序列的N端區(qū)域進(jìn)行定點(diǎn)誘變,誘導(dǎo)表達(dá)得到Nisin A和Nisin H。測(cè)試兩種Nisin的對(duì)金黃色葡萄球菌()的最小抑菌濃度,結(jié)果顯示Nisin A的最小抑菌濃度是6.25 μmol/L,而Nisin H為0.78 μmol/L,顯然,經(jīng)過(guò)定點(diǎn)突變的Nisin H比Nisin A抗菌效力更好。同樣,O’sullivan等發(fā)現(xiàn)由頭狀葡萄球菌()菌株所產(chǎn)生的乳鏈菌肽變體Nisin J對(duì)多種革蘭氏陽(yáng)性病原體都表現(xiàn)出較強(qiáng)的抗菌活性,使用打孔擴(kuò)散法測(cè)試Nisin A和Nisin J對(duì)金黃色葡萄球菌的抗菌能力,Nisin J的抑菌圈面積為153.1 mm,而Nisin A的抑菌圈面積只有109.4 mm。而Nisin J相比于典型的Nisin A在結(jié)構(gòu)上的區(qū)別在于其中有9個(gè)氨基酸都發(fā)生了變化,這導(dǎo)致了Nisin J缺少了乳鏈菌肽調(diào)節(jié)基因和乳鏈菌肽免疫基因,從而形成了一種新型的抗菌細(xì)菌素。上述研究是基于通過(guò)PCR定點(diǎn)誘變的方法得到乳鏈菌肽,這也說(shuō)明了通過(guò)生物工程的方法去改造乳酸桿菌進(jìn)而得到更完善的益生菌是可能的。Oh等利用CRISPRCas9對(duì)羅伊氏乳桿菌()的和基因進(jìn)行定點(diǎn)飽和誘變,對(duì)含有NNK基序(N=A/T/G/C和K=G/T)的寡核苷酸進(jìn)行一次轉(zhuǎn)化,其中一個(gè)密碼子被修飾為編碼所有20個(gè)氨基酸,結(jié)果發(fā)現(xiàn)這一重組體增強(qiáng)的抗菌活性。Van等對(duì)構(gòu)建單鏈DNA(ssDNA)重組工程,在pdu操縱子上游的啟動(dòng)子區(qū)域進(jìn)行了6個(gè)堿基變化,從而使抗微生物化合物羅伊氏菌素的產(chǎn)量增加了3倍,且與野生型菌株相比,對(duì)的殺傷效率提高了3倍。隨著技術(shù)的不斷完善,研究者通過(guò)CRISPRCas9技術(shù)對(duì)一些有益的乳酸桿菌的染色體中的密碼子進(jìn)行精確誘變,打造出具有強(qiáng)抗菌性的乳酸桿菌是可以實(shí)現(xiàn)的。
乳酸桿菌產(chǎn)生的細(xì)菌素在抑菌譜、產(chǎn)量、穩(wěn)定性等方面還能進(jìn)一步改進(jìn)和提升,上述的研究成果為利用CRISPR-Cas9技術(shù)去修飾乳酸桿菌的抗菌活性,并將其改造為一種更有價(jià)值的益生菌菌株的研究與開(kāi)發(fā)提供了新思路。
3.3.3 改變?nèi)樗釛U菌的免疫調(diào)節(jié)特性 對(duì)乳酸桿菌中有助于免疫調(diào)節(jié)的相關(guān)基因進(jìn)行編輯修飾,是改變?nèi)樗釛U菌免疫調(diào)節(jié)特性的方法之一。一些乳酸桿菌對(duì)宿主具有調(diào)節(jié)、改善或防止免疫有關(guān)的疾病的功效,Steidler等構(gòu)建重組分泌小鼠白細(xì)胞介素10(IL-10),當(dāng)小鼠口服重組菌株可顯著減少腸道炎癥,這是最先將轉(zhuǎn)基因乳酸菌運(yùn)用在調(diào)節(jié)免疫治療中,為治療炎癥性腸病(Inflammatory bowel disease, IBD)提供新的思路。盡管現(xiàn)在科學(xué)家們還缺乏對(duì)細(xì)菌類的免疫特性整體機(jī)制的理解,但有相關(guān)研究表明,細(xì)菌的外細(xì)胞表面蛋白在細(xì)菌與宿主之間的相互作用中起了關(guān)鍵的作用。細(xì)菌的細(xì)胞外壁通常由細(xì)胞壁和細(xì)胞膜組成,但在許多古細(xì)菌和真細(xì)菌中發(fā)現(xiàn)還有一層表面層(Surface layers)結(jié)構(gòu),也稱為s-層(S-layers),該層是通過(guò)一類特殊的蛋白質(zhì)(稱為S層蛋白)之間的相互作用所構(gòu)建的二維晶格結(jié)構(gòu)所組成。許多研究結(jié)果都表明了S層蛋白具有介導(dǎo)免疫調(diào)節(jié)的功能,為改變?nèi)樗釛U菌免疫調(diào)節(jié)特性提供了潛在的目標(biāo)。SIGNR3是小鼠8個(gè)同源的樹(shù)突細(xì)胞受體(DC-sepecific ICAM-grabbing non-integrin,DC-SIGN)之一,與人DC-SIGN的生物特征高度相似。Lightfoot等研究發(fā)現(xiàn)了的S層蛋白可與小鼠的SIGNR3連接,進(jìn)而表達(dá)出調(diào)控信號(hào),緩解小鼠的結(jié)腸炎癥。而Johnson等的研究中也發(fā)現(xiàn)了中與S層相關(guān)的絲氨酸蛋白酶同源物PrtX(PrtX, lba1578)突變?cè)鰪?qiáng)了對(duì)白細(xì)胞介素 6(Interleukin 6,IL-6)、IL-12 和 IL-10的刺激,可能導(dǎo)致改變上皮腸細(xì)胞基質(zhì)的結(jié)構(gòu)和特性。此外,Uroi?等發(fā)現(xiàn)了在有S層蛋白的情況下會(huì)對(duì)機(jī)體產(chǎn)生特別的保護(hù)以及增強(qiáng)了對(duì)腸細(xì)胞的粘附作用,并且的S層蛋白可以在單核細(xì)胞衍生的樹(shù)突狀細(xì)胞(Monocyte-deriveddendritic cells,moDC)中誘導(dǎo)腫瘤壞死因子-(Tumor necrosis factor-,TNF-)的生成。除了發(fā)酵乳桿菌()和等某些物種不會(huì)產(chǎn)生S層結(jié)構(gòu),許多原核生物中都存在S層結(jié)構(gòu),且S-層的結(jié)構(gòu)都是保守的,不會(huì)輕易地變異。通過(guò)運(yùn)用CRISPR-Cas9基因編輯技術(shù)去精確改變某些乳酸桿菌S層蛋白的表達(dá),可以做到穩(wěn)定長(zhǎng)期地增強(qiáng)這類菌株的益生功能。
總的來(lái)說(shuō),對(duì)一些精選出來(lái)的益生菌或非益生菌的結(jié)構(gòu)更深入的了解,利用CRISPR-Cas9技術(shù)敲入高誘導(dǎo)性啟動(dòng)子來(lái)驅(qū)動(dòng)這些基因的過(guò)表達(dá),進(jìn)而調(diào)整優(yōu)化這些結(jié)構(gòu)來(lái)達(dá)到改變其免疫特性的目的。
4 結(jié)語(yǔ)
乳酸桿菌作為一種與人類生活密切聯(lián)系的微生物,在農(nóng)業(yè)、工業(yè)和醫(yī)藥等領(lǐng)域都發(fā)揮著重要的作用。而隨著人們生活水平的不斷提高以及對(duì)美好生活的需要,開(kāi)發(fā)一些更符合人民需求且更優(yōu)良的新型乳酸桿菌變得尤為重要。近年來(lái),通過(guò)CRISPR-Cas9基因編輯技術(shù)打造改良菌株的技術(shù)方法引起了國(guó)內(nèi)外學(xué)者的廣泛關(guān)注,大批研究者通過(guò)該技術(shù)改造乳酸桿菌,但轉(zhuǎn)基因乳酸桿菌的應(yīng)用仍處于實(shí)驗(yàn)室驗(yàn)證階段。目前作為新一代的基因編輯技術(shù)CRISPR-Cas9仍然存在脫靶的問(wèn)題,精確性和效率有待提高。因此,科學(xué)家們不斷地追求著更加精準(zhǔn)、高效的CRISPRCas9介導(dǎo)乳酸桿菌的基因編輯方法,并將其運(yùn)用到不同種類的乳酸桿菌中。為了滿足人類的需要,改善乳酸桿菌的特性和功能,通過(guò)CRISPR-Cas9技術(shù)打造出具有高抗脅迫性、高抗菌活性、不同的免疫活性等特性的乳酸桿菌,將會(huì)是未來(lái)發(fā)展的趨勢(shì)。可以預(yù)見(jiàn)的是,隨著CRISPR-Cas9技術(shù)進(jìn)一步地發(fā)展以及對(duì)一些精選出來(lái)的乳酸桿菌的基因結(jié)構(gòu)進(jìn)行更深入的了解后,將有望打造出更優(yōu)良且能夠被公眾所接受的乳酸桿菌菌株。

