羽扇豆醇對結直腸癌HCT116細胞的抑制作用及機制研究*
韓澤平,蔡 貞
1.南方醫科大學南方醫院檢驗科,廣東廣州 510515;2.廣州市番禺區中心醫院中心實驗室,廣東廣州 511400
結直腸癌是全球最常見的消化道惡性腫瘤,發病率居惡性腫瘤的第3位,也是癌癥相關死亡的第二大原因[1]。手術及放化療是目前治療結直腸癌的主要方法,但由于外科手術的局限性、放療劑量的限制、化療藥物的不良反應及耐藥性等影響,導致結直腸癌治療及預后仍不理想[2]。近年來,傳統中草藥及其有效成分的抗癌、調節免疫等作用逐漸引起人們的關注[3-4]。羽扇豆醇是一種來源于羽扇豆、蒲公英等草本植物中的五環三萜類化合物,相對分子質量為426.72,分子式為C30H50O,具有抗炎、抗氧化、抗感染和調節免疫力等作用,提示其具有不同的藥理活性及多種作用機制[5-6]。在抗腫瘤研究中,羽扇豆醇對多種腫瘤具有良好的治療效果[7-8],并且具有保護心臟、肝臟、神經等作用[9-10],但羽扇豆醇抗結直腸癌的作用機制尚未闡明。本文進一步研究羽扇豆醇對結直腸癌HCT116細胞生物學功能的影響,通過TMT標記定量蛋白質組學分析明確羽扇豆醇抑制結直腸癌增殖和轉移的潛在分子機制,推動中醫藥抗腫瘤研究的發展,并為結直腸癌的治療提供新思路。
1 材料與方法
1.1儀器與試劑 羽扇豆醇(南京狄爾格醫藥科技有限公司);胎牛血清、RPMI1640培養基、DMEM培養基、胰蛋白酶(美國HyClone公司);Matrigel基質膠(美國Corning公司);Annexin V-FITC細胞凋亡檢測試劑盒、BCA蛋白定量試劑盒(凱基生物科技發展有限公司);缺氧誘導因子(HIF)-1α、α-烯醇化酶(ENO1)、乳酸脫氫酶A(LDHA)、β-actin抗體(美國Bioworld Technology公司);CO2培養箱和生物安全柜(美國Thermo公司);Bio-Tek酶標儀ELX-800(美國Biotech公司);倒置熒光顯微鏡(德國Leica公司);ImageQuant LAS 500生物分子成像儀(美國GE公司);750D照相機(日本Canon公司)。
1.2細胞培養與藥物配制 人結直腸癌HCT116細胞、人結腸癌上皮FHC細胞、人腹膜間皮HMrSV5細胞購自武漢普諾賽生物科技有限公司。細胞培養于含10%胎牛血清、1%鏈霉素(100 μg/mL)和青霉素(100 U/mL)的 RPMI1640 培養基中,置于37 ℃、飽和濕度、5%CO2培養箱內培養。使用0.25%胰蛋白酶消化傳代,取對數生長期的細胞用于試驗。羽扇豆醇使用無水乙醇和二甲亞砜(DMSO)(1∶1)混合液充分溶解,配制成 23 434.71 μmol/L的貯存液,置于-20 ℃分裝保存。采用RPMI1640完全培養基稀釋至相應的工作濃度。
1.3方法
1.3.1CCK-8法 以細胞濃度5×103個/孔接種至96孔板,設空白對照組(不加細胞),陰性對照組(不加藥物,即0 μmol/L羽扇豆醇組)、溶劑組(DMSO+無水乙醇)、羽扇豆醇組(藥物濃度分別為10、20、40、80、160 μmol/L),每組各5個復孔,分別于37 ℃,5% CO2培養箱中孵育24、48、72 h。吸棄舊培養基,每孔加入新鮮培養基100 μL和CCK-8試劑10 μL,于37 ℃孵育3 h,酶標儀檢測450 nm處各孔吸光度值(A值),并計算抑制率和半數抑制濃度(IC50)。抑制率=(A陰性對照組-A羽扇豆醇組)/(A陰性對照組-A空白對照組)×100%。
1.3.2克隆形成試驗 將細胞按8×102個/孔接種于12孔板中,細胞貼壁后,按羽扇豆醇終濃度為0、20、40、60 μmol/L分為0、20、40、60 μmol/L羽扇豆醇組(簡稱0、20、40、60 μmol/L組)4組,每組設置 3個復孔。培養7 d后,棄去培養液,用磷酸鹽緩沖液(PBS)浸洗2次,95%乙醇固定10 min,風干后用0.1%結晶紫染色10 min,蒸餾水沖洗3次,風干后拍照,計數細胞克隆數量。
1.3.3劃痕愈合試驗 細胞于12孔版中培養,待融合率達到90%以上時,用槍頭垂直劃痕,PBS洗去劃下的細胞,分別加入終濃度為0、20、40、60 μmol/L羽扇豆醇的無血清培養基繼續培養。分別在0、24、48 h于倒置顯微鏡拍攝細胞劃痕愈合情況,并使用Image J軟件計算細胞間距離均值。遷移率=(1-測量的寬度/0 h的平均測量寬度)×100%。
1.3.4Transwell試驗 用預冷的無血清培養基以1∶3的體積比稀釋Matrigel基質膠,取40 μL加入預冷的Transwell小室中,37 ℃孵育2 h,使Matrigel基質膠凝固。吸走小室中多余的液體,并在上室、下室分別加入100、600 μL無血清培養基,37 ℃平衡過夜。計數1×105個細胞,用100 μL無血清培養基重懸,加入Transwell小室上室,分別將終濃度為0、20、40、60 μmol/L羽扇豆醇加載到細胞懸液中。在下室加入600 μL完全培養基。在37 ℃,5%CO2培養箱中孵育48 h后,取出小室,用棉簽擦去上室的細胞,倒置顯微鏡觀察小室中的細胞并拍照,計數侵襲細胞的總數。
1.3.5流式細胞術 以2×105個/孔細胞濃度接種于6孔板中,終濃度0、20、40、60 μmol/L羽扇豆醇干預細胞48 h后收集細胞,按照Annexin V-FITC細胞凋亡檢測試劑盒說明書進行操作,并采用流式細胞術檢測細胞凋亡情況。
1.4TMT標記定量蛋白質組學及生物信息學分析
1.4.1細胞處理 以2×105個/孔細胞濃度接種于6孔板中,并分為陰性對照組(不加藥物)和羽扇豆醇組(加入48 μmol/L羽扇豆醇),每組設置3個復孔,于37 ℃,5%CO2培養箱中孵育48 h后收集細胞,收獲細胞沉淀并于-80 ℃保存。
1.4.2數據檢索和差異蛋白篩選 上述標本送廣州輝駿生物科技股份有限公司進行TMT標記定量蛋白質組學檢測,并篩選出差異蛋白,篩選條件設置為:(1)至少 2 次重復鑒定到的蛋白;(2)肽段數≥2;(3)選擇重復性好的蛋白,即CV<0.5 %;(4)P<0.05;(5)計算各組數據比值的均值(AVG),以AVG≥1.200為上調蛋白,AVG≤0.833為下調蛋白。
1.4.3Gene Ontology(GO)功能富集及KEGG信號通路注釋分析 通過R軟件,從GO、KEGG數據庫中獲取每個差異蛋白所對應的功能,設置篩選條件為P<0.05,并計算每種功能上的蛋白富集數,最后將排名前20的GO分析結果和 KEGG 通路繪制成氣泡圖。
1.4.4蛋白質互作網絡(PPI)分析 應用STRING數據庫(https://cn.string-db.org/)將蛋白與庫中的相應物種蛋白進行比對,并提取蛋白序列,進行PPI分析。
1.5蛋白質免疫印跡法檢測相關蛋白的表達水平 細胞接種于6孔板中,以終濃度0、20、40、60 μmol/L羽扇豆醇干預細胞48 h后收集細胞,加入裂解液冰上裂解30 min,12 000×g,4 ℃離心20 min,取上清液,BCA法蛋白定量。95 ℃變性5 min,每組取40 μg總蛋白樣本于10%聚丙烯酰胺凝膠電泳,用聚偏乙烯(PVDF)膜進行轉膜,5%脫脂奶粉對膜封閉1 h,加入稀釋比為1∶1 000的一抗和稀釋比為1∶5 000的內參后,4 ℃孵育過夜。TBST清洗PVDF膜2次,每次15 min,用辣根過氧化物酶標記的二抗在室溫下孵育2 h,TBST清洗PVDF膜2次后,加入ECL化學發光試劑,通過ImageQuant LAS 500生物分子成像儀曝光顯色。
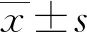
2 結 果
2.1羽扇豆醇對結直腸癌HCT116細胞生物學功能的影響
2.1.1羽扇豆醇抑制HCT116細胞的增殖 分別使用終濃度為0、10、20、40、80、160 μmol/L的羽扇豆醇作用HCT116細胞24、48、72 h,如圖1A所示,不同濃度的羽扇豆醇對HCT116細胞有不同程度的增殖抑制作用,并呈明顯的時間-劑量依賴性。另外,羽扇豆醇作用HCT116細胞24、48、72 h后的IC50分別為(60.71±4.11)、(48.4±2.26)和(40.79±2.97)μmol/L,IC50隨作用時間延長而明顯下降,差異有統計學意義(P<0.05),見圖1B。圖1C顯示,分別經溶劑和不同濃度的羽扇豆醇干預48 h后,人正常結腸上皮FHC細胞及人腹膜間皮HMrSV5細胞的存活率比較,差異無統計學意義(P>0.05)。
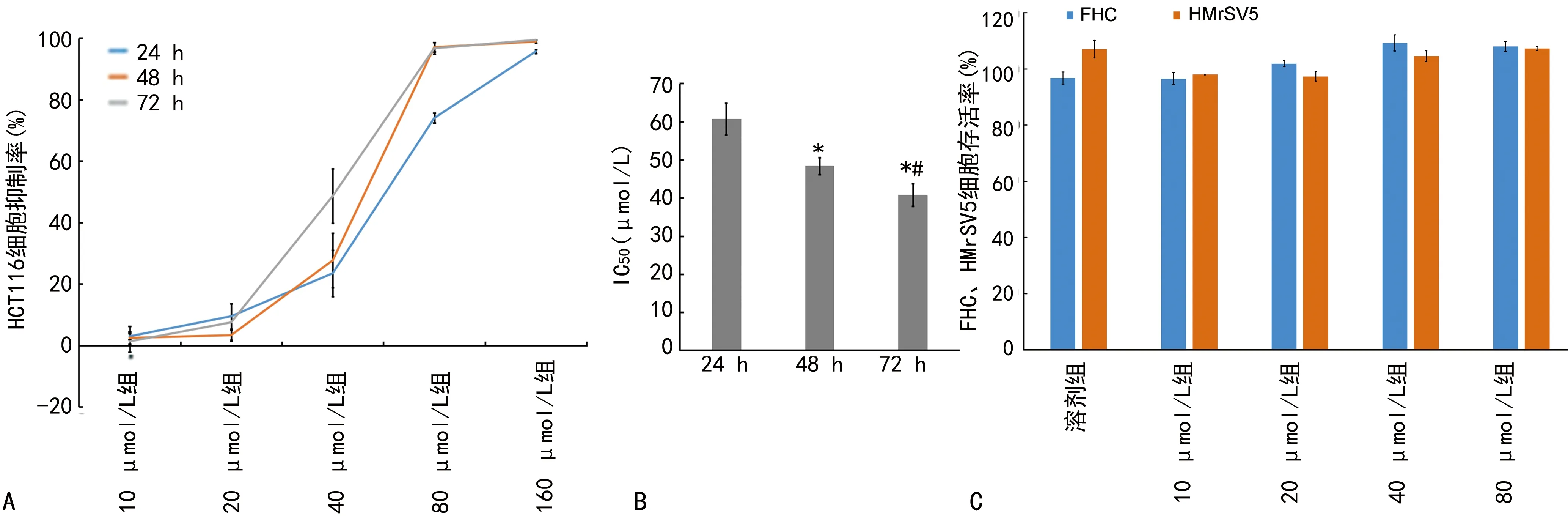
注:A為羽扇豆醇對HCT116細胞的抑制率;B為羽扇豆醇作用HCT116細胞24、48、72 h后的IC50比較;C為羽扇豆醇對FHC、HMrSV5細胞的存活率。與24 h比較,*P<0.05;與48 h比較,#P<0.05。
2.1.2羽扇豆醇抑制HCT116細胞的克隆形成能力 與0 μmol/L組比較,20 μmol/L組對HCT116細胞的克隆形成能力影響不明顯,差異無統計學意義(P>0.05),而40 μmol/L組及60 μmol/L組可明顯抑制細胞克隆形成能力,差異均有統計學意義(P<0.05),并且HCT116細胞的克隆形成數量隨著羽扇豆醇濃度升高呈減少趨勢。見圖2。
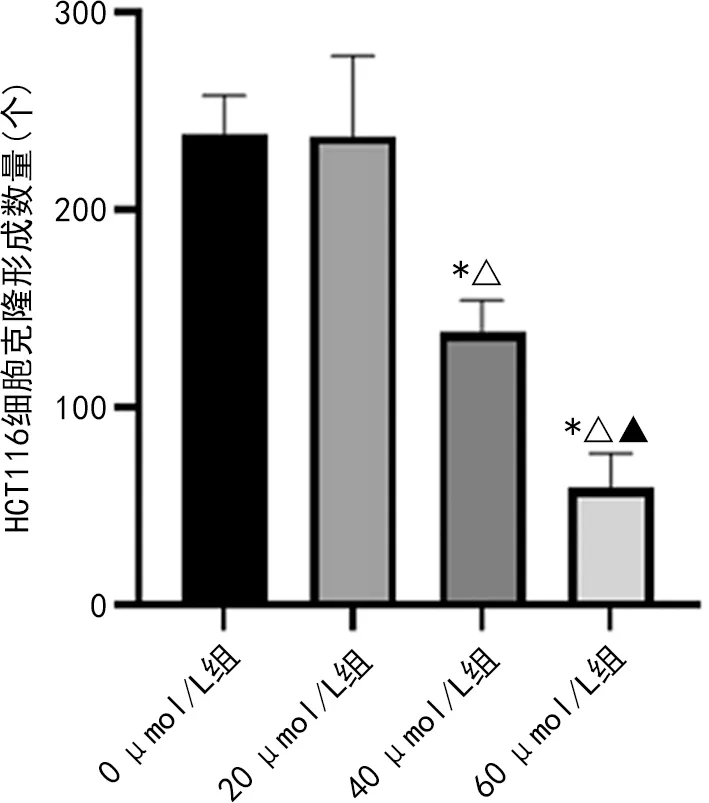
注:與0 μmol/L組比較,*P<0.05;與20 μmol/L組比較,△P<0.05;與40 μmol/L組比較,▲P<0.05。
2.1.3羽扇豆醇抑制HCT116細胞的遷移能力 經40 μmol/L羽扇豆醇干預48 h后,HCT116細胞的遷移率為(50.83±5.55)%,明顯低于0 μmol/L組的(81.51±2.69)%,差異有統計學意義(P<0.05)。隨著羽扇豆醇濃度增加,HCT116細胞遷移率進一步下降,在羽扇豆醇濃度為60 μmol/L時,HCT116細胞的遷移率僅為(32.62±5.30)%,明顯低于0 μmol/L組、20 μmol/L組和40 μmol/L組,差異均有統計學意義(P<0.05)。見圖3。
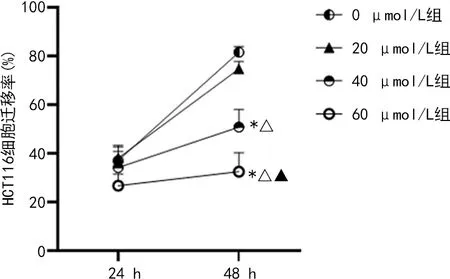
注:與0 μmol/L組比較,*P<0.05;與20 μmol/L組比較,△P<0.05;與40 μmol/L組比較,◆P<0.05。
2.1.4羽扇豆醇抑制HCT116細胞的侵襲能力 Transwell試驗結果顯示,與0 μmol/L組比較,20 μmol/L羽扇豆醇作用HCT116細胞后,細胞侵襲能力無明顯改變,差異無統計學意義(P>0.05);而經40 μmol/L及60 μmol/L的羽扇豆醇干預后,細胞侵襲個數明顯減少,差異均有統計學意義(P<0.05)。見圖4。
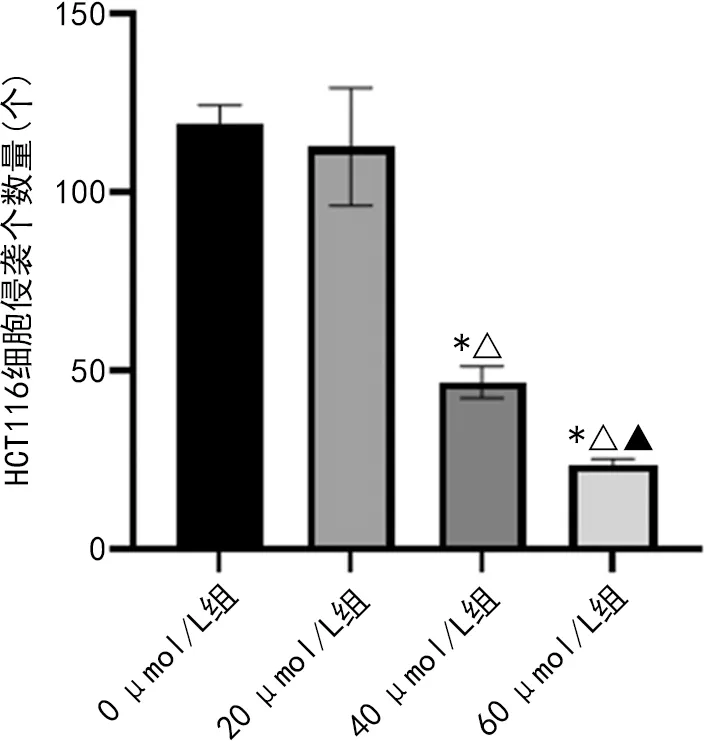
注:與0 μmol/L組比較,*P<0.05;與20 μmol/L組比較,△P<0.05;與40 μmol/L組比較,▲P<0.05。
2.1.5羽扇豆醇誘導HCT116細胞發生凋亡 20 μmol/L與40 μmol/L的羽扇豆醇干預HCT116細胞48 h后無明顯細胞凋亡發生,而60 μmol/L的羽扇豆醇可明顯誘導細胞凋亡,其中早期凋亡率為(7.33±0.35)%,晚期凋亡率為(7.33±1.44)%,與0 μmol/L組比較明顯增高,差異均有統計學意義(P<0.05);但早期、晚期凋亡率比較,差異無統計學意義(P>0.05)。見圖5。
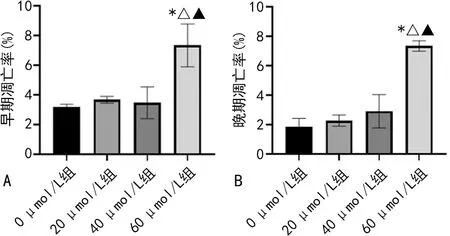
注:A為早期凋亡率;B為晚期凋亡率;與0 μmol/L組比較,*P<0.05;與20 μmol/L組比較,△P<0.05;與40 μmol/L組比較,▲P<0.05。
2.2羽扇豆醇對結直腸癌HCT116細胞TMT標記定量蛋白質組學及生物信息學分析結果
2.2.1差異表達蛋白分析 共490種表達差異明顯的蛋白質在0 μmol/L組與其他濃度羽扇豆醇組比較中被發現,其中表達上調蛋白269種,表達下調蛋白221種。進一步對蛋白集合的定量信息進行歸一化處理,即歸一化至-1,1;同時使用Complexheatmap R包(Version 3.4)對樣品和蛋白表達量2個維度進行分類,并生成層次聚類熱圖,見圖6A。熱圖中列舉了差異明顯的前50種蛋白表達情況,蛋白上調程度越高,顏色越紅;蛋白下調程度越低,顏色越綠,黑色代表中間表達的蛋白。圖6B火山圖中每個點代表一種蛋白,黑色是表達在陰性對照組與羽扇豆醇組中無差異的蛋白,藍色點代表下調的蛋白,紅色點則代表上調的蛋白。
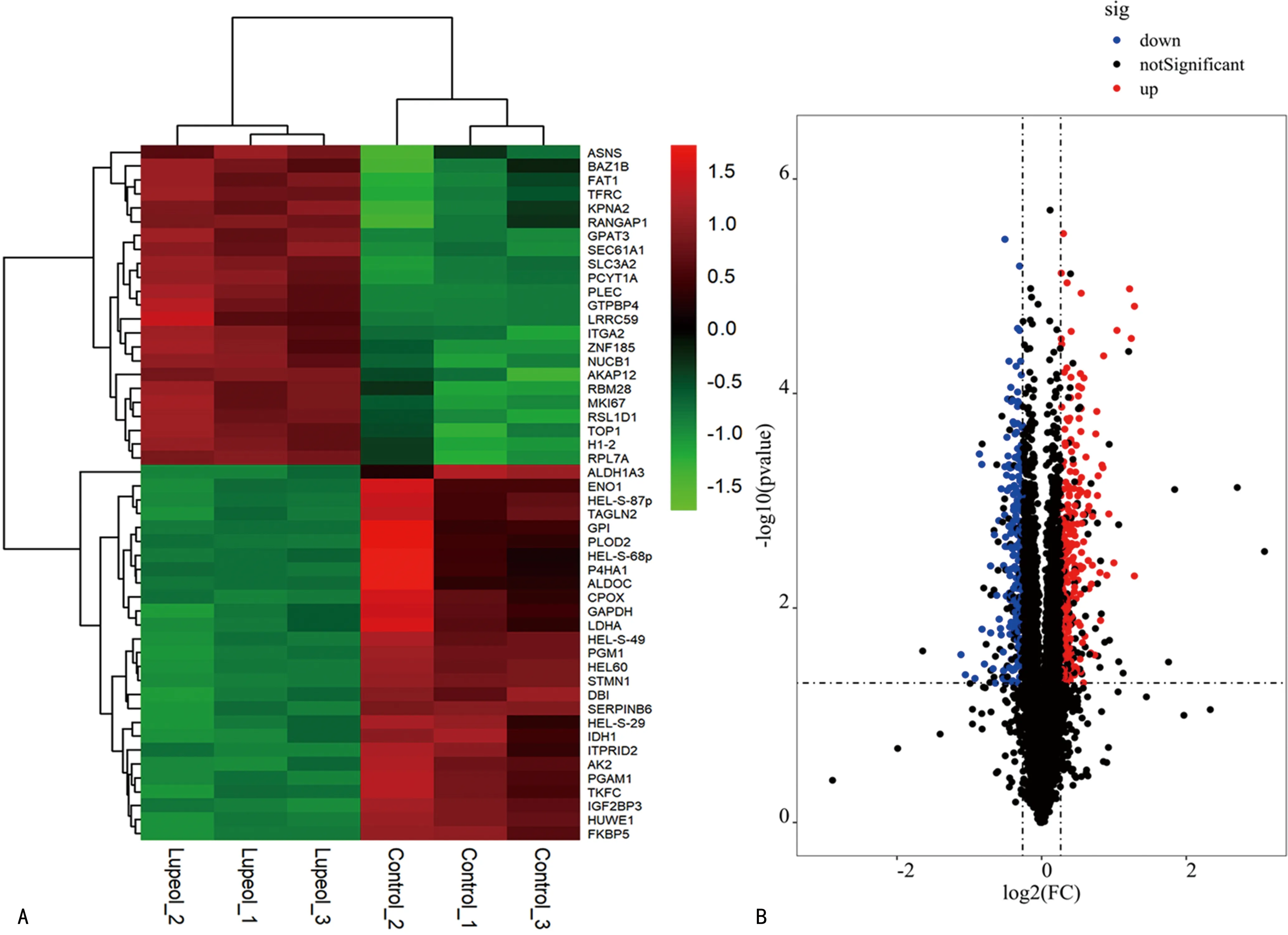
注:A為羽扇豆醇差異蛋白表達量聚類熱圖;B為羽扇豆醇差異蛋白數目的火山圖。
2.2.2差異蛋白的GO功能富集分析 利用GO功能富集分析,將上述490種差異蛋白富集在生物學過程、細胞組分和分子功能3個層面上的二級條目及其蛋白數目。在生物學過程中,差異蛋白主要富集在L-丙氨酸跨膜轉運、p53信號通路、紡錘體中區組裝、LSU-rRNA的成熟、二磷酸腺苷代謝過程等生物學過程中。在細胞組分中,差異蛋白主要富集在核仁腔、血小板α顆粒腔、內質網內腔等細胞部位。在分子功能中,差異蛋白主要富集在L-丙氨酸跨膜轉運體活性、運貨受體活性、絲氨酸型內肽酶抑制劑活性、L-抗壞血酸結合等活性分子功能上。
2.2.3差異蛋白的KEGG信號通路注釋分析 差異蛋白進行KEGG信號通路注釋分析后發現,差異蛋白主要富集在糖酵解/糖異生、HIF-1信號通路、病毒蛋白與細胞因子及細胞因子受體的相互作用、淀粉和蔗糖代謝途徑等信號通路上。見圖7。
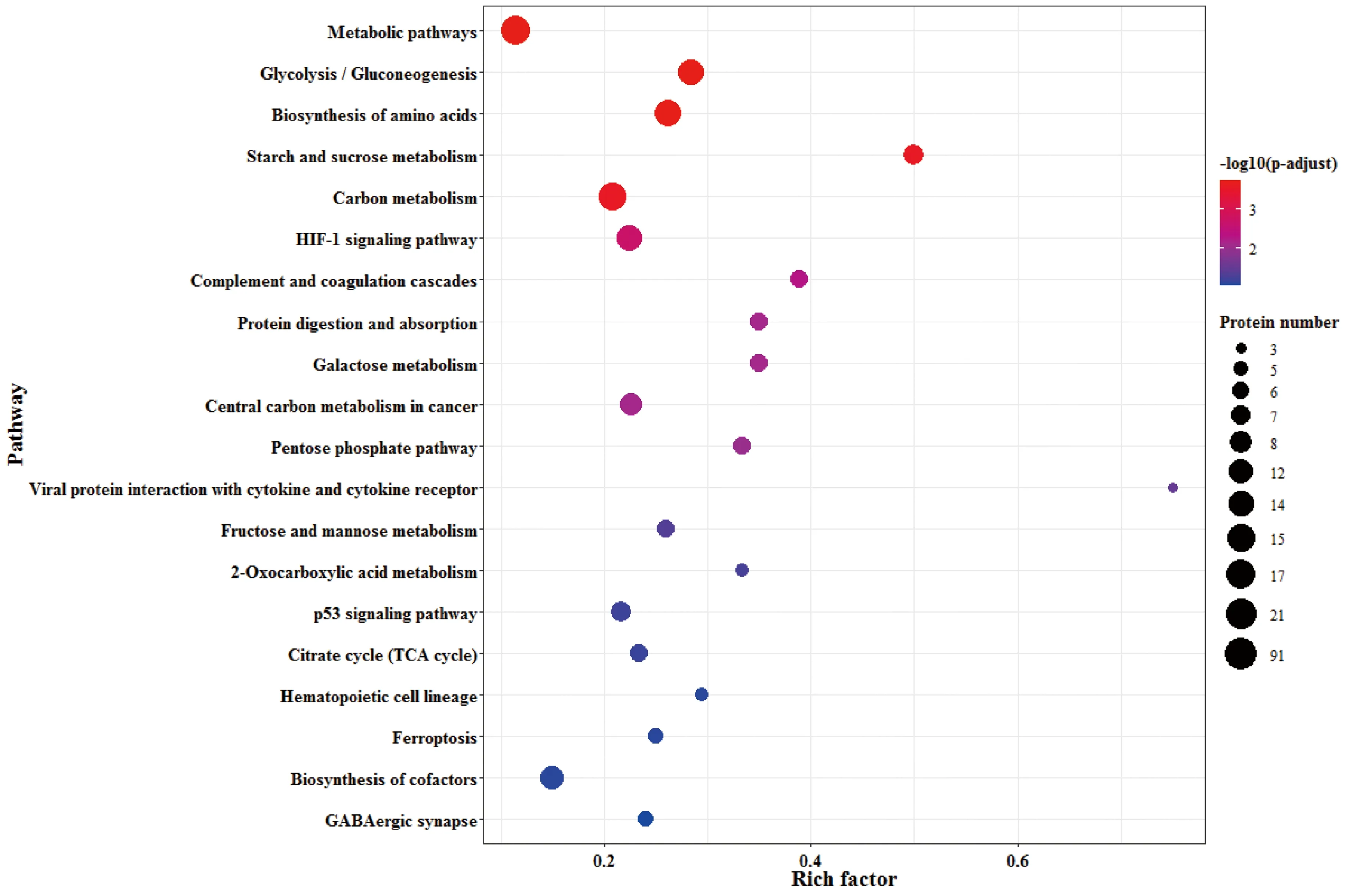
圖7 KEGG信號通路注釋分析氣泡圖
2.2.4差異蛋白PPI分析 為進一步探索差異蛋白之間的相互作用,本研究應用 STRING 數據庫對490種差異蛋白進行分析,并構建PPI,其中關聯度前10的蛋白分別為LDLR、APP、AURKB、ENO1、CALCOCO2、CCNB1、CDC20、CDCA8、LDHA、ECT2,這些蛋白與其他蛋白存在較為緊密的相互作用關系(圖8)。另外,參與糖酵解途徑的關鍵酶ENO1和LDHA位于上述差異蛋白的關鍵節點上。

圖8 差異蛋白PPI分析結果
2.3羽扇豆醇對糖酵解途徑相關蛋白表達水平的影響 經不同濃度的羽扇豆醇干預HCT116細胞48 h后,細胞中HIF-1α、ENO1和LDHA蛋白表達水平出現明顯改變,隨著羽扇豆醇干預濃度增高,HIF-1α、ENO1、LDHA蛋白表達水平均呈不同程度減少(圖9)。
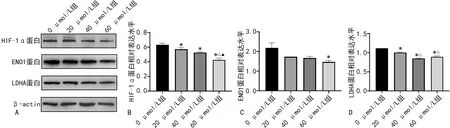
注:A為各組HCT116細胞的HIF-1α、ENO1、LDHA蛋白表達情況;B為各組HIF-1α蛋白相對表達水平;C為各組ENO1蛋白相對表達水平;D為各組LDHA蛋白相對表達水平。與0 μmol/L組比較,*P<0.05;與20 μmol/L組比較,△P<0.05;與40 μmol/L組比較,▲P<0.05。
3 討 論
隨著中藥扶正祛邪的機制及促進人體免疫力的研究進展,中藥在癌癥預防、早期治療,甚至是在癌癥中晚期的應用方面具有明顯優勢[11-12]。據報道,羽扇豆醇對前列腺癌、肺癌、膀胱癌等惡性腫瘤具有良好的治療效果,其機制涉及MAPK/ERK、PI3K/AKT/mTOR等多種細胞內信號通路的改變[13-14]。值得注意的是,與傳統抗腫瘤藥物不同,羽扇豆醇已被證實對正常細胞、組織、小鼠無毒,并且具有有效的治療劑量[9-10]。本研究結果顯示,羽扇豆醇能明顯抑制HCT116細胞的增殖,且呈時間-劑量依賴性,但對人正常結腸上皮FHC細胞及人腹膜間皮HMrSV5細胞無抑制作用。進一步的細胞功能試驗提示,羽扇豆醇可明顯抑制HCT116細胞的克隆形成、遷移和侵襲能力,同時能有效誘導細胞凋亡,由此提示羽扇豆醇在治療結直腸癌方面具有一定的臨床價值。
本研究進一步通過TMT標記定量蛋白質組學及生物信息學分析探討其潛在的分子機制。經TMT標記定量蛋白質組學分析顯示,共篩選出490種有明顯差異表達的蛋白,其中表達上調蛋白269種,表達下調蛋白221種。GO功能富集分析提示,差異蛋白主要參與了細胞分裂、增殖、凋亡及營養物質代謝等生物學過程,以上過程與腫瘤的發生和發展密切相關。通過KEGG信號通路注釋分析發現,羽扇豆醇的抑癌作用可能與糖酵解/糖異生、HIF-1信號通路、淀粉和蔗糖代謝途徑等信號通路相關。有氧糖酵解途徑是腫瘤細胞特征性的代謝方式,腫瘤細胞通過增強糖酵解活性和產生大量乳酸及快速生成三磷酸腺苷(ATP),促進癌細胞的生長與轉移[15]。本研究構建PPI分析發現,糖酵解途徑中的關鍵酶ENO1和LDHA均位于差異蛋白的關鍵節點上。因此,本研究推測羽扇豆醇的抗結直腸癌作用可能與抑制細胞糖酵解通路有關。
ENO1屬于一種烯醇化酶,在糖酵解過程中催化2-磷酸甘油酸轉化為磷酸烯醇丙酮酸,在大多數腫瘤細胞中表達水平升高,是糖酵解途徑的關鍵酶之一[16]。ENO1可通過糖酵解途徑向腫瘤細胞提供代謝所需要的ATP,對腫瘤細胞具有抑制凋亡和促進增殖的作用[17-18],但在正常細胞中無此作用,其原因可能是因為腫瘤細胞處于缺氧微環境,重新調節了糖酵解途徑,最終使糖酵解酶增加,而正常細胞則無此現象[19]。另外,ENO1可激活糖酵解途徑,改善腫瘤細胞對低氧的能量失衡,誘導腫瘤新生血管形成,促進結直腸癌細胞的增殖、侵襲和體外轉移[20]。LDHA也是糖酵解途徑的關鍵酶,處于糖酵解反應的終末端,在多種癌癥中呈過表達,可作為一種生物標志物,與預后不良相關[21]。LDHA能將丙酮酸轉化為乳酸,降低細胞對氧氣的依賴性,為腫瘤細胞生長和增殖提供能量,并且可抑制腫瘤細胞凋亡,促進腫瘤的惡性進展[22]。
HIF-1α是一種氧敏感轉錄因子,介導對缺氧的適應性代謝反應,在大多數腫瘤組織、細胞中可誘導糖酵解相關基因的表達,通過改變能量代謝、促進細胞增殖、血管生成和血管重塑等方式提高細胞在缺氧環境中的適應性,促進腫瘤生長,與患者預后不良及腫瘤耐藥密切相關[23]。據報道,ENO1與LDHA均是HIF-1α的下游信號分子,在糖酵解過程中,HIF-1α可通過與ENO1和LDHA啟動子中的低氧反應原件結合,調節ENO1和LDHA表達和靶基因轉錄,誘導細胞對缺氧的適應性反應,同時隨著乳酸生成和葡萄糖利用增加,從而促進腫瘤細胞生長[24-25]。因此,HIF-1α與ENO1、LDHA的表達均呈正相關,并且均能促進腫瘤細胞的生長和轉移。本研究中,羽扇豆醇作用于結直腸癌HCT116細胞后,HIF-1α、ENO1和LDHA蛋白表達水平均明顯降低,提示羽扇豆醇可抑制HIF-1α表達,進一步下調其下游靶標ENO1和LDHA蛋白表達水平,減少乳酸及ATP產生,最終抑制糖酵解途徑,導致HCT116細胞增殖及轉移能力受限,并誘導細胞凋亡。上述分子功能和潛在相關通路與生物信息學分析綜合結果趨勢一致。
綜上所述,羽扇豆醇可明顯抑制HCT-116細胞增殖、克隆、遷移、侵襲的能力,同時可誘導細胞凋亡,其作用機制可能與下調糖酵解信號通路中HIF-1α、LDHA和ENO1蛋白的表達水平有關。

