膝關節腔內及周圍痛點注射富血小板血漿治療Kellgren-Lawrence Ⅱ、Ⅲ級膝骨關節炎療效觀察
朱凱,陳紅梅,張燕,丁宇
(解放軍總醫院第六醫學中心中醫醫學部骨傷科,北京 100048)
膝骨關節炎(knee osteoarthritis,KOA)是導致中老年人膝關節疼痛、功能障礙最為常見的原因,發病率逐年升高。其基本病理改變為關節軟骨的進行性破壞,導致膝關節力線改變,繼發膝關節周圍軟組織損傷。因此,保護關節軟骨就成為筆者采用非手術方法治療KOA的主要目的,同時還需針對膝關節周圍韌帶、肌腱等軟組織損傷進行修復性治療。臨床醫生最常用的方法就是向關節腔內注射玻璃酸鈉、長效激素等藥物來保護關節軟骨,膝周痛點封閉治療。目前,關節腔內及周圍軟組織注射富血小板血漿(platelet rich plasma,PRP)治療KOA應用日益廣泛[1-2],并推廣到髖[3]、踝、肩[4]等關節的治療。富血小板血漿中血小板含量高于人體正常血液,被激活的血小板可釋放多種生物活性物質,包括多種生長因子、細胞因子、趨化因子及穩定的四價纖維蛋白支架等[5],這些活性物質可抑制局部軟組織炎癥,調節局部組織的微環境,促進組織細胞增殖、膠原合成,促進組織修復與重建[6],且沒有免疫排斥反應。加之PRP具有制作簡便、成本低、對機體損傷小等優點,現已成為KOA治療的新焦點。本研究采用自體富血小板血漿進行膝關節腔內及膝周痛點注射治療52例KOA患者,療效滿意,現報道如下。
1 資料與方法
1.1 一般資料 2018年1月至2019年12月解放軍總醫院第六醫學中心中醫醫學部骨傷科收治KOA患者52例,其中男23例,女29例;年齡41~59歲,平均(51.71±4.38)歲;病程1~8年,平均(4.88±2.14)年;左膝關節22例,右膝關節30例;根據骨關節炎Kellgren-Lawrence(K-L)分級標準,Ⅱ級31例,Ⅲ級21例。本研究中的所有患者,均在治療前告知治療方案,簽署相關知情同意書,并通過醫院倫理委員會審核。
納入標準:(1)年齡41~59歲;(2)確診為膝骨關節炎,K-L分級為Ⅱ級或Ⅲ級;(3)患者臨床癥狀具有典型的髕股關節炎、脛股關節炎表現;(4)患者均同意參與本項研究并已簽署知情同意書。排除標準:(1)治療前2個月內已接受關節腔注射或使用非甾體抗炎藥等治療者;(2)明確診斷為感染性膝關節炎者;(3)合并類風濕性關節炎、痛風、糖尿病、血液系統、心血管系統等內科疾病;(4)有膝關節周圍神經損傷病史;(5)既往有腦血管病史,影響包括膝關節在內的肢體活動功能或無法配合功能鍛煉者;(6)既往有累及膝關節的開放性損傷及手術病史。
根據2010年中華醫學會風濕病學分會修訂的診斷標準[7]:(1)近1個月內反復膝關節疼痛;(2)X線(負重位)示關節間隙變窄、軟骨下骨化和/或囊性變、關節緣骨贅形成;(3)關節液(至少2次)清亮、黏稠,白細胞(white blood cell,WBC)<2 000個/mL;(4)年齡≥40歲;(5)晨僵≤30 min;(6)活動時有骨擦音或骨擦感。滿足1+2或1+3+5+6或1+4+5+6即可診斷。
1.2 自體富血小板血漿制備 從患者肘前靜脈取血30 mL,注入預先配備枸櫞酸鈉抗凝劑的離心管(每支管存放5 mL血,共6支)中,搖勻后將離心管對稱放入離心機,以3 000 r/min離心10 min,可見離心后全血分3層,上層為血漿層(platelet poor plasma,PPP),成分以纖維蛋白原為主,下層為紅細胞層(red cell,RC),兩層交界處淺黃色層(platelet rich plasma,PRP),即為濃縮的血小板層。使用無菌注射器抽取交界層富血小板血漿備用,上、下層棄用。30 mL靜脈血可獲得約3 mL PRP。
1.3 治療方法 所有病例的相關操作均由同一組醫師完成,并且未告知患者及醫護人員K-L分級情況。患者膝關節處于屈曲30°位,腘窩處墊枕,選髕骨上極外側關節間隙處為穿刺點,嚴格消毒,鋪無菌單,使用5 mL注射器抽取2 mL生理鹽水加0.5 mL利多卡因穿刺,局麻后繼續刺入,確定針尖到達關節腔內,更換注射器,關節腔內注入PRP約2 mL。選取髕骨支持帶、側副韌帶、髕下脂肪墊及鵝足滑囊等處痛點,于各痛點分別注入PRP約0.2 mL,拔出針頭,按壓各穿刺點5 min止血,無菌敷料保護。囑患者自行完成膝關節緩慢屈伸活動5~10次,術后48 h內操作區域勿沾水。療程:1次/周,共3次。
1.4 評價指標 治療結束后3、6、12個月對所有患者進行門診隨訪。采用疼痛視覺模擬評分[8](visual analogue scale,VAS)、西安大略和麥克馬斯特大學(the Western Ontario and McMaster Universities,WOMAC)膝骨關節炎指數評分[9]、Lysholm評分[10]評價療效。
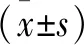
2 結 果
52例均獲得隨訪,隨訪時間12~18個月,平均(14.30±1.73)個月。所有患者穿刺點皮膚愈合良好,均未出現皮膚及膝關節腔內感染。治療后3、6、12個月VAS評分、WOMAC評分及Lysholm評分均較治療前明顯改善,差異均有統計學意義(P<0.05,見表1)。
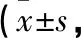
表1 膝骨關節炎自體富血小板血漿關節腔注射治療前后VAS、WOMAC、Lysholm評分比較分)
K-L不同分級患者不同隨訪時間WOMAC評分情況見表2。Ⅱ級患者術后3、6、12個月WOMAC評分均低于Ⅲ級患者,差異有統計學意義(P<0.05)。
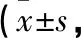
表2 K-LⅡ、Ⅲ級膝骨關節炎自體富血小板血漿關節腔注射治療WOMAC評分比較分)
3 討 論
膝骨關節炎的病理變化包括以下幾個方面:(1)膝關節軟骨軟化,軟骨基質中硫酸軟骨素含量減少,導致軟骨表面毛糙;(2)骨贅異常的增生軟骨下新骨形成;(3)滑膜增厚,絨毛肥大;(4)關節囊纖維化;(5)游離體形成。以上病理變化最終引起膝痛、膝關節活動受限及畸形等臨床表現[11]。在治療方面,包括手術治療與非手術治療。手術治療多為關節置換手術,適用于晚期膝骨關節炎;非手術治療主要適用于早、中期患者[12],包括關節腔內注射玻璃酸鈉或少量的糖皮質激素、臭氧灌洗術[13]、口服藥物治療、干細胞移植[14]、康復訓練治療、健康管理、健康教育、中醫針灸及減重等[15-16]。這些治療方法在緩解臨床癥狀、改善關節功能方面發揮了一定的作用,但仍無法阻斷軟骨退變,促進軟骨修復。由于膝骨關節炎發病的直接原因是局部內環境的紊亂與應力的不平衡導致軟骨細胞受到破壞,故在其發病早期,治療根本目的仍然是修復受損軟骨細胞,改善軟骨細胞生長環境,延緩病變進展。Sanchez等[17]在2008年首次報道了自體PRP注射治療膝骨關節炎可減輕膝關節疼痛,改善膝關節功能。有研究數據顯示,采用PRP關節內注射方法可治療膝關節內軟骨損傷,減輕炎癥反應,促進軟骨細胞的增生和分裂[18]。PRP中富含血小板,并含有纖維蛋白和少量的白細胞。其中,血小板被激活后,可釋放多種具有生物活性的因子,促進軟骨細胞增生、分裂[19],促進軟骨再生;纖維蛋白在軟骨的修復過程中發揮生物支架的作用,有利于多種生物活性因子的產生,促進組織修復;少量白細胞分布于滑膜表面,可減輕滑膜的炎癥反應,發揮一定的抗感染作用。此外,PRP完全是從自體血中提取的,無免疫排異反應,是一種安全性很高的治療方法。
膝骨關節炎通常指膝關節內的范疇,然而,關節內的病變常常會導致關節外軟組織病變,關節外軟組織病變反過來也會加重關節內的病變,二者相互影響,形成惡性循環。因此,筆者認為對關節外軟組織的治療同樣十分重要。關節腔外軟組織主要包括肌肉、肌腱、韌帶、神經、血管和滑囊等結構,PRP中含有多種生長因子,可促使多能干細胞聚集在待修復部位,促進成纖維細胞的增殖,加快纖維蛋白與細胞外基質的合成[20]。同時,PRP可加速損傷區域周圍新生血管形成,促進軟組織愈合[21]。此外,PRP中的白細胞在局部具有抗炎作用。
本研究52例患者的年齡均不超過60歲,膝關節腔內及膝關節周圍痛點每周注射1次自體富血小板血漿,經過3次治療,治療后3、6、12個月VAS評分、WOMAC評分及Lysholm評分較治療前明顯改善,差異均有統計學意義(P<0.05),獲得了滿意的臨床效果。其中,腔內注射PRP后,通過改變腔內微環境,并將大量促進軟骨再生的生長因子輸送到損傷軟骨周圍,可減緩甚至阻斷炎癥反應,促進損傷軟骨的修復和再生[22]。膝關節周圍痛點注射PRP,可修復受損的軟組織,并在一定程度上對受損軟組織周圍炎癥起到抑制作用[23]。將膝關節腔內外看做一個整體,內外兼治才能充分調整膝關節力學平衡,使療效最大化,實現膝關節功能快速康復的目的。此外,本研究發現K-LⅡ級患者治療后6、12個月WOMAC評分均低于Ⅲ級患者,差異有統計學意義(P<0.05)。筆者發現,在K-L分級較高的患者中,其關節軟骨修復能力較差,臨床療效也較差。因此,筆者認為,軟骨細胞修復的能力與患者軟骨的自身潛能有關[24],K-L分級水平與關節軟骨修復能力之間的相關性仍需進一步研究。
綜上所述,PRP是一種“綠色”治療方法,制備簡便,安全性高,幾乎不會發生排異反應,為膝骨關節炎的臨床治療提供了新的思路,PRP更適用于膝關節退變較輕、年齡較輕的患者。

