血管活性肽對血管緊張素Ⅱ誘導(dǎo)高血壓大鼠血管膠原重構(gòu)的作用機制
陳光遠(yuǎn),王秀艷,劉星群,溫霞
(1.內(nèi)蒙古自治區(qū)人民醫(yī)院 體檢科,內(nèi)蒙古 呼和浩特 010017;2.內(nèi)蒙古自治區(qū)人民醫(yī)院 急診科,內(nèi)蒙古 呼和浩特 010017)
高血壓是最常見的心血管疾病,它能提高中風(fēng)、心臟病等心腦血管疾病的風(fēng)險[1]。血管緊張素Ⅱ(angiotensinⅡ, AngⅡ)是調(diào)節(jié)人體心血管系統(tǒng)的一種重要活性物質(zhì),能夠作用于血管平滑肌使血管收縮,從而使得血壓升高[2]。研究表明AngⅡ在多種心血管疾病發(fā)生過程中,發(fā)揮重要作用,能夠促進心肌細(xì)胞及血管平滑肌細(xì)胞中膠原的合成[3],而血管膠原合成是多種心血管疾病發(fā)生的重要病理生理過程[4]。血管活性肽(intermedin,IMD)屬于降鈣素基因相關(guān)肽(calcitonin gene related peptide,CGRP)超家族成員,它能通過降鈣素受體樣受體或者受體活性修飾蛋白發(fā)揮作用[5],是重要的內(nèi)源性心臟-腎臟保護因子,具有降低血壓、擴張冠脈、調(diào)節(jié)水和電解質(zhì)平衡、調(diào)節(jié)垂體激素分泌等作用[6-7]。既往研究顯示IMD能夠通過改善血管平滑肌細(xì)胞舒張功能,代償性拮抗內(nèi)膜增殖,進而影響損傷血管狹窄的形成[8],但是有關(guān)IMD對AngⅡ誘導(dǎo)的高血壓血管膠原重構(gòu)的機制尚不完全清楚。因此,本研究擬通過研究血管中膠原合成和重構(gòu)的過程來評價IMD在AngⅡ誘導(dǎo)高血壓中血管膠原重構(gòu)中的作用機制。
1 材料與方法
1.1 實驗材料
1.1.1動物來源 12周齡雄性Sprague Dawley(SD)大鼠(購自北京大學(xué)醫(yī)學(xué)院實驗動物中心)36只,體質(zhì)量(403.4±5.3)g,普食喂養(yǎng)、自由攝食、進水,溫度25 ℃,濕度(60±10)%。
1.1.2主要試劑與儀器 蘇木精-伊紅(hematoxylin-eosin staining,HE)試劑盒、β-actin小鼠單克隆抗體、一抗稀釋液、二抗稀釋液及電化學(xué)發(fā)光液(electrochemiluminescence,ECL;上海碧云天生物技術(shù)),AngⅡ和IMD(美國Sigma),酶聯(lián)免疫吸附劑測定(enzyme linked immunosorbent assay,ELISA)試劑盒(北京中杉金橋),RNA逆轉(zhuǎn)錄試劑盒(上海生工生物工程),TRIzol RNA提取試劑(中國賽默飛世爾科技),磷酸化絲氨酸/蘇氨酸激酶(phosphorylated-Akt,p-Akt)兔單克隆抗體和絲裂原活化蛋白激酶(phosphorylated-MAPK,p-MAPK)兔單克隆抗體(美國Cell Signaling Technology);G22-W型高速離心機(湖南湘儀實驗室),SuPerMax 3000FA型多功能酶標(biāo)儀(中國賽默飛世爾科技),M371450型組織渦旋儀(武漢維塞爾生物),TC-XDS-500C型熒光倒置顯微鏡(日本奧林巴斯),Western blotting檢測裝置和GoodLook-1000型成像系統(tǒng)(美國Bio-Rad),Applied Biosystems ABI 7500聚合酶鏈?zhǔn)椒磻?yīng)(polymerase chain reaction,PCR)儀(中國Thermo Fisher Scientific)。
1.2 實驗方法
1.2.1動物分組 36只大鼠隨機均分為AngⅡ組、AngⅡ+IMD組及對照組,AngⅡ組大鼠于下肢遠(yuǎn)端縫匠肌肌內(nèi)局部注射10-7mol/L AngⅡ(生理鹽水配制)0.2 mL,AngⅡ+IMD組大鼠采用同樣的方法注射10-7mol/L AngⅡ(生理鹽水配制)0.2 mL和IMD 150 μg/kg(生理鹽水配制),對照組僅注射相同體積的生理鹽水[7, 9],1次/d。所有大鼠干預(yù)時間為2周。
1.2.2尾動脈容積法測量大鼠尾動脈血壓 各組大鼠處理2周后測量其尾動脈血壓,將其置于大鼠血壓心率測量儀的37 ℃保溫箱中使大鼠體溫上升,鼠尾套入氣囊套,待動物安靜后充氣,測定收縮壓,重復(fù)3次,取平均值。
1.2.3ELISA法檢測血清Ⅰ、Ⅲ型膠原蛋白 60 mg/kg水和氯醛腹腔注射麻醉大鼠,經(jīng)內(nèi)眥靜脈抽血,3 000 r/min離心5 min,分離血清,取96孔酶標(biāo)板,每孔加血清100 μL,加pH 7.4的PBS 100 μL,4 ℃反應(yīng)過夜;PBS沖洗后用2%H2O2-乙醇溶液封閉內(nèi)源過氧化物酶活性,加1%BSA溶液封閉非特異性抗體結(jié)合位點,PBS洗滌后加1∶1 000稀釋的分別加入Ⅰ、Ⅲ型前膠原的特異性抗體,37 ℃反應(yīng)2 h,洗去多余抗體;加1∶200稀釋的生物素標(biāo)記的山羊抗大鼠二抗,37 ℃反應(yīng)1.5 h,洗去多余二抗;加OPD顯色液在室溫下顯色反應(yīng)6 min,加 0.2 mmol/L H2SO4終止反應(yīng);利用酶標(biāo)儀檢測血清Ⅰ、Ⅲ型膠原蛋白的含量。
1.2.4HE染色 60 mg/kg水合氯醛腹腔注射麻醉大鼠,打開胸腔,取胸主動脈中段長度為0.5 cm的血管,40 g/L多聚甲醛固定、石蠟包埋,其余的血管組織樣本用液氮低溫保存。石蠟包埋的組織連續(xù)切片4張、厚度5 μm,60 ℃烘烤30 min,二甲苯中脫蠟15 min;梯度酒精浸泡除去二甲苯,蒸餾水浸泡沖洗2次,吸取水分;晾干后蘇木精染色15 min,蒸餾水沖洗2遍;1%鹽酸酒精分化30 s,蒸餾水浸泡15 min,吸干水分后于1%伊紅染色液中染色3 min;70%酒精沖洗后利用梯酒精浸泡脫水,二甲苯酒精(1∶1)中浸泡5 min,二甲苯中浸泡5 min,換二甲苯中浸泡15 min,取切片,滴加樹膠封片,染色切片;通過ImageJ軟件自動圖像分析系統(tǒng)分析不同區(qū)域組織像素差異,測定胸動脈壁厚/腔徑比值(wall thickness/lumen diameter of thoracic artery,W/C)和膠原面積百分比(percentage of collagen area,VFC)[10]。
1.2.5p-Akt及p-MAPK蛋白表達(dá) 取1.2.4項下液氮凍存的各組大鼠胸主動脈血管組織200 mg,于液氮中研磨為粉末,加預(yù)冷的細(xì)胞裂解液裂解,4 ℃反應(yīng)過夜,12 000 r/min離心10 min,取上清進行SDS-PAGE電泳分析;抽提總蛋白,利用SDS-PAGE電泳法分離不同蛋白,通過電轉(zhuǎn)法將總蛋白從凝膠中轉(zhuǎn)移至PVDF膜上;5%脫脂奶粉37 ℃封閉1 h,TBST洗滌加一抗工作液(一抗分別為p-Akt、p-MAPK特異性鼠源抗體),4 ℃孵育過夜;TBST洗去多余一抗,加辣根過氧化酶標(biāo)記山羊抗大鼠IgG二抗(1∶1 000),室溫孵育1h;TBST洗膜后加新鮮配制的DAB顯色液避光顯色10 min,蒸餾水洗停止顯色;將Western-Blot結(jié)果圖像輸入計算機,利用凝膠成像分析系統(tǒng)檢測條帶的積分灰度值[11]。
1.2.6p-AktmRNA和p-MAPKmRNA表達(dá) 根據(jù)Akt和MAPK的序列(GeneBank登錄號分別為NM_001165894 及X58712)設(shè)計用于RT-PCR的引物,引物序列見表1。取液氮凍存血管組織,通過TRIzol RNA提取試劑盒提取組織中的總RNA,進行RT-PCR檢測,利用RT-PCR一步法試劑盒在Real-Time PCR儀(Bio-Rad)進行RT-PCR反應(yīng),RT-PCR反應(yīng)條件為95 ℃、3 min,60 ℃、15 s,72 ℃、30 s,40個循環(huán);使用儀器配套分析軟件V2.02進行分析以β-actin作為內(nèi)參照,結(jié)果用以2-ΔΔCt來表示[12]。

表1 RT-PCR引物
1.3 統(tǒng)計學(xué)分析
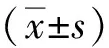
2 結(jié)果
2.1 尾動脈血壓
與對照組相比,AngⅡ組大鼠尾動脈血壓明顯升高,差異有統(tǒng)計學(xué)意義(P<0.01);與AngⅡ組相比,AngⅡ+IMD組大鼠尾動脈血壓降低,差異有統(tǒng)計學(xué)意義(P<0.05,圖1)。

注:(1)與對照組比較,P<0.01;(2)與AngⅡ組比較,P<0.05。
2.2 血清中Ⅰ、Ⅲ型膠原含量和主動脈W/C及VFC
ELISA檢測如表2所示,與對照組相比,AngⅡ組大鼠血清中Ⅰ、Ⅲ型膠原含量及主動脈W/C與VFC升高(P<0.05或P<0.01),AngⅡ+IMD組大鼠血清中Ⅰ型膠原含量與主動脈W/C提高(P<0.05或P<0.01);與AngⅡ組相比,AngⅡ+IMD組大鼠血清中Ⅰ、Ⅲ型膠原含量及主動脈W/C與VFC升高,差異有統(tǒng)計學(xué)意義(P<0.05或P<0.01)。HE染色結(jié)果如圖2所示,AngⅡ組大鼠的動脈血管內(nèi)徑較對照組變小、且膠原重構(gòu)現(xiàn)象較對照組明顯(P<0.05),AngⅡ+IMD組大鼠血管膠原重構(gòu)現(xiàn)象較AngⅡ組減輕(P<0.05)。

對照組 AngⅡ組 AngⅡ+IMD組
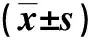
表2 各組大鼠血清中Ⅰ、Ⅲ型膠原含量和主動脈W/C及VFC
2.3 p-Akt和p-MAPK蛋白的表達(dá)
Western blot結(jié)果顯示,與對照組相比,AngⅡ組大鼠血管中p-Akt及p-MAPK蛋白的表達(dá)明顯升高,差異均有統(tǒng)計學(xué)意義(P<0.01);與AngⅡ組相比,AngⅡ+IMD組大鼠血管中p-Akt及p-MAPK蛋白的表達(dá)降低,差異均有統(tǒng)計學(xué)意義(P<0.05,圖3)。

注:A為 Western blot檢測結(jié)果,B為 p-Akt及p-MAPK蛋白的定量表達(dá);與對照組比較,(1)P<0.01,(2)P<0.05。
2.4 p-Akt和p-MAPK mRNA的表達(dá)
RT-PCR結(jié)果顯示,與對照組相比,AngⅡ組大鼠的血管細(xì)胞中p-AktmRNA表達(dá)顯著升高(P<0.05),而p-MAPKmRNA表達(dá)水平無差異(P>0.05);AngⅡ+IMD組大鼠的血管細(xì)胞中p-Aktt及p-MAPKmRNA的表達(dá)水平與對照組比較,差異無統(tǒng)計學(xué)意義(P>0.05,圖4)。

注:(1)與對照組比較,P<0.05;(2)與AngⅡ組比較,P<0.05。
3 討論
為了研究IMD在AngⅡ誘導(dǎo)大鼠高血壓中的影響及在血管膠原重構(gòu)中的作用機制,本研究首先利用體外注射的方法分別研究AngⅡ單獨作用及其與IMD共同作用對大鼠血壓的影響,IMD可以有效拮抗AngⅡ升血壓的作用,大鼠尾動脈血壓維持在較低水平。該結(jié)果可能是由于IMD是一種血管活性多肽,同時IMD屬于降鈣素基因相關(guān)肽(calcitonin gene related peptide,CGRP)超家族成員能夠通過降鈣素受體樣受體或者受體活性修飾蛋白發(fā)揮作用,降低血壓[13];既往研究證實IMD在降低血壓方面主要是通過結(jié)合受體活性修飾蛋白(receptor activity modifying protein,RAMPs)/降鈣素受體樣受體(calcitonin receptor like receptor,CRLR)受體復(fù)合物,并且調(diào)節(jié)cAMP水平和其他心血管活性因子實現(xiàn)的[14]。
由高血壓引發(fā)的其他多種心血管疾病包括動脈粥樣硬化等過程中,血管膠原的重構(gòu)是一個重要的病理生理過程[15]。為了研究IMD在AngⅡ誘導(dǎo)大鼠高血壓中血管膠原重構(gòu)中的作用機制,本研究通過ELISA、免疫組織化學(xué)等方法觀察大鼠血管微結(jié)構(gòu)的變化,計算W/C和VFC,結(jié)果表明IMD能夠抑制AngⅡ誘導(dǎo)大鼠高血壓中血管膠原重構(gòu)的過程;隨后為了解IMD抑制AngⅡ誘導(dǎo)高血壓中血管膠原重構(gòu)過程中可能的作用機制,本研究先后利用Western blot和RT-PCR的方法分別檢測Akt、MAPK mRNA和蛋白的表達(dá)水平,結(jié)果表明IMD可通過拮抗AngⅡ的作用調(diào)節(jié)Akt及MAPK的磷酸化水平,從而抑制血管膠原的重構(gòu)。
AngⅡ誘導(dǎo)血管膠原重構(gòu)的作用主要通過結(jié)合血管內(nèi)皮細(xì)胞表面AngⅡ的血管緊張素Ⅱ-1型受體(angiotensin Ⅱ type 1 receptor,AT1R),隨后激活下游的信號通路,最終引起膠原增生[16]。眾多研究表明,AngⅡ能夠作用于細(xì)胞表面的AT1R,已往研究使用Gi蛋白拮抗劑,證明AT1R能夠與Gi蛋白偶聯(lián),當(dāng)二者結(jié)合時Gi蛋白水解三磷酸鳥嘌呤核糖核苷,并且使G蛋白β受體酪氨酸激酶解離并活化酪氨酸激酶,從而激活表皮生長因子受體(epidermal growth factor receptor,EGFR),并在隨后可以激活Ras/raf/MAPK/ERK信號通路以及磷脂酰肌醇3-激酶/Akt信號通路[17]。研究表明AngⅡ結(jié)合AT1R激活EGFR通路的過程中需要Ca2+/鈣調(diào)素的作用,Ca2+/鈣調(diào)素能夠激活肌醇磷脂磷脂酶C,該酶能夠水解細(xì)胞膜結(jié)合的4,5二磷酸磷脂酰肌醇為三磷酸肌醇[18]。而IMD作為一種降鈣素相關(guān)肽家族的一員能夠結(jié)合Ca2+/鈣調(diào)素,并且降低其活性最終通過一系列信號通路的傳導(dǎo)降低EGFR信號通路的激活狀態(tài),使其下游多個信號通路關(guān)鍵蛋白的活性受到限制[19],其中包括MAPK及Akt等調(diào)節(jié)細(xì)胞生長分裂的關(guān)鍵蛋白。
IMD是內(nèi)環(huán)境中重要的活性多肽,目前大量研究已經(jīng)證實IMD在調(diào)節(jié)血壓及心肌、血管及腎臟等免受慢性氧化應(yīng)激及急性氧化應(yīng)激等過程中發(fā)揮重要作用,同時它對于抑制細(xì)胞凋亡,減輕不良組織的重構(gòu),保護心血管及腎臟功能方面也重要的作用[20]。因此,進一步研究IMD的生理功能及其機制對于心血管等方面疾病的研究和治療有著重要的理論和實踐意義。
- 貴州醫(yī)科大學(xué)學(xué)報的其它文章
- 右美托咪啶聯(lián)合喉上神經(jīng)阻滯對改良腭咽成形術(shù)患者疼痛評分、生活質(zhì)量及安全性的影響
- 大塊瓷化納米樹脂充填與微創(chuàng)去腐聯(lián)合治療齲齒的效果及對充填體磨損率的影響*
- 牙周組織再生術(shù)后行口腔正畸治療對牙周炎患者齦溝液中炎癥因子水平的影響*
- 磁共振成像檢測顳葉癲癇患者不同腦區(qū)腦白質(zhì)纖維束FA、MD值及分析皮層厚度與認(rèn)知功能的相關(guān)性*
- 沙庫巴曲纈沙坦與培哚普利對慢性心力衰竭患者心功能指標(biāo)及血清sST2和Gal-3水平的影響*
- 干燥綜合征患者抗SSA/SSB抗體及IgG與唇腺活檢病理的關(guān)系*

