硫酸鎂型光鹵石轉化鉀鹽鎂礬的過程機制與動態規律
周桓,張夢麗,郝晴,吳思,李杰,徐存兵
(1 天津科技大學化工與材料學院,天津 300457; 2 天津科技大學海洋與環境學院,天津 300457; 3 天津市鹵水資源與生態化利用重點實驗室,天津 300457)
引 言
新疆的羅布泊,青海的(東、西)臺吉乃爾、一里坪、大浪灘、大柴旦等都屬于硫酸鎂亞型鹽湖,是我國鹽湖硫酸鉀的主要生產基地[1]。硫酸鎂亞型鹽湖鉀肥生產,包括三段式鹽田成礦過程,即鈉鹽礦、鉀混鹽礦、光鹵石礦,和鉀礦加工過程[2]。鹽田鉀混礦主要由軟鉀鎂礬(Pic)、氯化鉀、七水硫酸鎂(Eps)和氯化鈉構成;光鹵石礦主要由光鹵石(Car)、氯化鉀、七水硫酸鎂和氯化鈉構成;鉀礦加工則包括鉀混礦轉化并浮選軟鉀鎂礬,光鹵石礦分解并浮選氯化鉀,以及軟鉀鎂礬和氯化鉀合成硫酸鉀等過程。硫酸鎂亞型鹽湖鹵水成鹽種類多,鹽田鉀礦成分復雜,導致鉀礦加工存在鉀鹽收率低[3]和質量波動,是亟待解決的問題。
水鹽體系相圖是鹵水化工過程分析與開發的依據[4],而硫酸鎂亞型鹽湖的三段式鹽田過程主要是依據蒸發析鹽規律[5-9]來確定的;鹽田鉀礦加工生產軟鉀鎂礬工藝也通常由實驗確定[10-13]。這主要是因為硫酸鎂亞型鹽湖鹵水的蒸發析鹽規律[5-9]與穩態相圖[14]存在著明顯差異,如鉀鹽析出順序是Pic、KCl和Car,沒有出現van’t Hof 平衡相圖[14]上的鉀鹽鎂礬(Kai)。這一現象早在1938 年由Kurnakov 等[15]發現,并繪制了蒸發相圖(“介穩相圖”),Danilov[16]在此基礎上研究了俄羅斯南部鹽湖的析鹽規律;金作美等[17-19]采用等溫蒸發法測定了15、25、35℃三套“介穩相圖”數據,圖1 是25℃“介穩相圖”與平衡相圖的比較,安東等[20]用“介穩相圖”的方法研究了25℃鉀鹽鎂礬相區特征。因蒸發析鹽規律與“介穩相圖”相符,而被鹽湖企業和廣大學者廣泛認同和使用。

圖1 五元體系25℃平衡相圖[14]與“介穩相圖”[17]比較Fig.1 Comparison between the 25℃equilibrium phase diagram[14]and“metastable phase diagram”[17]of quinary system
但事實上,盡管蒸發析鹽過程沒有復鹽Kai,可鹽田光鹵石礦的XRD 顯示有Kai 復鹽存在。Choudhari[21]也曾研究過日曬蒸發海水苦鹵生產Kai的過程。關于介穩相圖的科學性Steiger 等[22]提出質疑,并指出等溫蒸發實驗法不能獲得穩態的和嚴格意義上介穩態的溶解度數據;Autenrieth 等[23-27]特別研究了海水體系的介穩平衡,以更好地了解鉀鹽的結晶過程;Zhou 等[28-30]對蒸發成鹽相區不同于平衡相圖的機制進行過闡述:成鹽所需推動力的差異是造成成鹽相區偏離平衡相區的原因。
對于鹽湖鉀礦加工轉化過程,因不存在蒸發推動力,其固液相平衡規律應滿足平衡相圖特征。但令人費解的是:硫酸鎂型光鹵石的分解液組成點,恰好位于“介穩相圖”的KCl、Car、Eps、NaCl 四鹽共存 的 液 相 點,而 不 是 平 衡 相 圖 上KCl、Car、Kai、NaCl,或Car、Kai、Eps、NaCl 四鹽共飽點。對于鉀鎂混鹽轉化的復雜過程,海擎宇[31]、時歷杰等[32]做過硫酸鎂亞型鹽湖鉀鎂混鹽成礦及轉化行為的研究,但尚不足以說明上述過程。因此,為了澄清理論上的混亂,進一步開展過程機制和動力學特征的研究非常必要。
為此,本研究關注硫酸鎂亞型鹵水體系介穩態到平衡態轉化的熱力學機制和動力學特征,以一里坪鹽湖鹽田光鹵石礦為原料,以少量加水保證光鹵石不完全分解的方式,考察硫酸鎂型光鹵石在全混狀態下的分解和轉化規律,進而提出過程機制,建立預測固液系統狀態及其隨時間變化的動態模型,為認識鹽湖鉀鹽轉化機制、表達固相轉化過程動態,改善鹽湖資源利用過程提供依據。
1 實驗材料和方法
為考察硫酸鎂型光鹵石分解及轉化機制和動力學特征。本研究以一里坪鹽田光鹵石礦為原料,做恒溫全混的不完全分解實驗,檢測分解與轉化過程的固液相變化。
反應裝置:容積2 L 的三層玻璃反應釜,黑道夫錨式攪拌槳器,使過程從加水開始就處于全混狀態;溫度控制:由導熱油控制反應釜夾套層的溫度為(25±0.5)℃。
加水量:1000 g 光鹵石礦,研磨到全部通過0.3 mm 篩。按E′和A點液相組成,核算加水量分別為292 g 和234.6 g。為確保整個過程始終有未分解的光鹵石,加水量為最低水量的95%,即實際加水量僅為222 g。
取樣:考慮到開始時變化較快,取樣時間做近似指數型遞增安排,詳見3.1 節;移液管抽取的漿料做等溫過濾,濕固相用濾紙吸干;測定固液相組成,鑒定固相鹽類物種。
分析檢測[33]:測定離子K+、Mg2+、Cl-和SO2-4濃度,其中K+采用四苯硼酸鈉法,Mg2+采用EDTA 法,Cl-采用硝酸銀法,METTLER TOLEDO-T70 型電位滴定儀;SO2-4采用BaSO4重量法;Na+由離子電中性核算,H2O用歸一法計算。根據固相樣的XRD譜圖確定鹽類構成,設備為日本島津-6100型X射線衍射儀。
2 過程機理與模型
2.1 硫酸鎂型光鹵石的成礦組成
硫酸鎂亞型鹽湖鹵水鉀鹽生產的光鹵石析出階段,鹵水組成變化與Na+, K+, Mg2+//Cl-, SO2-4-H2O五元體系“介穩相圖”相符,伴有氯化鈉和硫酸鎂水合物的析出。從光鹵石開始析出的(KCl、Car、Eps、NaCl)共析點,到(Car、Eps、Kai、NaCl)共析點的所析出鹽類,按15~25℃的“介穩相圖”數據核算光鹵石礦的鹽類構成:Car 63%~68%、Eps 23%~33%、NaCl 3%~8%,例如一里坪鹽田光鹵石礦見表1 和圖2。因此,含大量硫酸鎂水合物和較少氯化鈉是硫酸鎂亞型鹽湖鹵水光鹵石礦(簡稱:硫酸鎂型光鹵石)的基本特征。
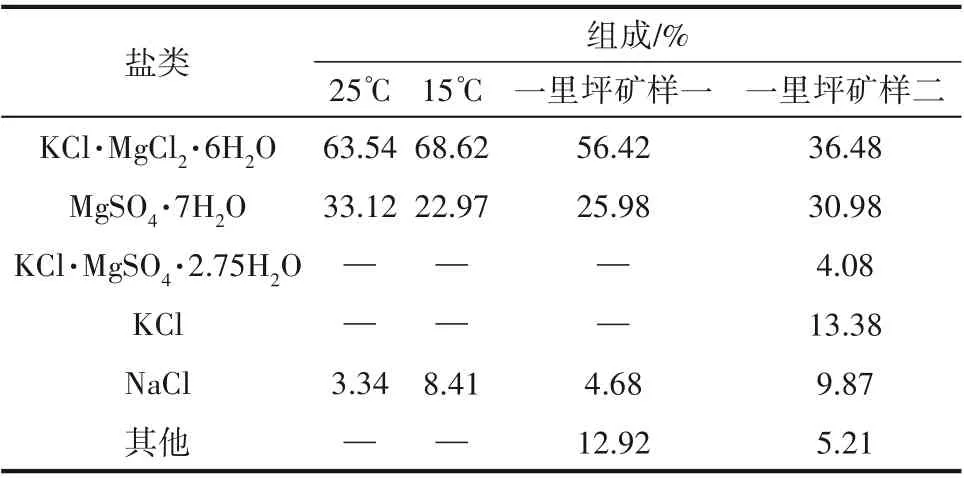
表1 硫酸鎂型光鹵石礦組成Table 1 Composition of magnesium sulfate type carnallite
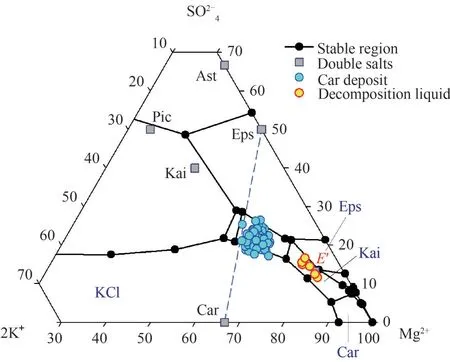
圖2 硫酸鎂型鹽田光鹵石礦組成點與分解液相點Fig.2 Composition points of magnesium sulfate type carnallite ore points and decomposition liquid
2.2 過程機理
2.2.1 光鹵石分解 光鹵石加適量水,氯化鎂全部溶于水,氯化鉀則部分溶解并形成固相,即:

硫酸鎂型光鹵石分解的同時,硫酸鎂水合物部分溶解,分解液滿足NaCl、KCl、Car 和Eps 四鹽共飽和,這一液相點在五元體系平衡相圖上并不存在,但在“介穩相圖”上為E′點,見圖1。
2.2.2 鉀鹽鎂礬的生成機制E′點處于五元相圖的鉀鹽鎂礬相區,存在轉化生成鉀鹽鎂礬的可能。如
果出現轉化,會有三種可能的轉化機制,如圖3 和圖4。

圖3 硫酸鎂型光鹵石轉化鉀鹽鎂礬的反應機制Fig.3 Conversion mechanism of magnesium sulfate type carnallite convert to kainite
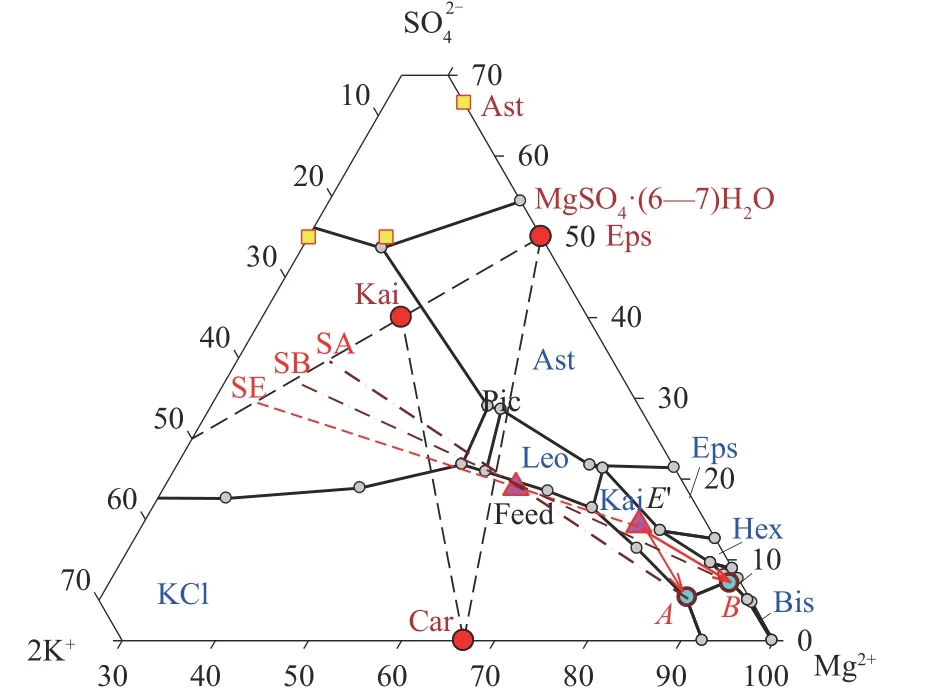
圖4 硫酸鎂型光鹵石轉化鉀鹽鎂礬的相圖分析Fig.4 Phase diagram analysis of magnesium sulfate type carnallite convert into kainite
機制一:光鹵石分解產生的氯化鉀和七水硫酸鎂轉化為鉀鹽鎂礬,如圖3(a),該過程反應物與產物的氯化鉀和硫酸鎂是等量的,因此反應前后的液相和固相的干基組成不變。釋放4.25 當量的水可使母液量增加。
機制二:如果固相氯化鉀過量,但七水硫酸鎂不足,如圖3(b),液相硫酸鎂與氯化鉀結合形成鉀鹽鎂礬。如圖4,液相點向Kai、Car、KCl、NaCl 共飽和的穩定平衡點A移動。
機制三:硫酸鎂水合物和光鹵石共存,并轉化為鉀鹽鎂礬,如圖3(c),釋放氯化鎂和水,使液相點向圖4中B點方向移動,B點為Kai、Car、Eps、NaCl共飽和點。
2.3 動力學方程
根據鉀鹽鎂礬形成的過程機制,Eps與Car共存時,液相點不動;Eps 消失后,液相點從“介穩”點E′向平衡點A轉移。兩個階段鉀鹽鎂礬生成的反應方程均為:

與反應式伴隨的還有Eps、Car、KCl 的溶解,但溶解速率受限于反應式(2)的反應速率。考慮到鉀鹽鎂礬的生成也是結晶過程,設定結晶速率的影響因素為2 個:液相離子濃度與平衡狀態的差異和鉀鹽鎂礬晶種的表面積。為此提出反應動力學方程:
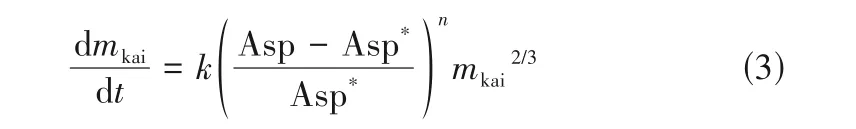

2.4 物料衡算方程
通過取樣點與初始配料的物料衡算,可以確定取樣時刻,液相量和固相中各鹽的量。衡算方程為:

其中,j= 1~6 是組分數(5 個離子和1 個水);Mi是光鹵石礦、水、底液、晶種(i=1~4)的配料量;No 為取樣點序號;Ci,j,CNo,j為配料和取樣點No 的液相濃度;S1~m是固相中鹽(Car, Kai, Eps, KCl, NaCl)的質量;Rk,j是鹽的離子計量系數;LNo是第No 點的液相質量。
3 結果與討論
3.1 轉化過程
從固液混合開始計時(t0),到確認系統達到平衡狀態,共持續50 h(t4),過程取樣22 組。取樣點的固液相離子濃度見表2 和表3。液相離子濃度隨時間的變化見圖5(a),固液組成在五元相圖上的位置見圖5(b)。從表2數據和圖5可見:t0~t1時段,液相數據波動較大;t1~t3時段,固液相離子濃度沒有明顯的和規律性的變化,如圖5(b)液相點在E′附近幾乎不動;t3~t4時段,圖5(b)液相點移動并趨近KCl、Car、Kai、NaCl四鹽共飽和點A。
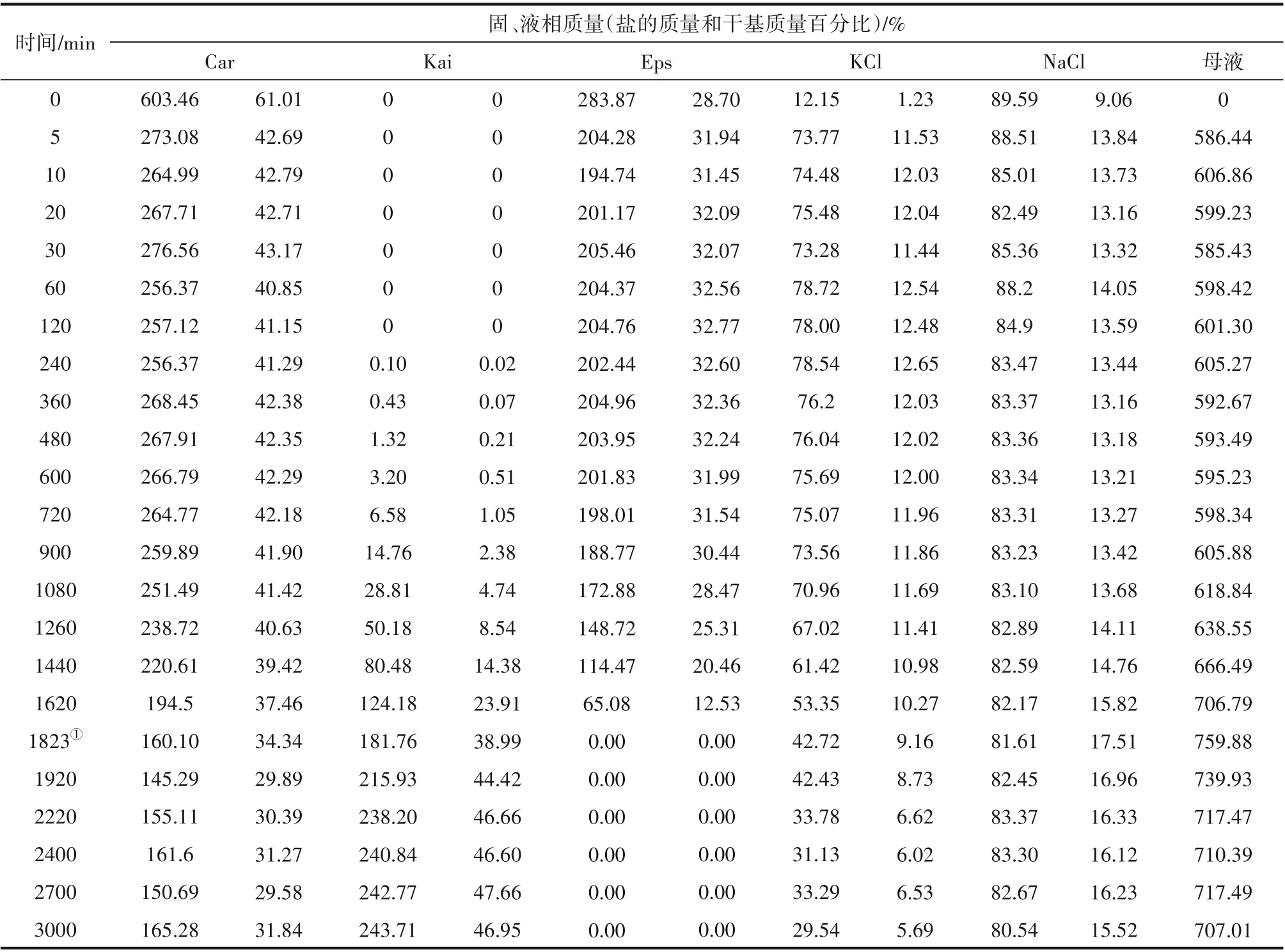
表3 25℃光鹵石礦加水轉化鉀鹽鎂礬過程的鹽類組成和母液量Table 3 Salt composition and mother liquor amount in the process of kainite converted from carnallite ore at 25℃
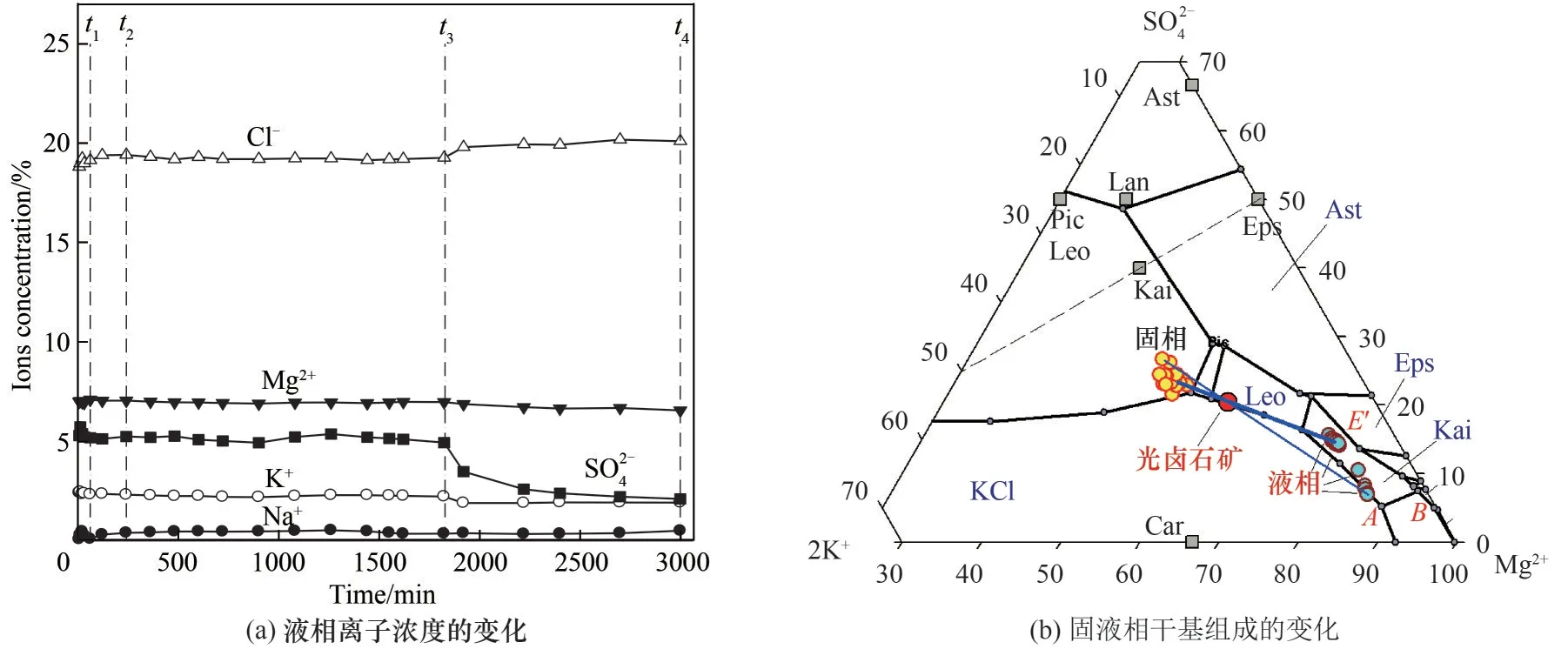
圖5 硫酸鎂型光鹵石礦加水轉化過程液相組成變化Fig.5 The liquid composition change in magnesium sulfate type carnallite ore decompose process
固液相點在t1~t3時段的不動和在t3~t4時段的移動說明:(1)KCl、Eps 和Car 共存時,液相點不變;(2)t1~t4過程有Kai 生成;(3)存在t3時刻,固相中Eps剛好全部溶解。也就是t1~t3時段符合機制一的特征;t3~t4時段符合機制二的反應特征。t3無法用實驗方法準確測定,也就無法確定t1~t3時段反應的程度。
為確定t1~t3時段鉀鹽鎂礬出現的時刻,比對時間點720、1260、1440、3000 min 的固相樣品XRD 譜圖(圖6),判斷鉀鹽鎂礬的存在屬性分別為:(a)不排除,(b)可確定,(c)很明顯和(d)肯定是。如果就此判定720 min 就是鉀鹽鎂礬出現的時刻,還是很勉強的,因為鉀鹽鎂礬復鹽的結晶度很差,尤其與氯化鈉、氯化鉀、七(六)水硫酸鎂XRD 特征峰很強的物質共存,鉀鹽鎂礬的XRD特征峰非常弱。

圖6 光鹵石礦加水轉化鉀鹽鎂礬過程的固相XRD譜圖Fig.6 XRD pattern of solid phase during carnallite ore decompose process
鹽量變化:在t1~t3階段,5 個鹽和液相共6 個變量,物料衡算只有5個獨立方程,只能結合動力學方程,求解各點的物料衡算方程,獲得每個鹽的質量,進而分析鹽類轉化規律。t3時刻之后,各點的Eps量為零,固相鹽和液相量可以直接衡算得到:如1920 min,Kai 量為215.93 g,占總固相量的44.4%,占Kai 全過程析出量的89.0%。下面的動力學研究確定t3時刻為1823.5 min,t1~t3時段鉀鹽鎂礬析出量占總量的84.9%。
用表2數據和相圖數據計算鉀鹽鎂礬的濃度積Asp和平衡態濃度積Asp*,得到圖7的Asp、Asp*隨時間的變化,其中虛線是t1~t3時段離子平均濃度計算的Asp。總體特征為:t1~t3時段Asp 在均值上下呈現明顯的波動,但其均值是Asp*的3.5倍;在t3之后Asp逐漸趨近于Asp*。這一結果表明,當硫酸鎂固相存在時,鉀鹽鎂礬的成鹽推動力(Asp-Asp*)大體恒定,反之則消耗液相的硫酸鎂直至推動力減為零。

圖7 鉀鹽鎂礬析出的過程推動力隨時間的變化Fig.7 Driving force changes of potassium magnesium alum precipitation process with time
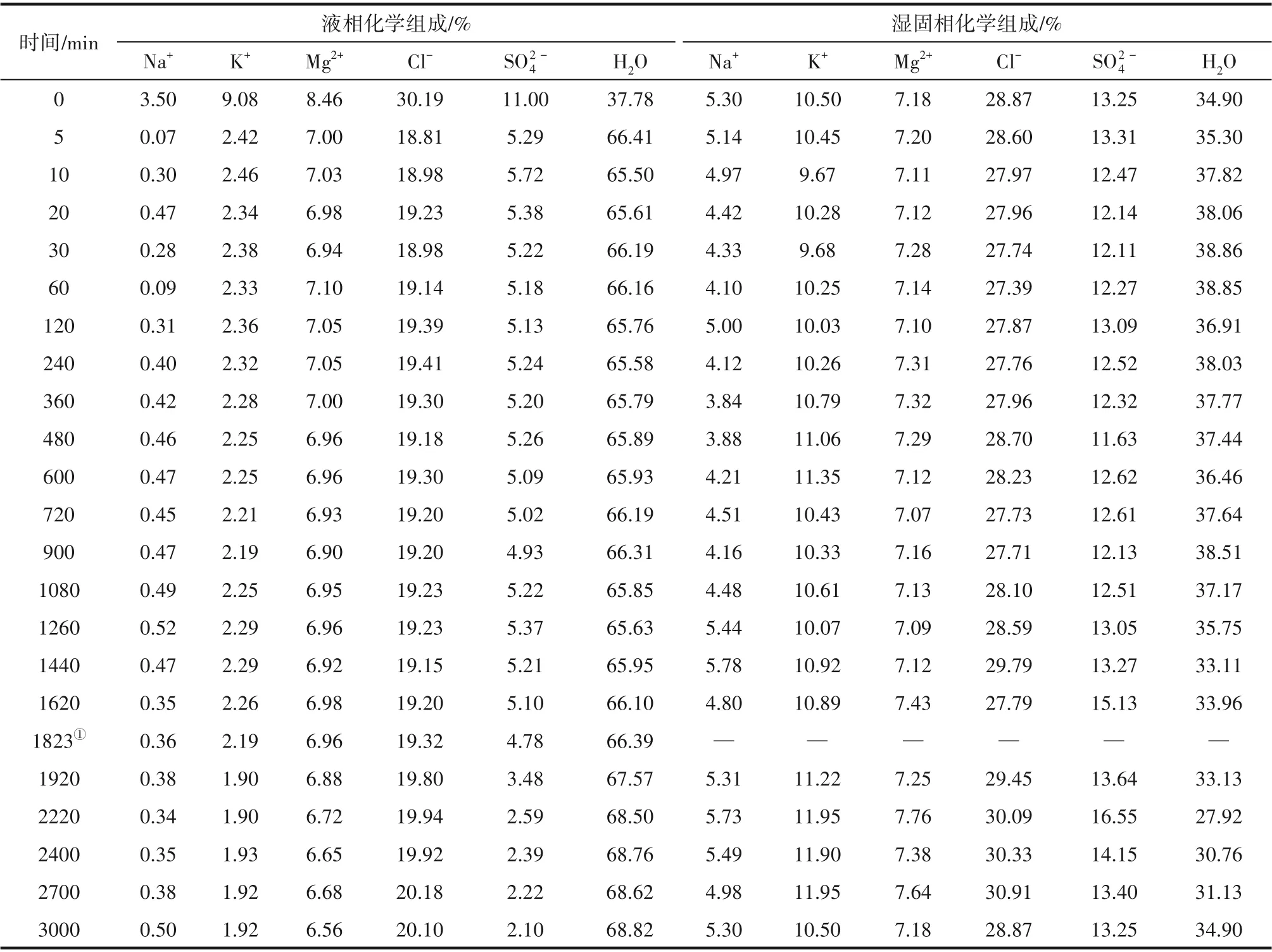
表2 25℃光鹵石礦加水轉化鉀鹽鎂礬過程的固液相離子濃度Table 2 Solid and liquid ion concentrations of kainite converted from carnallite ore with water at 25℃
3.2 動態模擬
過程模型:動力學方程式(3)和物料衡算方程式(6)構成了過程的動態模型。給定配料量,積分求解過程模型,可以確定體系狀態(液相量和各鹽量)隨時間的變化;模擬結果與實驗結果的匹配可以驗證動力學方程的合理性,并確定反應級數n和反應速度常數k。
約束條件:這是一個動態過程模擬的邊值問題。求解兩個待定參數應滿足兩個約束條件:(1)硫酸鎂水合物消失時刻t3的預測值,應在1620~1920 min 之間;(2)鉀鹽鎂礬累積量預測值在t3之后應與物料衡算結果相匹配。


3.3 過程分析
經過上述模擬,確定Kai生成的反應級數n和速度常數k分別為1.5和3.907×10-4mol1/3·min-1;硫酸鎂水合物的消失時刻t3為第1823.5 min;t3~t4時段的鉀鹽鎂礬析出量,預測值與測定值偏差為±1.2%。
用t2~t3時段各離子的平均濃度預測每個時間點Kai 的析出量;用離子平均濃度和實測濃度,分別對每個時間點的Car、Eps、KCl、NaCl 的鹽量進行衡算;所得兩組數據繪成圖8。曲線為基于平均濃度的預測值,散點為實測濃度衡算值,兩組的偏差分別為Kai±1.2%,Eps±2.5%,KCl±1.96%,Car±2.08%。結合圖8 可見,預測值基本反映了系統狀態(每個鹽的量、液相量)隨時間的變化規律。過程分析具體如下。
(1)加水時段(t0~t1),Car、Eps 分解和溶解量分別為330.39 g 和79.58 g,析出和溶解的KCl 分別占總鉀量的45.2%和15.3%。t1~t2固液穩定時段,大體為鉀鹽鎂礬的結晶誘導期。
(2)在t2~t3時段,硫酸鎂型光鹵石礦轉化,但液相組成大體不變,見圖5,此時固相發生著氯化鉀和Eps 轉化為鉀鹽鎂礬的過程,見圖8,此階段Kai析出并逐步增加,在720 min 的固相XRD 不排除Kai 存在,Kai 析出量占全部固相量的1.05%,由于含量較低和Kai 的XRD 特征峰并不明顯,到1260 min 時,Kai 量占總固相量的8.8%,XRD 可以判定其存在。
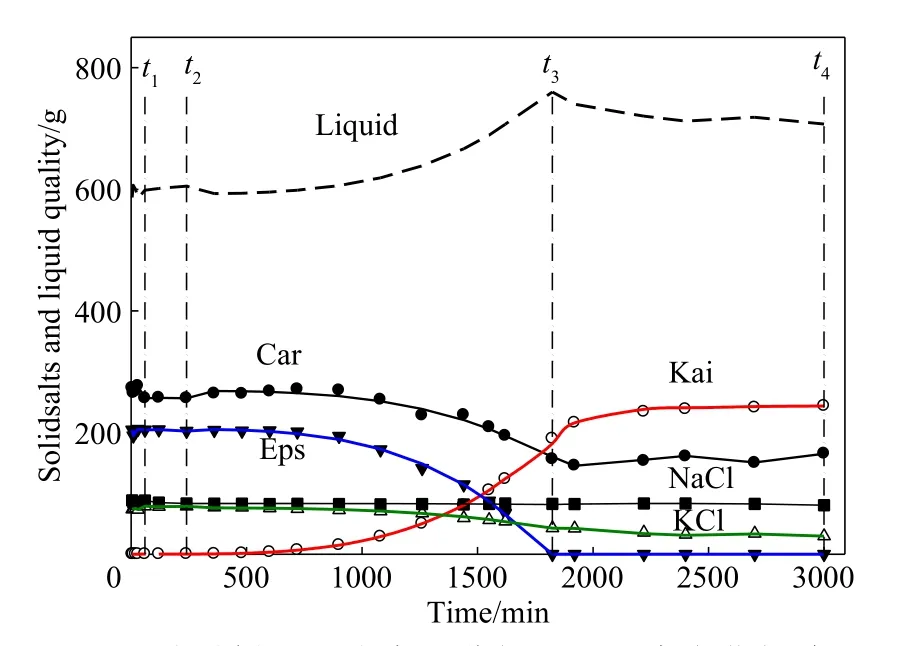
圖8 硫酸鎂亞型光鹵石分解過程鹽類變化規律Fig.8 Salts conversion behaviors in carnallite decomposition process
t2~t3時段,固液組成看似處于所謂的“介穩狀態”,實則是固相轉化的動態和液相的非平衡定態。
(3)Eps 消 失 的t3時 刻:Kai 已 析 出 總 量 的74.6%,Car 和KCl 固相存量分別降低到t2時刻的57.9% 和54.4%;此時光鹵石分解的氯化鉀,有32.6%為氯化鉀結晶,42.3%轉化為鉀鹽鎂礬,其余25.1%溶于液相;硫酸鎂的64.5%轉化為鉀鹽鎂礬,35.5%溶于液相。
(4)液相點移動時段(t3~t4);光鹵石存量大致不動,但氯化鉀降低到t2時刻的37.5%。
也就是整個轉化過程,光鹵石分解釋放的氯化鉀,僅有25.4%為氯化鉀結晶態,54.9%轉化為鉀鹽鎂礬,其余19.7%溶于液相;原礦中的硫酸鎂的85.6%轉化為鉀鹽鎂礬,14.4%溶于液相。
4 結 論
為了高效利用硫酸鎂亞型鹽湖鉀資源,弄清硫酸鎂型光鹵石加工鉀鹽收率低的原因,對硫酸鎂型光鹵石的分解轉化機制、動態規律進行了25℃不完全分解實驗和過程模型化研究,得到如下結論。
(1)硫酸鎂型光鹵石礦特點和轉化機制:硫酸鎂型光鹵石礦通常含有20%~33%硫酸鎂水合物;在光鹵石加水分解過程,硫酸鎂水合物具有與氯化鉀形成鉀鹽鎂礬的熱力學條件,經過3~4 h 的誘導期,鉀鹽鎂礬會逐漸形成,在達到系統平衡后,光鹵石分解的氯化鉀,僅有約25%處于氯化鉀結晶態,近55%轉化為鉀鹽鎂礬,其余20%則溶于分解液。
(2)對硫酸鎂型光鹵石礦在加水分解時所呈現的狀態有了新的認知:光鹵石與硫酸鎂水合物共存時,固液混合物中固相和液相組成大體不變,看似處于所謂的“介穩狀態”,但實際上處于氯化鉀和硫酸鎂水合物轉化為鉀鹽鎂礬的過程中,直到硫酸鎂水合物缺失,液相點的化學組成才開始變化。
(3)鉀鹽鎂礬的離子活度積與共飽和點活度積之差是鉀鹽鎂礬生成的推動力,反應級數為1.5,產物存量對生成速率的影響指數為2/3,反應速率常數為3.907×10-4mol1/3·min-1。動力學方程與全組分物料方程構成了動態模型,可量化表達轉化過程中任意時刻固液混合體系的狀態。
這一研究掌握了硫酸鎂型光鹵石特性、過程機制和動態規律,在理論上澄清了關于介穩現象的認知,對鹽湖鉀資源利用過程的改善具有指導意義。

