UGT2B28、FABP5、CYP2C9基因在脂肪酸代謝異常所致大鼠肝纖維化發生中的作用
宋敬茹 武超 曹紅燕 謝咚 王錚 劉璐 王丹 孫明瑜 邊艷琴
二甲基亞硝胺(Dimethylnitrosamine,DMN)誘發的肝纖維化大鼠模型已成為研究肝纖維化及肝硬化的經典動物模型[1,2]。研究證實,肝星狀細胞活化后轉化為肌成纖維細胞分泌大量細胞外基質,導致細胞外膠原沉積增多[3]。前期研究采用全基因芯片結合生物信息學分析技術,發現脂肪酸代謝異常是DMN誘導肝纖維化發生的另一重要原因[2]。本研究在前期研究基礎上,對生物信息分析結果深入挖掘,以期闡明脂肪酸代謝異常引起大鼠肝纖維化發生的重要機制。
資料與方法
一、實驗動物與材料
(一)動物 Wistar大鼠,雄性,體質量(200±15)g,清潔級,購自中國科學院上海實驗動物中心。動物合格證:SCXK(滬)2008-0003。于上海中醫藥大學實驗動物中心進行飼養、造模及觀察,自由飲食。
(二)試劑及儀器 甲醛、甲醇、中性樹膠、二甲苯、無水乙醇等均購自國藥集團化學試劑有限公司;DMN購自和光純藥工業株式會社;石蠟購自德國Leica公司;天狼猩紅購自美國Sigma公司;基因檢測及分析所需試劑及儀器設備均由上海生物芯片公司提供。
二、實驗方法
(一)造模方法 參照Ala-Kokko方法造模[4]。模型組大鼠以10 mg/kg劑量于每周前3天連續腹腔注射0.5% 的DMN溶液(以0.9% NaCl稀釋),持續共4周,對照組大鼠腹腔注射等量的0.9% NaCl。分別在造模2周末、4周末殺鼠取材評估組織病理變化。
(二)樣品的采集與處理 在實驗2周末和4周末,采用3%戊巴比妥鈉,以2 ml/kg劑量腹腔注射麻醉后,打開腹腔,經下腔靜脈采血。待血液抽凈后,摘取肝臟,然后選取肝臟最厚一葉作為目標組織,切取1.0 cm×1.0 cm肝組織2塊,4%甲醛固定,剩余肝組織EP管中-80℃保存備用。組織標本經過脫水、包埋、切片處理后,進行HE和天狼猩紅染色[5],觀察組織病理學變化。采集血液4℃靜置3 h后, 以3000 r/min離心15 min,分離血清,-80℃保存備用。ALT、AST、TC和FFA檢測按照試劑盒說明書進行。
(三)肝組織基因芯片雜交實驗 采用Trizol試劑盒提取總RNA→純化→合成cDNA→純化,參照BioArray(TM)HighYield(TM)RNA轉錄標記試劑盒方法合成cRNA→將cRNA片段雜交于Afymetrix Rat2302.0芯片→洗脫→染色→掃描芯片。基因芯片:Afymetrix Rat2302.0基因表達譜芯片,共載基因探針31099個。
(四)基因芯片的數據處理、差異基因篩選和生物信息分析 基因芯片的數據處理、差異基因篩選和生物信息分析參照文獻[6]。利用R語言進行通路富集分析,利用 Cytoscape 3. 8. 0繪制差異基因參與的脂代謝信號網絡圖。
三、統計學分析

結 果
一、各組大鼠肝組織病理變化
HE染色結果提示,與對照組比較,造模2周時,肝組織內可見大量炎細胞彌漫分布于肝竇內,肝臟結構開始出現紊亂;隨著造模時間延長,肝組織開始出現廣泛的肝細胞壞死、肝小葉結構消失。膠原沉積在中央靜脈和門脈區并開始向肝竇蔓延是肝纖維化形成的標志。天狼猩紅染色結果示,相較于對照組,造模2周組位于中央靜脈及門脈區域的結締組織明顯增多,并向肝竇持續蔓延,形成不完全間隔,提示肝纖維化形成;造模4周時膠原纖維明顯較2周時增多、增厚、變粗,相鄰的纖維間隔之間彼此連接、并包繞肝小葉形成假小葉,肝臟結構被改變,膠原沉積明顯增多,提示肝纖維化已向肝硬化轉變,造模成功。見圖1。

A、B、C:HE染色×200;D、E、F:天狼猩紅染色×100
二、各組大鼠肝功能與血脂變化
隨著造模時間的延長,大鼠血清ALT、AST呈現遞增性上升,TG先升高后降低,FFA含量先降低后升高。如表1所示,與對照組比較,4WDMN組大鼠血清ALT、AST酶活性明顯升高,且差異有統計學意義(P<0.05);2WDMN組大鼠血清TG升高,但差異無統計學意義(P>0.05)(考慮是樣本離散度太大);2WDMN組大鼠血清FFA明顯降低,且差異有統計學意義(P<0.05);4WDMN組大鼠血清TG與FFA含量與對照組比較差異無統計學意義(P>0.05)。
三、差異基因分析
選取差異表達大于2倍的基因,并比對其中共同存在的差異基因。2WDMN組與對照組比較顯著差異基因數目共有133個,4WDMN組與對照組比較顯著差異基因共有98個,兩組共同的差異基因共有55個。55個共同差異基因中,上調的基因有40個,下調的基因有15個。在上調基因中,UGT2B28、FABP5為變化最為顯著基因,在2WDMN中變化差異倍數均大于5倍,UGT2B28同時在4WDMN組中變化差異倍數也大于5倍;在下調的基因中,CYP2C9、STAC3、MLC1為變化最為顯著基因,在2WDMN、4WDMN中變化差異倍數均大于4倍。
四、共同差異基因參與生物學功能及信號通路
分析55個共同差異基因參與調控的生物學功能及信號通路,對共享基因功能富集,根據Pvalue值從高到低排列,結果顯示共享基因參與的前10條通路,其功能主要涉及蛋白酶結合、細胞外基質合成、脂肪酸代謝等方面,見圖2。其中,參與脂肪酸代謝功能的通路共有5條, CYP2C9、FABP5、UGT2B28參與了脂代謝所有信號通路,見圖3,提示這些基因在DMN誘導脂代謝形成中發揮重要作用。

圖2 共享差異基因功能富集分析
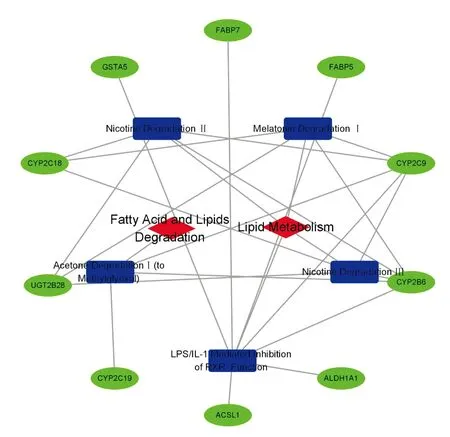
圖3 差異基因參與的脂代謝信號網絡圖
討 論
脂質代謝紊亂與肝星狀細胞激活相關,可促進肝纖維的發生發展[7,8]。本研究采用全基因芯片技術,發現差異基因主要參與脂代謝、炎癥、免疫和血管新生的調控,可能參與了肝纖維化的發生發展。DNA 的損傷修復貫穿于肝纖維化的發生、發展過程,脂肪酸的代謝紊亂在肝纖維化向肝硬化動態演變的過程中發揮了重要作用。以脂肪酸合成增加為主的脂代謝紊亂,早于肝臟炎癥反應,是肝纖維形成的機制之一[9]。

表1 各組大鼠血清肝功能及血脂變化(±s)
全基因芯片深入挖掘后,3個基因調控明顯。在下調基因中,隨著肝纖維化的加重,CYP2C9逐漸下調。CYP2C9是細胞色素P450家族2亞家族的C型成員之一,與藥物代謝以及類固醇、脂肪酸的合成相關[10,11]。CYP2C9的表達水平可以反映肝臟的功能,其在慢性肝病患者中較正常人下調[12]。在肝硬化進展之前,CYPS活性被選擇性地改變,肝臟疾病會不同程度地影響CYP亞型的活性[13]。CYP2C9蛋白在肝硬化、肝癌患者中表達均降低,CYP2C9高表達的肝癌患者生存率較高[14]。CYP2C9的下調提示肝纖維化發生發展過程中,肝功能的受損程度加重。研究提示在DMN誘導的肝纖維化大鼠模型中,花生四烯酸代謝紊亂可能促進肝纖維化的發生發展[5]。
在上調基因中,共享差異基因FABP5在2周、4周模型組中明顯上調大于5倍。FABP5是細胞內脂肪酸結合蛋白家族之一,與硬脂酸和亞油酸可以高度親和,參與FAA的攝取、結合、轉運和代謝 ,參與炎癥反應和能量代謝[15]。同時與腫瘤的發生相關,在HCC、肝內膽管細胞癌等顯著上調[16,17]。研究發現,FABP5在LPS誘導的急性炎癥反應中起調節作用[18]。FABP5在巨噬細胞中高表達,FABP5的沉默對LPS誘導的肝損傷具有保護作用,并有利于抗炎反應,FABP5-PPARγ信號通路可能促進HSC激活[19]。肝纖維的發生發展過程中,脂肪酸代謝紊亂發生在炎癥之前,并可能加重炎癥的發展。FAPB5在肝纖維發生的前期主要參與脂肪代謝紊亂,后期主要參與炎癥反應。
在上調基因中,共享差異基因UGT2B28在2周、4周上調均大于5倍。UGT2B28是UGT2B亞家族一員,負責膽汁酸和性激素的代謝[20]。UGT2B28基因變異與肝癌的發病年齡、復發、遠處轉移和死亡有關[21]。本研究發現UGT2B28在肝纖維化形成和發展的過程中上調,提示UGT2B28可能是肝纖維化加劇的預測因子之一。
綜上,肝纖維發生的早期存在明顯的脂肪代謝紊亂,以基因轉錄水平調整的脂肪酸紊亂,可能是逆轉肝纖維化向肝硬化轉化的策略,可以為進一步評估肝纖維化的療效奠定基礎。

