純物質分子受到的分子間引力及其應用研究
——利用平均場理論計算
*趙仁興
(河北科技大學 河北 050018)
分子間作用力是指兩個或多個分子之間除了離子鍵、共價鍵和金屬鍵外的其他弱相互作用力,常表現為范德華力、氫鍵等[1]。分子間作用力包括引力和斥力,但在絕大多數情況下,維系物質存在的是和斥力平衡后的引力。物質分子受到的引力大小決定了物質的熔點、沸點、臨界溫度、汽化熱、熔解熱、密度、表面張力、黏度、擴散系數等物理性質,同時和不同物質之間的溶解度、結晶、吸附等有關。
從1873年范德瓦爾斯建議引入引力、斥力將理想氣體狀態方程修正為VDW方程[2]以來,關于分子間作用力的研究一直持續不斷。1912年葛生(Keeson)研究了極性分子(永久偶極矩)之間的相互作用,1921年德拜(Debye)分析了極性分子與非極性分子之間(永久偶極矩和誘導偶極矩)的相互作用,1930年倫敦(London)研究了非極性(瞬間偶極矩與誘導偶極矩)分子之間的相互作用,以后又不斷推出氫鍵、靜電作用、π-π堆積及荷電基團、疏水基團等的相互作用[1]。我國學者金松壽等[3]20世紀80年代推出了選擇性分子間引力理論。
具有代表性的分子間作用力公式有兩個極性分子(永久偶極矩)之間吸引的平均作用能公式[4]和分子間總的相互作用勢能蘭納德—瓊斯公式[5]。
上述研究極大地推進了物質物性的估算、結構的研究及新材料的制備等,但至今為止物質的吸附、色譜分離、溶解度、沸點等仍不能用分子間引力及氫鍵能等直接進行量化的計算,只能作些定性推斷。
量子化學也將分子間力的研究作為一個重要目標。近二十年來量子化學的從頭計算法有了很大發展,可用來預測分子的結構和能量,但由于分子之間作用復雜并形式多樣,限制了其計算的精度[6]。
我國利用分子間引力也開展了多方面的研究,其中包括制冷劑性能、汽化熱和沸點的計算、表面活性劑自組裝調控、金屬表面小分子吸附、共沸物的研究等[7-10]。
物質是眾多分子的聚集,因此除需了解兩兩(例如偶極矩—偶極矩之間)分子間的作用力外,也需要得到分子在物質中受到的總引力,并且只有在了解總引力的基礎上,才能更好的了解物質本身。在充分了解不同基團之間的分子間作用后就可有目標的組合不同的基團,生產更好的產品,供人類使用。
基于上述考慮,本研究采用和以前研究不同的方法計算分子間引力。物質所表現的宏觀性能,應該是分子在物質內部或表面所受到的綜合作用力決定的。為此該研究從分子熱運動的平均場出發,利用汽液平衡時的汽化熱,在不考慮不同引力種類的前提下,計算任意一個單分子在純物質中受到其周圍分子的作用力之和,本文給出了常見單質氣體純物質分子受到的引力及相應的位能,同時從引力出發給出了物質臨界溫度、臨界壓力、表面張力的計算方法,并將計算結果和實測值進行了比較,具有較高的一致性。本項目分子間引力的研究方法和傳統研究有很大不同,是一種全新的分子間相互作用的研究方法。
1.研究使用的公式和推導過程
(1)靜電力公式
有關研究認為分子間力為長程力[11],作用范圍為0.3~0.5nm,但和水分子偶極矩尺寸6.20×10-23nm比較,在其作用范圍內仍包含有大量的其他分子。因此本研究認為純物質中單個分子所受到的作用力,是其周圍無數分子的共同作用的結果。在汽、液相變過程研究范圍內,由于單個分子占據的名義體積較大,分子間的斥力對物質宏觀性質尚不起決定性作用。考慮分子的熱運動引起的物質同一相內分子性能的均勻性,按平均場定義純物質中單個分子受到周圍分子引力的總和為:

式中:
F—任一物質分子在純物質中受到周圍分子的引力標量之和(不考慮方向)。
f—和純物質分子特性有關的引力系數,f也可表示為f=a1×a2,a1為某分子外其他分子對其能產生引力的綜合因子;a2為某分子自身具有的能和周圍其他分子產生引力的綜合因子。本研究以f代替了諸如永久偶極矩、誘導偶極矩或瞬時偶極等因子,但應該是某分子原子核的正電荷或核外電子與其他分子的原子核電荷、核外電子之間的相互作用系數,同時將4πε0也納入了f中,因此f值和以往研究的相應數值無法進行直接比較。
f′—某一對分子之間的引力系數。
n—某分子受到引力作用的分子對數。
r′—分子引力的作用半徑。以往分子相互作用的研究中,一般定義r′為兩個分子質心間的距離。本文定義分子引力的作用半徑為某分子原子核和相鄰最近分子電子云之間的距離,計算公式如下:
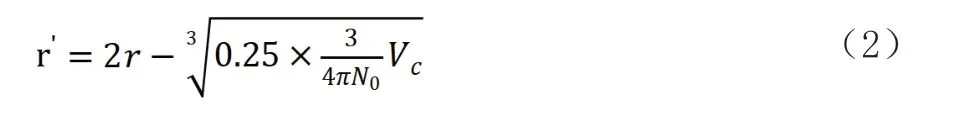
式中:Vc—臨界點時的摩爾體積;
r—定義為分子的引力平衡半徑。任何物質在壓力、溫度不變的情況下,其密度一般不會發生變化,因此可以認為在一定壓力、溫度下,分子所占有的名義球體體積的半徑即是分子間引力平衡半徑。
在單一物質均相無序狀態下,分子引力平衡半徑r的計算式如下:

式中:V—摩爾體積;N0—阿伏伽德羅常數。
必須說明的是r值會隨物質溫度、壓力而發生變化。
某物質分子原子核與電子云之間的距離按該物質臨界容積的0.25倍計算出的球體半徑。按羅于根《元素電離能與原子的實際半徑》中的計算,基態氫原子電子到核的距離為5.296×10-11m,氦原子為5.293×10-11m,兩者基本一致。按氫、氦臨界容積0.25倍計算出的氫分子、氦分子電子云半徑分別為4.81×10-10m、4.63×10-10m,約為按電離能算出原子半徑的10倍。
計算的中心分子和其外圍的第二層、第三層分子等的距離可以為等表示。
本研究為簡化計,不考慮周圍密接分子數及不同距離的分子數,所有其他因素綜合為f值。必須注意的是,因為我們采用的是汽化熱計算出來的f值,因此它是周圍分子對某一分子引力的綜合系數,是由周圍具有相同距離的分子及多個倍數距離分子共同作用的結果,這種假定的不足之處來源于:由于不同元素或化合物外層電子的多少,0.25倍Vc發生的變化;不同分子層引力的距離與單一距離的不同。
(2)汽、液相變過程中的蒸發熱和單分子引力系數的計算
①汽、液相變過程中的能量
相變是物質在自然界存在的一種最重要的過程,其中包括汽—液、汽—固、液—固相之間的相變及固體結晶內部不同相的變化。
汽、液相變過程中摩爾分子吸收的熱量[12]為;
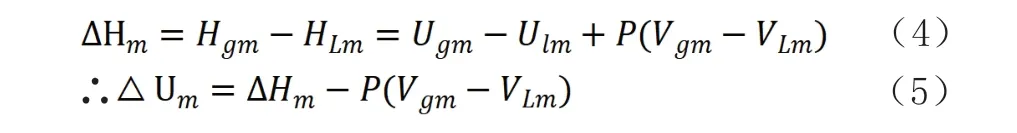
②由汽化熱計算單分子引力系數的公式
“汽化熱包括兩個組成部分,P(Vg-Vm)是液體汽化時擴大體積所需對外作的等壓功,而Ug,m—UL,m是液體分子變為相同溫度下的氣體分子所需克服周圍分子吸引力作的功”[13]。在汽液平衡時,氣相和液相分子均已有相同的溫度和壓力,因此在分子由氣相分子凝結成液相分子或由液相分子汽化為氣相分子時(按分子運動論,分子的動能和壓力、溫度有關),不會有壓力、溫度的變化,分子的動能不會再發生變化,汽體、液體內分子動能是相等。因此在汽、液相變化中需要克服分子間引力的作用、需吸收外環境的熱量或放出熱量。
根據引力公式可得:
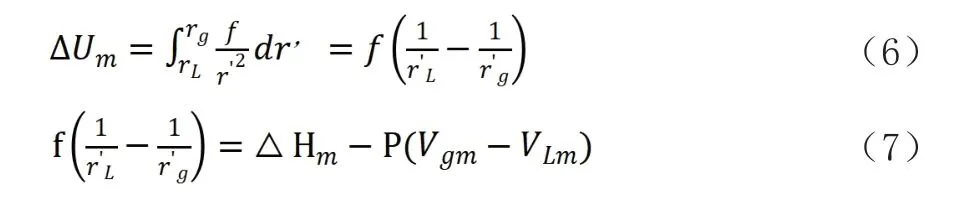
式中:ΔHm、ΔUm、Hgm、HLm、Ugm、ULm、Vgm、VLm—分別是汽化時摩爾焓、內能的變化及液體、氣體的摩爾焓、摩爾內能、摩爾體積。P為汽化時的壓力。公式(7)進行單位換算后,可用于實際計算引力系數的公式為:
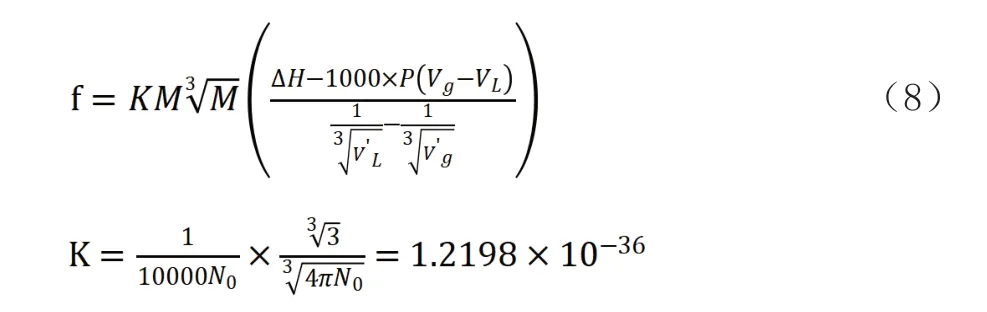
式中:f—純物質中單個分子的引力系數(kJ·m);
M—分子量;
N0—阿伏伽德羅常數(6.023×1023);
△HM—汽化熱(kJ/kg);
P—汽化時的壓力(MPa);
Vg—飽和氣體比容(m3/kg);
(3)單分子引力計算
根據引力系數計算公式,單個分子受到的引力計算公式如下:

式中:Vg′—飽和氣體比容(m3/moL);VL′—飽和液體比容(m3/moL);FL、Fg—飽和液體或氣體中單個分子受到的引力(N)。
(4)氣相、液相摩爾分子間的引力位能計算公式
根據位能的加和性能,摩爾分子間的引力位能Eg、EL的計算公式:

式中:Eg、EL—摩爾分子引力位能(kJ/mol);
其余符號同前。
2.常見氣態元素引力系數的計算結果和討論
(1)常見氣態元素的物理性質
本文計算用的10種元素熱力學數據除氯外均來源于參考文獻[13-14]。
(2)常見氣態元素分子間引力系數和溫度之間的關系
依據式(2)定義的引力計算半徑和式(8)計算出的常見氣態元素單分子引力系數和溫度之間的關系見圖1~圖5。
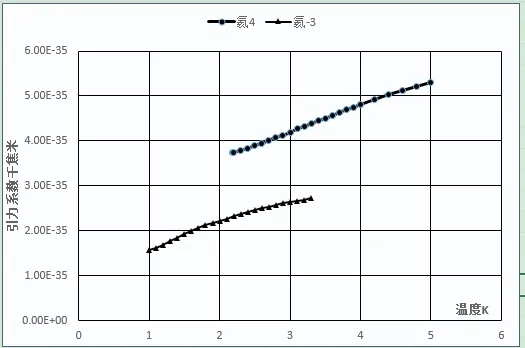
圖1 氦3、氦4引力系數和溫度關系曲線
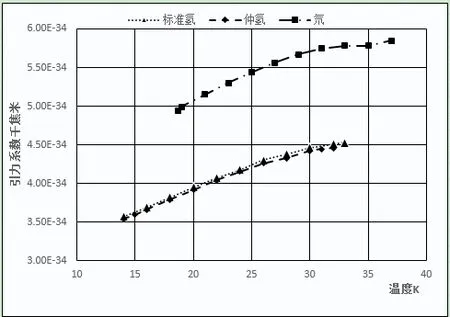
圖2 氫、仲氫、氘引力系數和溫度關系
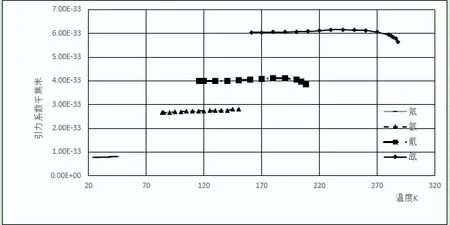
圖3 惰性元素引力系數和溫度關系
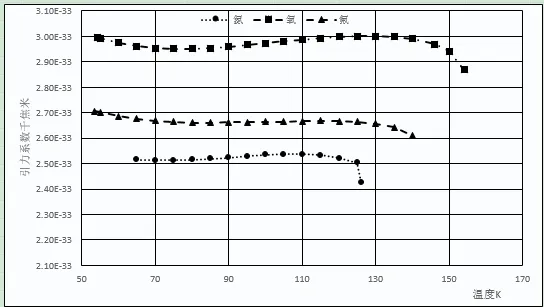
圖4 氮、氧、氟引力系數和溫度關系
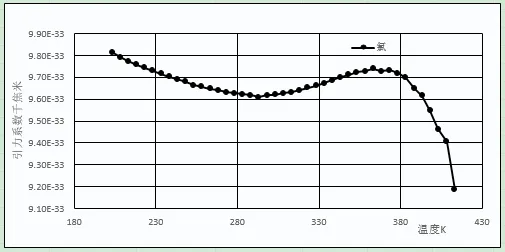
圖5 氯元素引力系數和溫度關系
上述10種元素的偶極距均為零,說明上述元素的分子之間引力主要來源于色散力。隨溫度上升,不同元素的引力系數變化各有不同。第一周期氦、氫元素,無論是氦3或氦4、標準氫或仲氫、氘分子間的引力系數均隨溫度的上升而直線上升,說明第一周期元素色散力會隨溫度的上升而增加,相對偏差較大。
其他周期元素的變化相對平穩,熔點到臨界點溫度范圍內引力系數與平均值相對偏差的平均值為0.34%~1.34%。不同元素的平均引力系數及相對偏差如下:氦3(2.23E-35,13.65%)、氦4(4.41E-35,9.14%)、仲氫(4.01E-34,7.81%)、標準氫(4.13E-34,6.92%)、氘(5.475E-34,4.70%),氖(6.33E-34,1.34%)、氟(2.66E-33,0.44%)、氮(2.52E-33,0.61%)、氬(2.71E-33,0.68%)、氧(2.97E-33,0.70%)、氪(4.01E-33,0.70%)、氙(6.07E-33,0.58%)、氯(9.66E-33,0.73%)。引力系數較大的元素,如氧、氮、氯、氪、氙等在臨界點附近,引力系數有明顯下降。分子引力系數越大的元素,引力系數下降越明顯,可能是靠近臨界點時氣相中分子的聚集[15]行為所造成的。本文認為通過一個公式能將元素不同氣、液相飽和溫度下4種數值相差很大的數據,計算出一個表征元素分子間引力并相對一致的數值,即使計算出的引力系數不是絕對正確,但這一相對穩定的數值體現了該元素的一種本質屬性,應具有較大的物理意義。
(3)不同元素引力系數的比較
不同元素引力系數變化的規律為:
①在周期表同一周期中外層電子數飽和的惰性元素引力系數最小,其他元素的引力系數相近,但隨外層電子數增加依次有所增加;
②在周期表同一列中,從上到下外層電子數越多,引力系數越大,也說明了分子間引力是原子核正電荷與核外電子的相互作用所引起的。
(4)單個分子的引力、克分子引力位能的計算結果
依據公式(9~12),不同元素計算溫度范圍內,飽和液相、汽相單個分子受到的引力和的克分子引力位能(焦耳)如下:氦3(32-44.7,3.63-35.3)、氦4(85-103.4,11.1-61.8)、仲氫(809.9-919.4,60.8-511)、標準氫(703.62-854.52,62.8-561)、氘(1099-1232,107.3-652),氖(1241-1743.7,161-911.4)、氟(4819-7209,91-2761)、氮(3537-5792,345-2947)、氬(4223-6407.8,547-3232)、氧(547-3232,85-3575)、氪(5929-8930,743-4423)、氙(8741-12423,1046-5657)、氯(20861.7-12974,865-8774)。在氣液平衡狀態下不同溫度時氣體或液體內的單分子受到的引力是不同的,在所計算的物質中氦3分子受到的引力最小,氯分子受到的引力最大;依據臨界點附近的數據外推得到臨界位能和臨界溫度的關系是正相關,相關系數達到0.998699。由于溫度是分子動能的量度,在分子的動能和位能達到某一平衡時會出現臨界狀態。
圖6、圖7給出了氧元素汽、液相中克分子引力位能及單個分子受到引力隨溫度的變化。隨溫度上升,液相中的單個分子受到的引力的下降速率大于引力位能的下降速率;汽相中單個分子受到的引力的上升速率小于引力位能的上升速率。
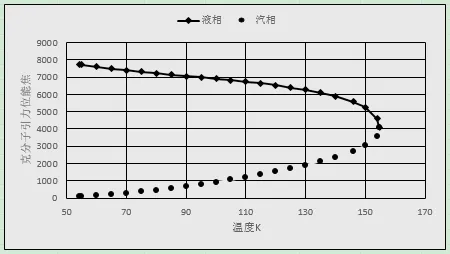
圖6 汽液相中克分子氧的引力位能隨溫度變化

圖7 汽液相中氧分子受到的引力隨溫度變化
將同一溫度下汽、液兩相克分子位能進行平均,其平均值和溫度線性相關系數基本接近于1,說明汽、液平衡時分子動能和分子間的位能應滿足一定的關系,圖8給出了氦4的示例。
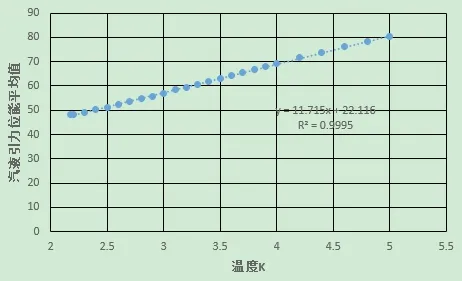
圖8 氦4液汽相克分子位能的平均值和溫度的關系
(5)和其他方法計算出的分子間力的比較
《建立分子簡化模型用經典電磁理論探析分子間作用力》說明了分子間引力、斥力、分子電流安培力之間的關系[16],同時計算了氦分子的分子間力,本計算和其計算出的引力比較見表4,差別未超過數量級,計算結果有可比性,同時說明了本文計算出的分子間引力具有一定的可靠性。

表1 氦分子間引力計算結果和其他研究結果的比較
3.利用分子間引力計算物質的臨界溫度和壓強
(1)分子間引力和臨界溫度、壓強關系式推導
對式(8)進行變換,增加一個不可壓縮的量則可得到下式:
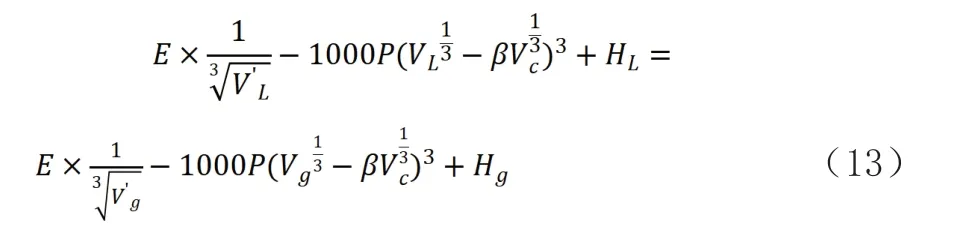
經推導到臨界點:
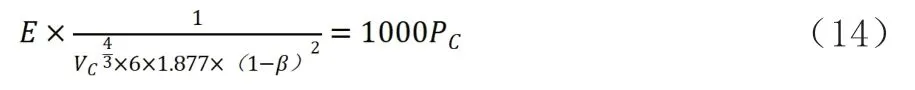
式中:E—平均公斤引力系數(kJ·m·kg-4/3),E=f/
Vc—臨界容積(m3/kg);
β—臨界態修正系數,無量綱;
Pc—臨界壓強(MPa)。
該式說明臨界點的氣壓和物質引力系數與(Vc)^(3/4)的倒數乘積成正比。
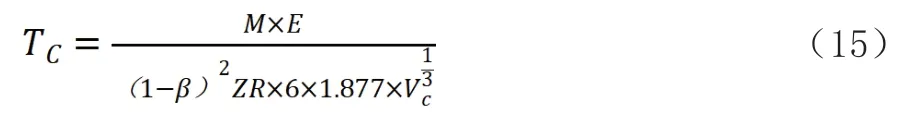
式中:R—8.3145(kJ·mol-1·K-1);Z—壓縮因子。
(2)計算結果和討論
①相關方程計算結果
圖9、圖10分別給出了第一周期五種元素、同位素和其余元素分子間引力系數(沸程內的平均值)和臨界體積4/3方倒數的乘積與臨界壓強的關系曲線,R2分別達到0.9679和0.9805,利用相關系數反算出的臨界壓力見表2,計算結果表明誤差在可接受范圍內。圖11、圖12、圖13、圖14給出了分子間引力系數(沸程內的平均值)和臨界體積^(1/3)方倒數的乘積與臨界溫度、沸點關系,同樣具有良好的正相關性。結果證實了本文提出引力關系式的推論,間接證實了利用汽化熱計算分子間力的可行性,同時可以看到分子間引力系數越大,物質的臨界點、沸點溫度越高。
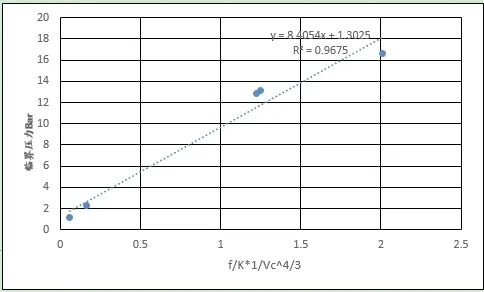
圖9 第一周期元素引力系數/臨界體積^(4/3)的關系

圖10 其余元素引力系數/臨界體積^(4/3)的關系

表2 利用回歸曲線計算出的臨界壓力和臨界溫度
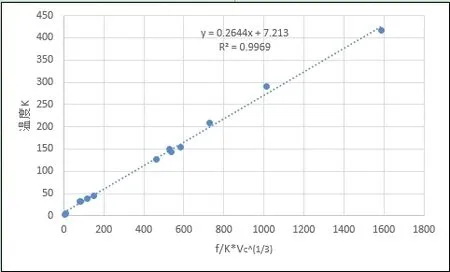
圖11 引力系數/臨界體積^(1/3)與臨界溫度關系
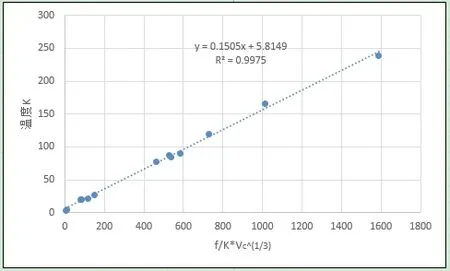
圖12 引力系數/臨界體積^(1/3)與沸點溫度關系
(3)通過引力公式直接計算臨界壓力、臨界溫度
由公式(14)(15)可知,在由分子間力計算臨界壓力、臨界溫度時需要確定β值。在不作β修整時,采用的引力系數是元素沸程范圍內的引力系數的平均值,每個元素代入壓縮因子Z為實際壓縮因子條件下計算出的臨界溫度、臨界壓力和實際值相差較大,不同元素臨界壓力相對誤差絕對值為16.81%~53.78%;臨界溫度為8.24%~53.86%。但考慮到是由引力直接計算出來的,臨界壓力、溫度的誤差在50%以下,應當說引力的假設是基本成立的。每個元素求得的臨界壓力、臨界溫度修正值β,除氦4外,溫度修正的β和壓力修正的β值基本一致,氬、氪、氙、氮、氧、氟、氯為-0.1351~-0.2158。第一周期元素的β變化較大,標準氫、仲氫、氘、氦4、氦3臨界壓強的β值分別為0.08896、0.0791、-0.0407、0.2109、0.319,臨界溫度的β值分別為0.0672、0.0791、-0.0407、-0.1747、0.3193。
4.由分子間引力計算飽和液體的表面張力
(1)公式推導
至今尚未有直接利用分子間力計算表面張力方法,現擬采用計算出的引力計算不同溫度下的表面張力。在液相和氣相的邊界層被認為是具有和氣相、液相完全不同性質的第三相。由于邊界層(表面相)兩側承受到的吸引力不同,表面處于張緊狀態,并傾向于保持最小的表面積。表面張力一般用γ表示,定義為表面上單位長度的力,達因/厘米。純質液體表面張力的估算公式有:Quayle的等張比容法、Sastri的對比關聯式等,產生的誤差一般在5%以內[17]。
汽液兩相接觸時,由于兩相內部引力不同,液體表面自由能ΔG=γdS。在等溫等壓下,液體形成新表面時吉布斯函數的變化應等于除體積功外的其他功。依據前面的公式,該功應是分子間引力所作的功。根據推理,形成新的汽液表面時,分子間引力作的功為:
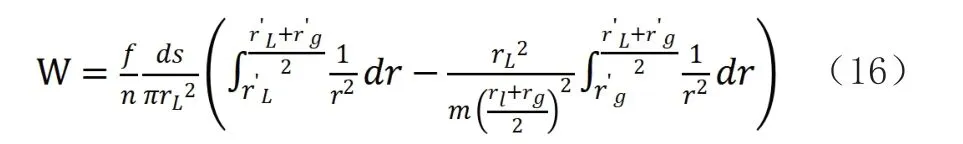
公式的前一部分是指的液體分子由內部進入表面時克服液體分子間引力所作的功;后一部分為氣體分子和液體分子接觸形成表面時,氣體分子引力所作的功。
式中:f—分子間的引力系數。n—某進入液體表面的中心分子最鄰近的分子數,為滿足表面自由能最小的條件,每個表面分子一般只失去一個鄰近分子,因此為1/n,實際引起表面張力不僅是第一層分子,也有其他層的分子,因此n一修正量,dS/π。r2—單位表面積含有的分子數。r—液體分子名義半徑;積分第一項為分子引力由液體內半徑為r進入表面到半徑為過程中作的功;后一項為dS面積上氣體相對于液體分子數的比例及氣體分子由氣體內進入到汽液表面氣體分子內引力作的功,實際氣體也有多層分子做功為此加入第二修正量m。汽液界面上氣體分子和液體分子受到的引力應該相等,因此:
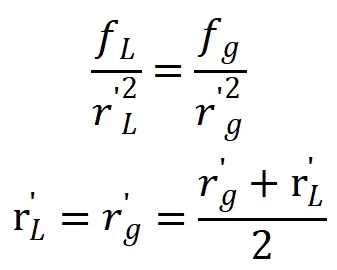
積分后公式為:
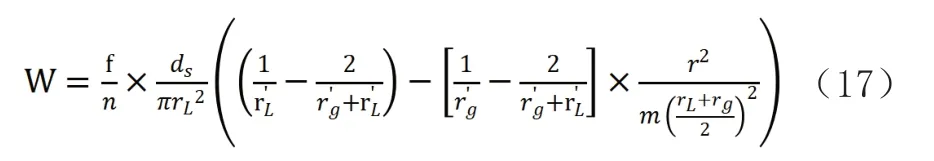
對公式進行單位換算,則得汽液相平衡時液相表面張力如下:

式中:γ—表面張力(μN/m);VL、Vg、VC—液體、氣體、臨界比容(m3/kg);M—分子量;n、m—修正系數。
(2)計算結果和討論
由不同物質表面張力的計算結果可知,查表結果和計算結果有一定誤差,但未超過數量級。
不同元素的表面張力誤差的計算結果見表3。結果表明計算不同元素表面張力的誤差不同,其中氖和氬元素的誤差最大,其他一般在5%~15%之間。不同元素的修正值不同,但多種元素的N值4.5~5,M值在0.5~0.61。不同元素M、N值的不同或計算和查表結果不能完全符合的原因可能和表面分子之間的結構有關。
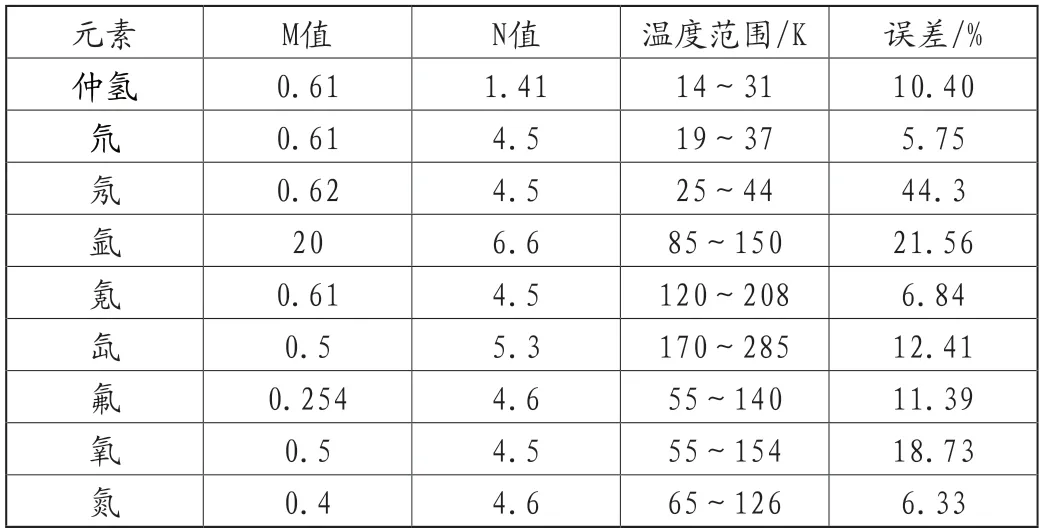
表3 其他元素表面張力計算的誤差
5.結論
(1)利用汽化熱計算和利用經典電磁理論計算得出的氦分子間引力基本一致,說明提出的方法適用于飽和態汽、液分子間引力的計算。(2)第一周期元素的分子間引力系數隨溫度上升而增加,其他周期元素的引力系數隨溫度上升有不同的變化但和平均值的偏差多數在1%以內,引力系數越大的元素,到臨界點附近引力系數有明顯下降。在同一周期中外層電子數飽和的惰性元素引力系數最小,其他元素的引力系數相近,但隨外層電子數增加依次有所增加;同一列中,從上到下外層電子數越多,引力系數越大。原子核內的中子數量對引力系數有影響,電子的自旋方向對引力系數的影響較小。(3)計算元素臨界點的單分子受到引力為10-13~10-11N,克分子引力位能為39~10000J;元素克分子引力位能和元素的臨界溫度線性相關,相關系數達到0.9987。元素臨界壓力與平均引力系數和臨界體積4/3次方倒數的乘積正相關,元素臨界溫度與平均引力系數和臨界體積的1/3次方倒數乘積正相關。利用推導出的公式可以計算出元素的臨界壓力和臨界溫度。(4)利用計算出的分子間力可通過推導出的公式計算出飽和液體的表面張力,部分元素的計算結果可滿足工程要求,部分元素計算出的結果和查表值誤差較大,原因可能在于不同元素汽、液的分子結構不同有關。(5)上文是分子間力定量化計算的一種有意義的方法,將會促進分子間引力研究的發展,為改善物質性能或生成新物質提供科學依據。

