箭葉淫羊藿多糖新組分EP80的結構表征及其對酒精代謝相關酶活力的影響研究
張夢園,楊曉華,段夢月,4,張華峰,3*
1陜西師范大學食品工程與營養科學學院 中俄食品與健康科學國際聯合研究中心西北瀕危藥材資源開發國家工程實驗室,西安 710119;2西安交通大學醫學部,西安 710061;3云南省普洱市院士專家工作站,普洱 665600;4安徽糧食工程職業學院,合肥 230012
中藥淫羊藿(Epimedii Folium)是小檗科(Berberidaceae)淫羊藿屬(Epimedium)藥用植物的干燥葉[1,2],含有多糖、黃酮類化合物、生物堿等活性成分[3,4],與肝臟健康密切相關[5,6]。據清代劉善述《草木便方》記載,淫羊藿“辛味甘溫”,可用于“補肝腎”。汪昂《本草備要》認為淫羊藿“辛香甘溫,入肝腎”,“補命門”。黃宮繡《本草求真》也認為淫羊藿“專入命門,兼入肝腎”。中國醫學科學院陜西分院中醫研究所[7]主編的《陜西中藥志》指出,淫羊藿“入肝、腎二經”,可以“補肝腎”。在臨床上,淫羊藿已被添加到“益肝解毒膠囊”等中成藥或院內制劑中,用于消除肝損傷病征[5]。近年來,酒精過度消耗(飲酒過量)對人體健康的影響特別是酒精性肝損傷日益得到全世界的關注[8]。酒精進入人體后在肝臟中分解代謝,先由乙醇脫氫酶(alcohol dehydrogenase,ALD)氧化成乙醛,再由乙醛脫氫酶(acetaldehyde dehydrogenase,ACD)氧化成乙酸,最終分解成二氧化碳和水[9]。如果酒精攝入過量或者酒精代謝相關酶活力較低,可能出現乙醛積累現象,干擾線粒體呼吸作用,生成蛋白質加合物(protein adducts),引起肝毒性[9]。從藥用植物中篩選具有解酒保肝作用的活性成分,解析其化學結構,成為中藥化學領域的重要研究課題。
植物多糖可能具有調節免疫、保肝、抗氧化等功能[10]。Deng等[11]采用酶提取法從桑葚(Fructus Mori)中分離制得了具有乙醇脫氫酶激活作用和自由基清除活性的粗多糖。Zhang等[12]采用乙醇分級分離(grading-alcohol precipitation)技術從方竹(Chimonobambusaquadrangularis)中分離制得了3種多糖組分:CPS70、CPS75和CPS80,其中CPS75具有較高的體外抗氧化作用和金屬螯合活性。Pan等[13]采用超聲波提取法制得了朝鮮淫羊藿(Epimediumkoreanum)總多糖,并利用小鼠模型考察了其對酒精性肝損傷的預防效果。本實驗室發現,心葉淫羊藿(Epimediumbrevicornu)總多糖能夠清除自由基,防止DNA氧化損傷[10]。乙醇分級分離技術能夠利用不同濃度的乙醇溶液將總多糖分成不同分子大小的多糖組分,從而獲得均一度更高、活性更強、性質更優的新組分[12,14]。然而,迄今未見采用乙醇分級分離技術從淫羊藿多糖中篩選具有酒精代謝相關酶(乙醇脫氫酶和乙醛脫氫酶)激活作用的新組分的研究報道。本研究以箭葉淫羊藿(Epimediumsagittatum)為植物材料,采用乙醇分級分離技術從淫羊藿中分離得到了多糖新組分EP80,運用傅里葉變換紅外光譜、圓二色譜、剛果紅實驗、掃描電子顯微鏡等方法表征了其化學結構,并研究了其抗氧化活性及對乙醇脫氫酶和乙醛脫氫酶的效應,以期為淫羊藿資源的科學開發和綜合利用提供參考。
1 材料與方法
1.1 材料、試劑與儀器
材料與試劑:淫羊藿于2020年7月15日采自秦嶺南麓,經西安交通大學楊曉華博士鑒定為箭葉淫羊藿(Epimediumsagittatum);1,1-二苯基-2-三硝基苯肼(DPPH,批號:101408373,純度≥98%,美國Sigma公司)、2,2’-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(ABTS,批號:C11838739,純度≥98%,上海麥克林生化科技有限公司);乙醇脫氫酶(批號:S10195,上海源葉公司);乙醛脫氫酶活性檢測試劑盒(批號:BC0750,北京索萊寶公司);薄層層析硅膠板(批號:1.05559.0001,西安晶博公司);半乳糖(Gal,批號:190090-201501,純度≥98%)、阿拉伯糖(Ara,批號:111506-200202,純度≥98%)、木糖(Xyl,批號:111508-201605,純度≥98%)、鼠李糖(Rha,批號:111683-201502,純度≥98%)、葡萄糖(Glu,批號:110833-201707,純度≥98%)標準品,以及碘化鉀、正丁醇等均為國產分析純試劑。
儀器設備:Chirascan型圓二色光譜儀(英國Applied Photophysics公司);Q1000DSC+LNCS+FACS Q600SDT型熱分析系統(美國TA公司);S-3400N型掃描電子顯微鏡(日本Hitachi公司);Multiskan Sky型全波長酶標儀(美國Thermo Electron公司);DV3TLVTJ0型粘度計(美國Brookfieldd公司);S1801544型紫外可見分光光度計(上海儀邁公司);Tensor 27型紅外光譜儀(德國Bruker公司);FDU-1200型冷凍干燥機(日本EYELA公司);5804R型高速冷凍離心機(德國Eppendorf公司);SPD-16型高效液相色譜儀(日本Shimadzu公司)。
1.2 實驗方法
1.2.1 糖組分制備方法
1.2.1.1 提取純化
參考Yang等[10]的水提醇沉方法,將淫羊藿葉干燥、粉碎、過篩,所得淫羊藿粉與蒸餾水按照1∶20(g/mL)固液比混勻后煮沸20 min,過濾后取上清液。將上清液減壓濃縮至原體積的1/3,收集濃縮液,加入4倍體積的無水乙醇,靜置12 h,離心后收集沉淀并回收乙醇。除去沉淀中的蛋白質并進行純化精制,Sephadex G-100葡聚糖凝膠柱層析的多糖溶液上樣濃度為5 mg/mL,收集單一洗脫峰流出液,使用冷凍干燥機將其冷凍干燥后制得淫羊藿總多糖[10,15,16]。
1.2.1.2 乙醇分級分離
參考Long等[14]的方法,將淫羊藿總多糖EP溶于蒸餾水中,加入無水乙醇至乙醇終濃度為40%(V/V),攪拌后靜置12 h,離心得到沉淀Ⅰ和上清液Ⅰ,沉淀Ⅰ凍干后得到多糖組分EP40。以此類推,制得多糖組分EP60和EP80(見圖1)。
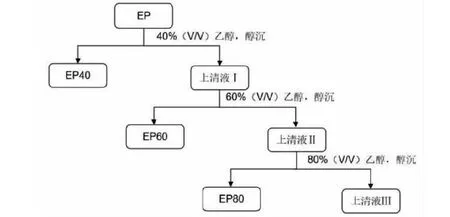
圖1 EP80的乙醇分級分離Fig.1 Grading-alcohol precipitation of EP80
1.2.2 多糖定性、定量方法
1.2.2.1 Molish實驗
參考Ye等[17]的方法,取淫羊藿多糖組分EP80溶液,加入α-萘酚乙醇溶液(質量分數5%),搖勻后緩慢加入濃硫酸。分別以蒸餾水和葡萄糖溶液作為陰性和陽性對照。
1.2.2.2 碘-碘化鉀實驗
參考Ye等[17]的方法,向EP80溶液中加入碘-碘化鉀溶液。分別以蒸餾水和淀粉溶液作為陰性和陽性對照。
1.2.2.3 Fehling實驗
參考Mayank等[18]的方法,向EP80樣液中加入Fehling試劑(現配現用),置60 ℃溫浴。分別以蒸餾水和葡萄糖溶液作為陰性和陽性對照。
1.2.2.4 多糖含量測定方法
采用本實驗室優化的苯酚硫酸法對EP80進行定量分析[19]。以單糖濃度(mg/mL)為橫坐標(x)、吸光度為縱坐標(y)繪制標準曲線,方程為:y= 0.034 9x+ 0.088 5,相關系數R2= 0.997 7,測得EP80多糖含量為81.3%。
1.2.3 單糖組成分析方法
采用柱前衍生化高效液相色譜法和薄層色譜法分析EP80的單糖組成[20]。
1.2.4 分子量測定方法
采用粘度計方法測定EP80的分子量[21]。使用ULA(0)型轉子,溫度為25 ℃,以各濃度下EP80的比濃粘度ηsp對其濃度作圖,使用Mark-Houwink方程計算分子量[21]。
1.2.5 熱重分析方法
在10 ℃/min的N2氣氛下測定EP80在0~800 ℃區間的質量變化,研究其熱穩定性[22]。
1.2.6 光譜分析方法
1.2.6.1 紫外光譜法
將淫羊藿多糖組分EP80溶于蒸餾水中,在190~500 nm波長范圍內進行掃描[23]。
1.2.6.2 傅里葉變換紅外光譜法
將EP80與溴化鉀按1∶100比例混合研磨,然后用壓片機壓片,在500~4 000 cm-1波數范圍內進行測定[21]。
1.2.6.3 圓二色譜法
將EP80溶于蒸餾水中,在190~400 nm波長范圍內測定圓二色譜數據[24]。
1.2.6.4 剛果紅實驗方法
將EP80溶液與相同體積的剛果紅溶液混合均勻,加入不同體積氫氧化鈉溶液(1 mol/L),使其終濃度分別為0、0.1、0.2、0.3、0.4、0.5、0.6 mol/L。在300~800 nm波長范圍內測定各氫氧化鈉濃度下液體的最大吸收波長[25]。
1.2.7 掃描電子顯微鏡法
首先剪取導電膠粘于金屬托盤上,然后蘸取EP80樣品粘于導電膠上,再用粉塵球吹走多余樣品,而后將托盤置于真空噴鍍儀內進行噴金處理,最后進行電鏡觀察[26]。
1.2.8 體外抗氧化實驗方法
1.2.8.1 DPPH分析
參考Cao等[27]的方法,配制DPPH的乙醇溶液,分別將1 mL的DPPH和2 mL的梯度濃度多糖組分溶液(0.005、0.010、0.020、0.010、0.060、0.080和0.100 mg/mL)混合均勻,37 ℃避光反應,之后在517 nm處測其吸光度。用等量蒸餾水取代多糖溶液作為空白組,用抗壞血酸(Vc)作為陽性對照組。以多糖組分質量濃度(mg/mL)、DPPH自由基清除率平均值分別為橫、縱坐標繪圖。清除率計算公式:
DPPH的清除率=
[1 - (As-Aa) /Ab] × 100%
式中,As:樣品或陽性對照吸光度;Ab:空白吸光度;Aa:對照吸光度。
1.2.8.2 ABTS分析
參考Medlej等[28]的方法,將ABTS溶液與過硫酸鉀溶液等體積混勻,避光反應12 h后,取混合液加入無水乙醇,制得ABTS工作液。分別將4.75 mL的ABTS工作液與0.25 mL的梯度濃度多糖組分溶液(0.100、0.200、0.400、0.600、0.800和1.000 mg/mL)混合,37 ℃避光反應后,于734 nm處測其吸光度。用等量蒸餾水取代多糖溶液作為空白組,用抗壞血酸作為陽性對照組。以多糖組分質量濃度(mg/mL)、ABTS自由基清除率平均值分別為橫、縱坐標繪圖。清除率計算公式:
ABTS的清除率 =
[1 - (As-Aa) /Ab] × 100%
式中,As:樣品/陽性對照吸光度;Ab:空白吸光度;Aa:對照吸光度。
1.2.9 酶學實驗方法
1.2.9.1 乙醇脫氫酶實驗
參考Madhusudhana等[29]的方法測定ALD活力,簡述如下:取焦磷酸鈉緩沖液1.5 mL(pH=8.8),加入乙醇溶液0.5 mL、氧化型輔酶Ⅰ(NAD+)溶液1.0 mL和EP80溶液0.1 mL,混勻后置25 ℃溫浴10 min。溫浴結束后立即加入乙醇脫氫酶溶液0.1 mL,搖勻后在340 nm下測定吸光度并計算酶活力和激活率。以蒸餾水為對照。
1.2.9.2 乙醛脫氫酶實驗
使用ACD活性檢測試劑盒測定酶活力和激活率。以蒸餾水為對照。
1.2.10 試驗設計和數據處理方法
每個實驗重復2~3次,取平均值。用Microsoft Office Excel 2016軟件對實驗數據進行錄入、計算,用圓二色光譜儀自帶軟件分析圓二色譜數據,用Origin 2018軟件繪圖,用熱分析系統自帶軟件進行熱重分析。
2 結果與分析
2.1 淫羊藿多糖組分EP80的理化性質
本研究從箭葉淫羊藿中分離出3種不同分子大小的多糖新組分:EP40、EP60和EP80(見圖1)。其中,EP80的抗氧化活性較強,對酒精代謝相關酶乙醇脫氫酶、乙醛脫氫酶的激活作用最好(參見后文),因此對其性質、結構和功能進行了進一步探究。
2.1.1 Moilsh實驗、碘-碘化鉀實驗與Fehling實驗分析
EP80樣品為棕褐色固體,凝膠過濾分析呈現單一峰形(見圖2),說明其為均一組分,純度符合要求[16]。Moilsh實驗中,EP80樣品產生了紫色圓環,證明其為糖類化合物。碘-碘化鉀實驗中,EP80樣品沒有呈現藍色,證明其中不含有淀粉。Fehling實驗中,EP80樣品沒有形成磚紅色沉淀,證明其為非還原糖。

圖2 EP80的Sephadex G-100凝膠層析洗脫曲線Fig.2 Elution curve of EP80 using Sephadex G-100 gel chromatography
2.1.2 單糖組成與分子量測定
采用柱前衍生化高效液相色譜法從EP80中鑒定出半乳糖、阿拉伯糖、葡萄糖和木糖4種單糖,薄層色譜分析也發現EP80圖譜中存在半乳糖、阿拉伯糖、葡萄糖和木糖斑點,這些說明EP80由半乳糖、阿拉伯糖、葡萄糖和木糖4種單糖組成。EP80的比濃粘度隨濃度變化趨勢如圖3所示,其分子量為3.2×104Da。
2.1.3 熱重分析
由圖4可見,在30~200 ℃范圍內,隨著溫度的增加,EP80樣品質量逐漸降低。多糖中通常含有羥基等親水基團,能夠吸附部分水分,當溫度增加時,水分會隨之蒸發,從而導致樣品質量降低。在247~353 ℃范圍內,隨著溫度的增加,樣品質量急劇下降,損失率可達50%以上。多糖分子在高溫下可能出現解聚或分解,生成小分子寡糖、單糖甚至二氧化碳等,氣體泄出后樣品質量減小。總體上看,EP80的熱失重區間主要集中在240~350 ℃范圍內,總失重率超過50%。
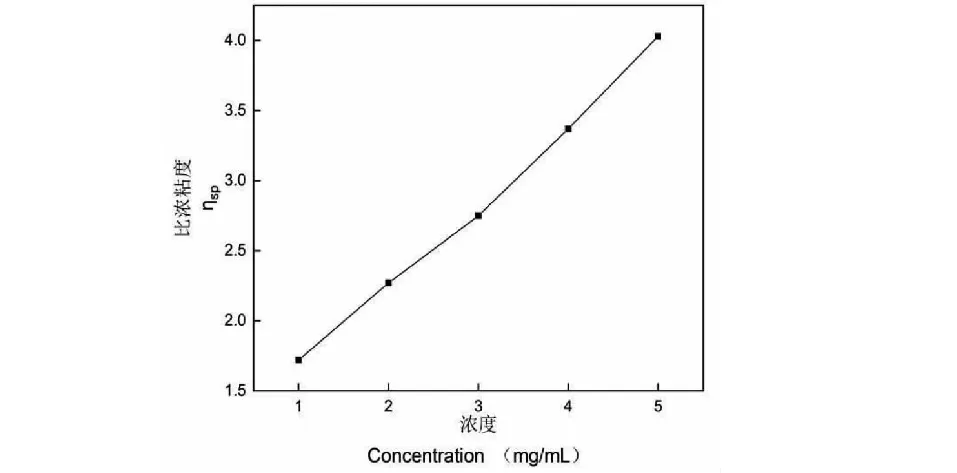
圖3 EP80的比濃粘度與濃度關系Fig.3 Relationship of EP80 between viscosity and concentration
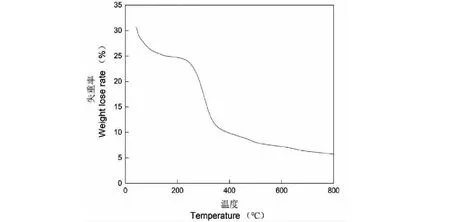
圖4 EP80的熱重分析Fig.4 Thermogravimetric analysis of EP80
2.2 淫羊藿多糖組分EP80的結構特征
2.2.1 紫外光譜
多糖組分EP80在190~500 nm波長范圍內的吸收光譜如圖5所示。可以看出,EP80樣品在260、280 nm處無明顯吸收峰,說明其中不含游離蛋白質和核酸雜質[10]。
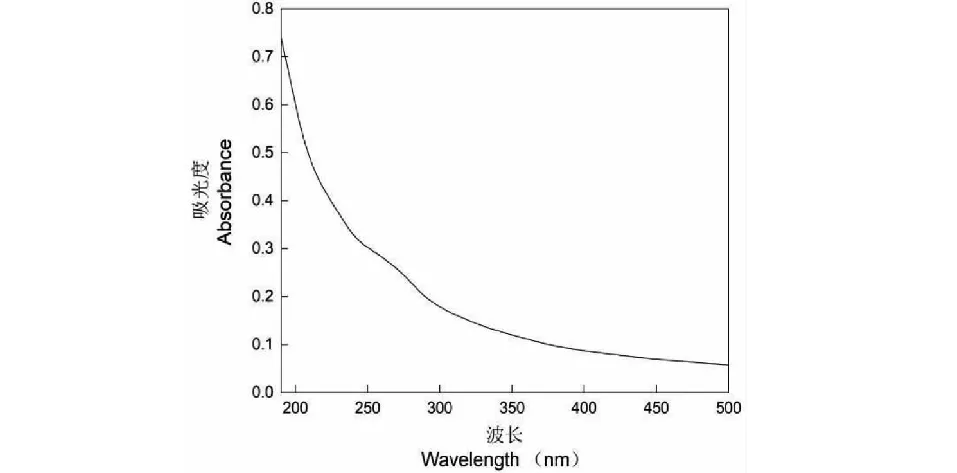
圖5 EP80的紫外光譜Fig.5 Ultraviolet spectrum of EP80
2.2.2 傅里葉變換紅外光譜
由EP80的紅外光譜可見,該樣品具有多糖的特征吸收峰(見圖6)。在波數3 442 cm-1附近有較寬的吸收峰,屬于多糖環上的O-H伸縮振動峰,提示樣品分子內和分子間含有氫鍵[30]。波數2 920 cm-1附近的吸收峰屬于C-H不對稱伸縮振動特征峰,而1 325 cm-1附近的吸收峰屬于糖類物質的C-H變角振動峰,提示樣品分子內含有甲基和亞甲基基團(見圖6)。波數1 145 cm-1附近的吸收峰較寬,屬于C-O-C不對稱伸縮振動峰,提示樣品分子中含有多糖類物質。波數1 593 cm-1附近的吸收峰屬于C=O收縮振動峰。波數1 050~1 145 cm-1范圍存在較弱的C-O-C以及C-H-O伸縮振動吸收峰,說明EP80樣品含有吡喃糖苷結構[31]。

圖6 EP80的傅里葉變換紅外光譜Fig.6 Fourier-transform infrared spectrum of EP80
2.2.3 圓二色譜
圓二色譜可以反映EP80的二級結構(見圖7)。可以看出,EP80在230 nm附近有一個較大的正吸收峰,存在正Cotton效應,而在260 nm附近有一個較大的負吸收峰,存在負Cotton效應,提示EP80存在不對稱結構,并且可能具有螺旋結構[32]。

圖7 EP80的圓二色譜Fig.7 Circular dichroism of EP80
2.2.4 掃描電鏡分析
由圖8可見,EP80的微觀形貌呈不規則片狀,

圖8 EP80樣品的掃描電鏡圖譜(×400和×1 000)Fig.8 Scanning electron micrographs of the same sample of EP80 (×400 and ×1 000)
有突出的褶皺結構,說明多糖分子間有一定的排斥力,吸引力較弱。此外,淫羊藿多糖的部分表面呈卷曲狀,表面較為粗糙并且存在一些細小的碎屑狀顆粒,提示樣品可能存在物理吸附現象。
2.2.5 剛果紅實驗分析
由圖9可見,剛果紅與EP80混合作用后,最大吸收波長發生了明顯的紅移,這可能是由于具有三股螺旋結構的多糖在堿性條件下發生螺旋卷曲所致[33]。剛果紅實驗結果進一步印證了圓二色譜實驗的部分結果,說明EP80具有三股螺旋結構。
2.3 淫羊藿多糖組分EP80的抗氧化活性
2.3.1 對DPPH自由基的清除能力
如圖10所示,EP80對DPPH自由基的清除率隨著其濃度的升高而增高,呈現出明顯的劑量依賴關系。當EP80濃度超過0.029 mg/mL時,對DPPH自由基的清除率可達50%以上(見表1),當EP80濃度超過0.060 mg/mL時,清除率高達80%以上(見圖10),提示EP80具有較好的DPPH自由基清除能力。

圖9 EP80與剛果紅反應體系的最大吸收波長Fig.9 Maximum absorption wavelength of complex of Congo-red reagent and EP80

圖10 EP80的DPPH自由基清除能力Fig.10 DPPH radical-scavenging capacity of EP80

表1 EP80與自由基清除率量效關系數學模型
2.3.2 對ABTS自由基的清除能力
如圖11所示,當EP80濃度在0~0.600 mg/mL范圍時,其對ABTS自由基的清除率隨著EP80濃度的增加而迅速升高,當濃度在0.600~1.000 mg/mL范圍時,清除率不再明顯增加。當EP80濃度超過0.235 mg/mL時,其對ABTS自由基的清除率可達50%以上(見表1),當濃度超過0.600 mg/mL時,其清除率高達90%以上(見圖11),提示EP80對ABTS自由基具有一定的清除能力。

圖11 EP80的ABTS自由基清除能力Fig.11 ABTS radical-scavenging capacity of EP80
2.4 淫羊藿多糖組分EP80對酒精代謝相關酶活力的影響
2.4.1 乙醇脫氫酶
淫羊藿多糖組分EP80對ALD的激活率隨著多糖組分濃度的增大而增加,呈現出明顯的劑量依賴關系(見圖12)。EP80濃度與乙醇脫氫酶活性激活率之間量效關系擬合方程的相關系數為0.9576(見表2),說明該方程擬合度較好。EP80的半有效濃度(EC50)為3.75 mg/mL,提示其濃度大于3.75 mg/mL時,ALD的激活率可達50%以上。EP80的EC50低于EP40(6.21 mg/mL)和EP60(7.16 mg/mL)(P<0.05),說明EP80對ALD的激活作用強于EP40和EP60。

圖12 EP80對乙醇脫氫酶激活率的影響Fig.12 Effect of EP80 on activation rate of alcohol dehydrogenase
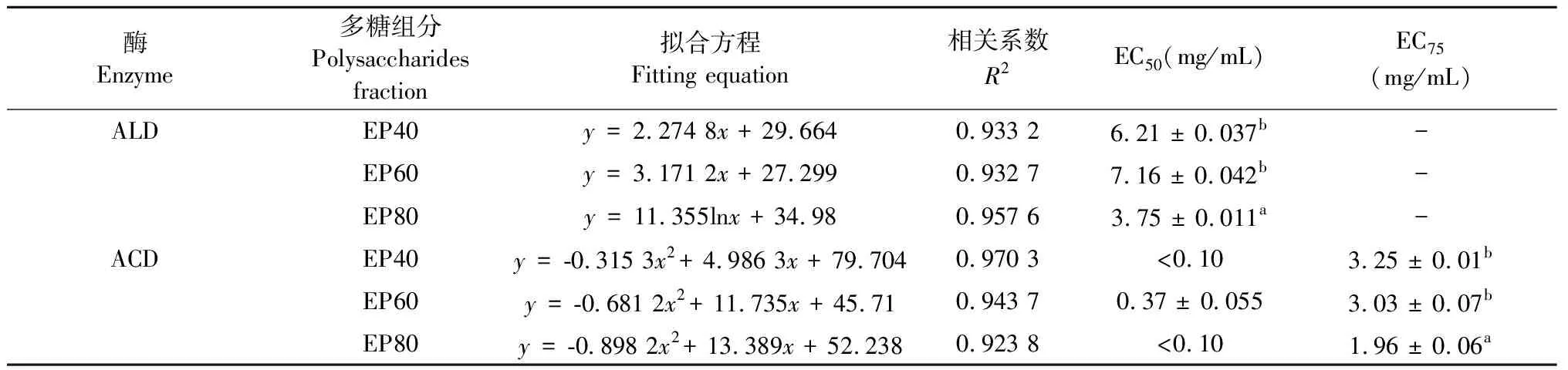
表2 EP80濃度與酒精代謝相關酶激活率之間的量效關系
2.4.2 乙醛脫氫酶
由圖13可見,隨著淫羊藿多糖組分EP80濃度的增大,ACD激活率逐漸增加,顯示出明顯的劑量依賴性。由表2可知,當EP80濃度超過6.48 mg/mL時,ACD的激活率接近100%。EP80對ACD的激活作用強于EP40和EP60。ALD和ACD是酒精進入人體后分解代謝的重要酶,EP80對ALD和ACD均表現出較好的激活作用,提示其在解酒保肝中具有一定的潛在應用價值。
由表2還可看出,EP80對ACD激活作用的EC50明顯低于其對ALD的EC50(P<0.01),提示其對ACD的激活作用強于ALD。在酒精分解代謝過程中,ALD將酒精氧化成乙醛,ACD將乙醛進一步氧化成乙酸。乙酸安全性較高,而乙醛在人體積累可能導致染色體損壞、干細胞突變或肝損傷等[34]。一般認為,ACD在減除酒精毒害中發揮的作用強于ALD[9,35]。本研究發現,EP80對酒精代謝相關酶具有激活作用,特別是其對ACD的激活作用更強,這樣有助于減輕酒精代謝產生的乙醛對人體的傷害。
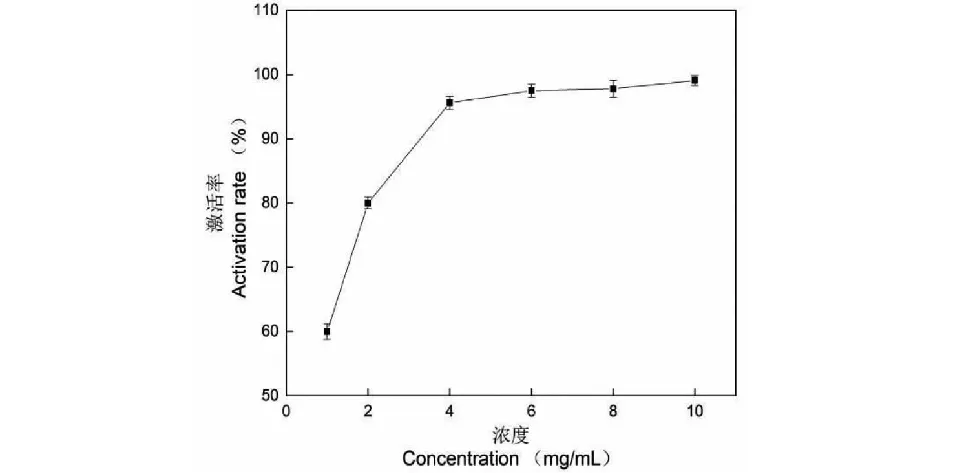
圖13 EP80對乙醛脫氫酶激活率的影響Fig.13 Effect of EP80 on activation rate of acetaldehyde dehydrogenase
3 結論
本研究從藥用植物箭葉淫羊藿中分離制備了多糖新組分EP80,采用紫外光譜、傅里葉變換紅外光譜、圓二色譜、剛果紅實驗、掃描電鏡、熱重分析等方法對EP80進行了結構表征,并考察了其體外抗氧化能力以及對酒精代謝相關酶乙醇脫氫酶和乙醛脫氫酶活力的影響。結果表明,EP80由半乳糖、阿拉伯糖、葡萄糖和木糖4種單糖組成,分子量為3.2×104Da,具有吡喃糖苷骨架,含有三股螺旋結構,在230 nm附近有正Cotton效應,在260 nm附近有負Cotton效應,微觀形貌呈不規則片狀,有突出的褶皺結構,熱失重區間主要集中在240~350 ℃。EP80具有一定的抗氧化活性,對乙醇脫氫酶和乙醛脫氫酶具有明顯的激活作用,對乙醛脫氫酶的激活作用強于乙醇脫氫酶,值得進一步研究。本研究為淫羊藿多糖的開發利用提供了參考。

