IL-17A、IL-6、IFN-γ在卵巢癌的表達情況及相關性研究*
殷美琴,王永霞△,秦智娟,李美琴,馬宗麗,沈曉健,薛衛紅,沙紅蘭
(如皋市人民醫院:1.婦產科;2.病理科,江蘇南通 226500)
卵巢癌對女性健康的威脅日趨嚴重,病死率是婦科腫瘤之首[1-2]。這與現今依然缺乏早期篩查手段及有效的治療措施密切相關。研究已經發現卵巢癌的生存率與腫瘤分期密切相關,分期越高,生存率越低[3]。因此,卵巢癌的早期診斷尤為重要。
炎癥在腫瘤中的作用被廣泛關注[4]。白細胞介素(IL)-17A是一種重要的炎癥介質[5],一方面可以誘導IL-6、粒細胞集落刺激因子(G-CSF)等表達,另一方面又能同腫瘤壞死因子-α(TNF-α)等協同作用,放大其致炎效應。但目前只發現IL-17A在炎性反應、自身免疫性疾病、部分腫瘤中發揮重要作用,與卵巢癌相關的研究較少。IL-6則是機體免疫應答和炎性反應的雙重調節因子,參與多種腫瘤的發生、發展。干擾素(IFN)具有廣泛的生物學功能,可以調節機體免疫、參與抗腫瘤等,IFN-γ能夠抑制腫瘤血管生成和腫瘤生長。目前關于細胞因子和卵巢癌的研究集中在對卵巢癌患者血清相關因子的測定,對卵巢癌組織中細胞因子表達水平的研究較少,且尚未發現IL-17A、IL-6、IFN-γ三者在卵巢癌中關系的研究。因此,本研究采用免疫組織化學分析檢測對照組織、卵巢良性上皮性腫瘤、卵巢癌組織中IL-17A、IL-6、IFN-γ蛋白的表達情況,通過ELISA檢測血清IL-17A、IL-6、IFN-γ蛋白的表達水平,最后分析IL-17A、IL-6、IFN-γ蛋白三者間的相關性,以期為卵巢癌的早期診斷及抗卵巢癌的藥物靶點提供新思路,現報道如下。
1 資料與方法
1.1 一般資料
選取2017年5月至2020年5月如皋市人民醫院就診的50例患者為研究對象,其中30例上皮性卵巢癌患者作為卵巢癌組,20例卵巢上皮性良性腫瘤患者作為良性腫瘤組,另選取同期因子宮肌瘤行全子宮+附件切除術且卵巢正常的20例患者作為對照組。卵巢癌患者納入標準:(1)30~70歲;(2)所有病例均符合卵巢癌病理分類標準和2014年國際婦產科聯盟(FIGO)分期標準診斷標準;(3)手術均按2015年美國國立綜合癌癥網絡(NCCN)卵巢癌指南規范的卵巢癌分期手術或卵巢癌減瘤術;(4)手術前均未行化療、放療及免疫治療。卵巢癌患者排除標準:(1)腫瘤非卵巢原發;(2)正在服用免疫抑制劑、免疫調節劑及糖皮質激素者;(3)存在惡性腫瘤、自身免疫性疾病等其他疾病者。本研究經醫院醫學倫理委員會批準,所有患者均簽署知情同意書。
1.2 方法
1.2.1主要試劑
DAB顯色試劑盒(AR1002)、聚合辣根過氧化物酶(HRP)標記抗小鼠IgG(SV0001)、聚合HRP標記抗兔IgG(SV0002)購自武漢博士德生物工程有限公司;抗IL-17A抗體(ab79056)、抗IL-6抗體(ab9324)、抗IFN-γ抗體(IFNG/466,ab218426)、人IL-17A ELISA Kit (ab216167)、人IL-6 ELISA Kit (ab178013)、人IFN-γ ELISA Kit (ab46025)購自英國Abcam公司。
1.2.2石蠟切片
將組織常規方法制作石蠟切片,切片厚度4 μm。
1.2.3蘇木素-伊紅(HE)染色
常規程序脫蠟染色,其中蘇木素液染色約10 min,水洗藍化20 min,伊紅液染1 s。
1.2.4免疫組織化學染色
切片脫蠟至水。過氧化氫(H2O2)孵育10 min,ddH2O洗滌5 min。枸櫞酸鹽抗原微波爐熱修復。磷酸鹽緩沖液(PBS)洗凈5 min。5%BSA室溫孵育20 min。滴加一抗(IL-17A抗體1∶200稀釋,IL-6抗體1∶1 000稀釋,IFN-γ抗體1∶500稀釋),4 ℃孵育過夜。PBS洗3次,每次3 min,二抗37 ℃孵育30 min。PBS洗3次,每次3 min,DAB顯色液。避光顯色,蒸餾水終止顯色。蘇木素染色10 min。純水藍化20 min。50%、70%、80%、95%和無水乙醇梯度脫水,每道2 min。二甲苯透明,中性樹脂封片,晾干,拍照。
1.2.5結果判斷
切片于低倍鏡下觀察,選擇卵巢癌較密處就進一步觀察。高倍鏡下,觀察5個視野,陽性表達為細胞質呈棕黃色。用Image.pro plus 6.0處理圖片,獲得吸光度(A)值。
1.2.6ELISA檢測血清IL-17A、IL-6、IFN-γ水平
每孔加入50 μL標準品和樣品,再加50 μL抗體Cocktail,室溫孵育2 h。洗滌10 s×3次。加入100 μL TMB Development Solution避光孵育10 min。加入100 μL Stop Solution,1 min后在A450 nm處讀數。
1.3 統計學處理
2 結 果
2.1 不同卵巢組織的形態觀察
對照組卵巢組織無明顯異常,良性腫瘤組卵巢有部分炎性細胞浸潤,卵巢癌組腫瘤細胞大小不均,形態各異,且排列雜亂無序,癌細胞核大且多呈卵圓形,核仁較為明顯,核分裂相較多,可見少量核固縮,細胞分化程度偏低,見圖1。
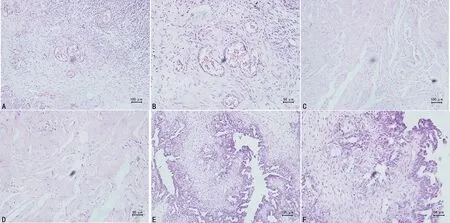
A、B:對照組;C、D:良性腫瘤組;E、F:卵巢癌組。
2.2 IL-17A在不同卵巢組織表達情況
IL-17A在對照組呈弱陽性,表達強度為0.147±0.025;在良性腫瘤組亦呈弱陽性,表達強度為0.159±0.028;在卵巢癌組呈強陽性,表達強度為0.386±0.024,3組比較差異有統計學意義(P<0.05),見圖2。
2.3 ELISA檢測血清IL-17A表達水平
對照組血清IL-17A表達水平為(31.99±5.69)pg/mL,良性腫瘤組為(33.99±7.12)pg/mL,卵巢癌組為(63.72±8.28)pg/mL,3組比較差異有統計學意義(P<0.05),見圖3。

a:P<0.05,與對照組比較;b:P<0.05,與良性腫瘤組比較。
2.4 IL-6在不同卵巢組織中的表達情況
IL-6在對照組呈弱陽性,表達強度為0.148±0.033;在良性腫瘤組呈中等陽性,表達強度為0.257±0.026;在卵巢癌組呈強陽性,表達強度為0.410±0.033,3組比較差異有統計學意義(P<0.05),見圖4。
2.5 ELISA檢測血清IL-6表達水平
對照組血清IL-6表達水平為(27.08±8.54)pg/mL,良性腫瘤組為(55.53±9.22)pg/mL,卵巢癌組為(153.45±17.5)pg/mL,3組比較差異有統計學意義(P<0.05),見圖5。
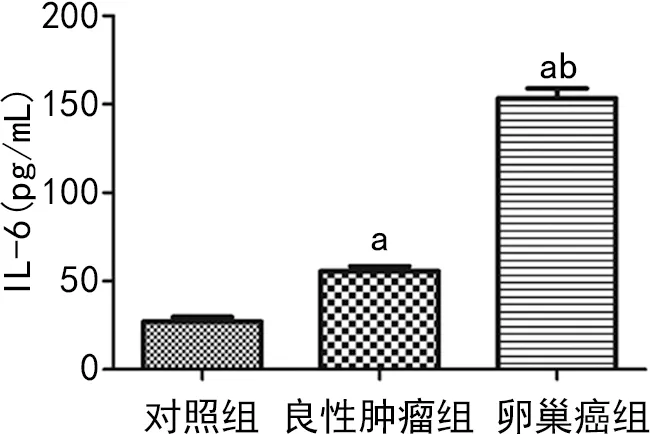
a:P<0.05,與對照組比較;b:P<0.05,與良性腫瘤組比較。
2.6 IFN-γ在不同卵巢組織中的表達情況
IFN-γ在對照組呈強陽性,表達強度為0.398±0.025;在良性腫瘤組亦呈強陽性,但弱于對照組,表達強度為0.301±0.035;在卵巢癌組呈弱陽性,表達強度為0.144±0.036,3組比較差異有統計學意義(P<0.05),見圖6。
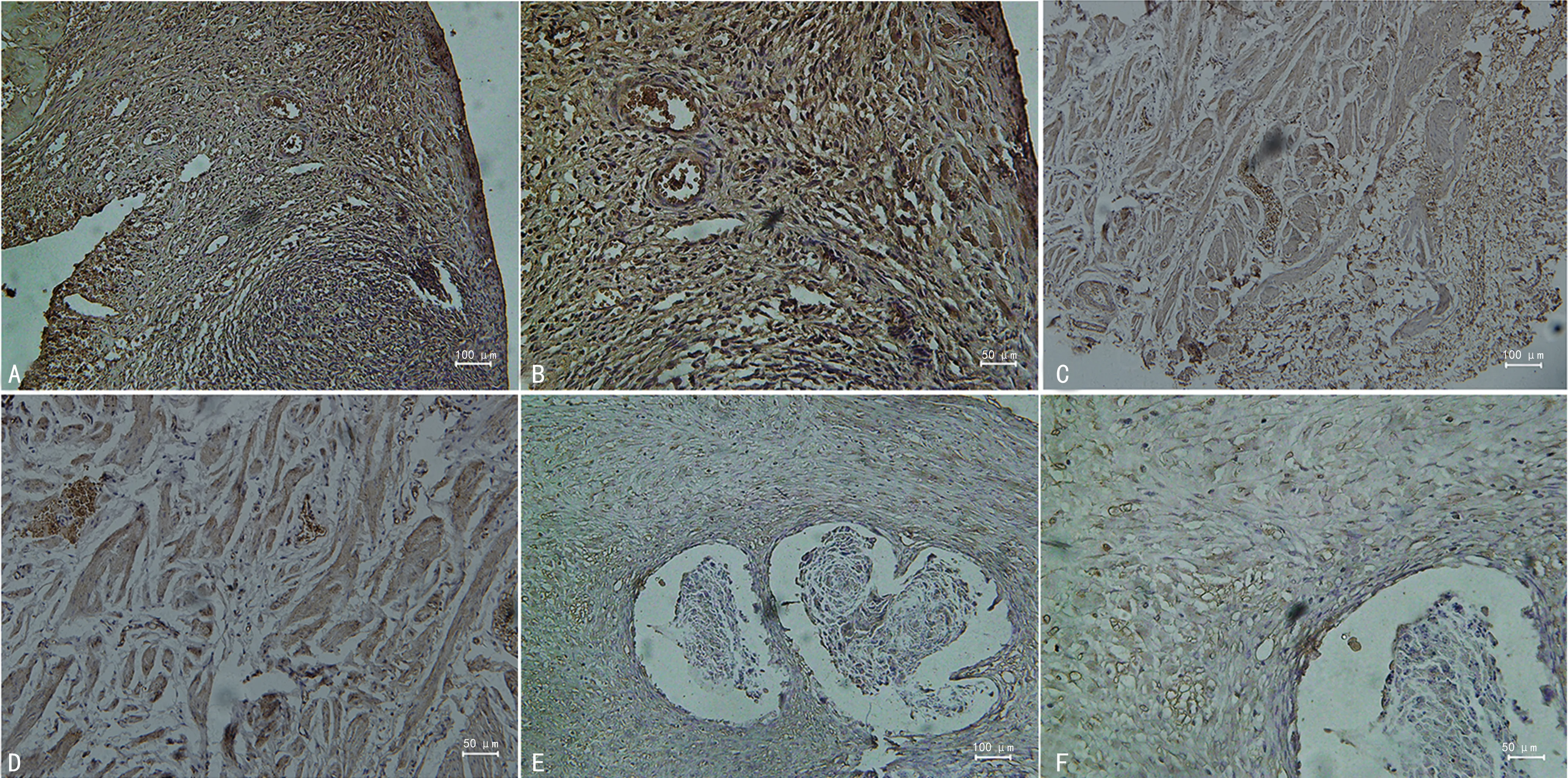
A、B:對照組;C、D:良性腫瘤組;E、F:卵巢癌組。
2.7 ELISA檢測血清IFN-γ的表達水平
對照組血清IFN-γ的表達水平為(142.97±20.79)pg/mL,良性腫瘤組為(111.89±17.40)pg/mL,卵巢癌組為(78.47±16.03)pg/mL,3組比較差異有統計學意義(P<0.05),見圖7。

a:P<0.05,與對照組比較;b:P<0.05,與良性腫瘤組比較。
2.8 IL-17A、IL-6、IFN-γ的相關性分析
IL-17A和IL-6呈強正相關關系(r=0.991 8),IL-17A和IFN-γ呈強負相關關系(r=-0.977 4)。
3 討 論
現今,卵巢癌的早期診斷和治療效果還不盡人意,雖然手術方式有所改進且化療藥物不斷更新,但晚期卵巢癌患者的5年生存率并無明顯提高。同時,卵巢癌的發生、發展機制仍不甚清楚,還需深入研究影響卵巢癌增殖、侵襲、轉移和分化的相關因素及分子機制,為臨床的早期診斷和治療提供新的思路。
許多上皮性腫瘤均有一個重要標志,即潛在的慢性感染伴隨持續的固有免疫細胞活化,該過程的發生常常早于疾病的發生并參與腫瘤的發生、發展[6]。而固有免疫細胞則是引起感染及炎癥相關性腫瘤基質中的重要組分。而當前慢性持續性的炎癥已成為惡性腫瘤新的熱門標記性特征。因此,研究卵巢癌患者腫瘤微環境中的免疫和炎性反應是了解卵巢癌發生、發展的關鍵所在。
IL-17A是由CD4+T細胞中的輔助型T細胞(Th)17細胞亞群分泌的一種細胞因子,可以誘導某些細胞中TNF-α、IL-1、IL-6等促炎因子的表達,進而參與炎性反應、抗感染反應等。IL-17A的表達水平也被一系列因素調節,如被抗原呈遞細胞分泌的IL-6和IL-1調節。另外,IFN-γ在IL-17A的調節中也起到重要作用,DMBA/TPA通過誘導IFN-γ的表達刺激IL-17A的分泌從而促進乳頭瘤的進展。但在IFN-/-的小鼠中,B16黑色素瘤的生長較野生型小鼠明顯增強,且IL-17A有更高的表達。由此推斷IFN-γ可能在不同腫瘤類型中對IL-17A的表達起不同調節作用。現有研究表明IL-17A在多種腫瘤中表達升高,如乳腺癌[7]、膽囊癌[8]、非小細胞肺癌[9]等,且促進癌細胞的增殖、遷移和侵襲。在本研究中,IL-17A在對照組、良性腫瘤組表達水平較低,且兩組間無差異;而在卵巢癌組表達水平升高,這與IL-17A在多種腫瘤中的表達趨勢一致。
IL-6來源廣泛,單核巨噬細胞、活化的T細胞、B細胞等都可以產生IL-6。IL-6是機體免疫應答和炎性反應的重要調節因子,其在機體內的生物學作用與其表達水平間具有兩面性。當IL-6處于低水平時,有利于機體的免疫調節;而當其處于高水平時,就會嚴重影響細胞因子間正常的協同作用,從而引起細胞因子功能紊亂,進而引發各種疾病。IL-6的過度產生在多種癌癥細胞中普遍存在,同時在癌癥患者中伴隨著血清IL-6水平的明顯上升。近些年國際國內研究表明,IL-6介導的信號通路與乳腺癌[10]、肝癌[11]、胃癌[12]等常見腫瘤的發生、發展均密切相關,且參與腫瘤的侵襲、轉移、預后及復發[13]。此外,IL-6還可增加卵巢癌細胞的黏附性、趨化性和化學促進性及總的侵襲力[14]。本研究3組IL-6在卵巢組織和血清均有所表達,且隨惡性程度加重呈遞增趨勢。這與IL-6處于低水平時,有利于機體的免疫調節,而在腫瘤中常常過度表達一致。
IFN-γ是多功能細胞因子,參與抗感染、抗腫瘤等多種生物學事件。IFN-γ一方面可以增強自然殺傷(NK)細胞和T細胞的活性,從而促進Th1型細胞因子的分泌,這有利于激活抗腫瘤免疫途徑;另一方面高濃度IFN-γ或持續性低劑量的IFN-γ又有利于形成腫瘤細胞免疫逃逸微環境,說明IFN-γ對腫瘤的調控存在多面性。現研究一般認為當Th1功能較強時,機體的細胞免疫可有效抑制腫瘤細胞的活力[15],反之亦然。本研究中,IFN-γ在對照組呈強陽性,在良性腫瘤組亦呈強陽性,但弱于對照組,而在卵巢癌組呈弱陽性,說明在卵巢癌中Th1功能較弱,腫瘤細胞活力較強。
綜上所述,IL-17A、IL-6和IFN-γ參與了卵巢癌的發生,且三者間有一定的關聯,有成為卵巢癌早期檢測和分子靶向的可能,但三者間具體的作用機制,以及如何促進卵巢癌的發生還有待深入研究。

