基于單細胞RNA測序的胃癌淋巴轉移的細胞學特征及分子機制研究*
鄒媛遠,黃 洋,周連幫
(安徽醫科大學第二附屬醫院普外科,合肥 230601)
胃腺癌是一種起源于胃黏膜的惡性腫瘤,其最常見的轉移方式是淋巴結轉移,淋巴結轉移與胃腺癌患者的治療反應、局部復發和長期生存直接相關,不僅能夠評價患者的預后,而且對于治療模式的選擇也是至關重要的[1]。單細胞RNA測序是一種在單細胞水平上對整個轉錄組進行擴增和測序的新技術。一些基于單細胞測序對胃癌的研究已經發表,但較少涉及與淋巴轉移相關細胞學的研究[2-4]。本研究收集淋巴結轉移陽性及陰性的胃腺癌組織及癌旁組織標本,采用單細胞測序技術進行分析,利用實時定量PCR(real time quantitative PCR,RT-qPCR)技術對相關分子表達水平進行驗證,旨在發現與胃癌淋巴轉移有關的細胞學特征及分子改變,為胃癌的臨床診斷和治療提供了新的見解,現報道如下。
1 材料與方法
1.1 材料
選取2019年9-12月本院接受胃切除手術的13例胃腺癌患者術中切除的腫瘤組織及癌旁組織,標本經病理檢查確診。患者術前未進行過放化療,且對本研究均知情同意。單細胞RNA文庫試劑盒均由南京新格元生物有限公司提供;SYBR?Green PCR(PowerTrackTMSYBR Green Master Mix)試劑盒、Trizol試劑購自美國Thermo Scientific有限公司。
1.2 方法
1.2.1分組
單細胞RNA測序:胃癌組織及癌旁組織根據淋巴結轉移情況,分為4種類型,即N1、T1(無淋巴結轉移的癌旁及腫瘤組織),N2、T2(有淋巴結轉移的癌旁及腫瘤組織)。RT-qPCR:胃癌標本13例依據術后病理結果分為淋巴結轉移陽性組及淋巴結轉移陰性組。
1.2.2單細胞RNA測序
按照試劑盒說明進行單細胞分離。利用Seurat程序進行細胞類型鑒定和聚類分析,將FindClusters函數的參數分辨率設置為0.6用于集群分析。使用功能FindMarkers對不同標本或連續聚類之間的差異表達基因進行鑒定。
1.2.3RT-qPCR檢測XIST和CXCL5表達水平
提取胃癌組織按照試劑盒說明進行PCR,相對表達水平用2-ΔΔCt法計算。以GAPDH為內參,XIST上游引物5′-TGG ATA GAG GAC CCA AGC GA-3′,下游引物5′-CAA GAC TGG CCC AGG CAT AA-3′;CXCL5上游引物5′-CAA GTT CCC TCC CCA CTC AC-3′,下游引物5′-TGC TAA AAA CCC GAC AGG CA-3′;內參GAPDH上游引物5′-CAA CGA ATT TGG CTA CAG CA-3′,下游引物5′-AGG GGT CTA CAT GGC AAC TG-3′。
1.3 統計學處理
2 結 果
2.1 胃腺癌中單細胞轉錄組圖譜和不同細胞類型
分別從淋巴結轉移陰性和陽性組的胃腺癌組織中獲得1 461和2 951個單細胞轉錄本進行分析,共鑒定出10種主要細胞類型。與淋巴轉移陰性組比較,淋巴轉移陽性組的主細胞占比明顯升高,見圖1。
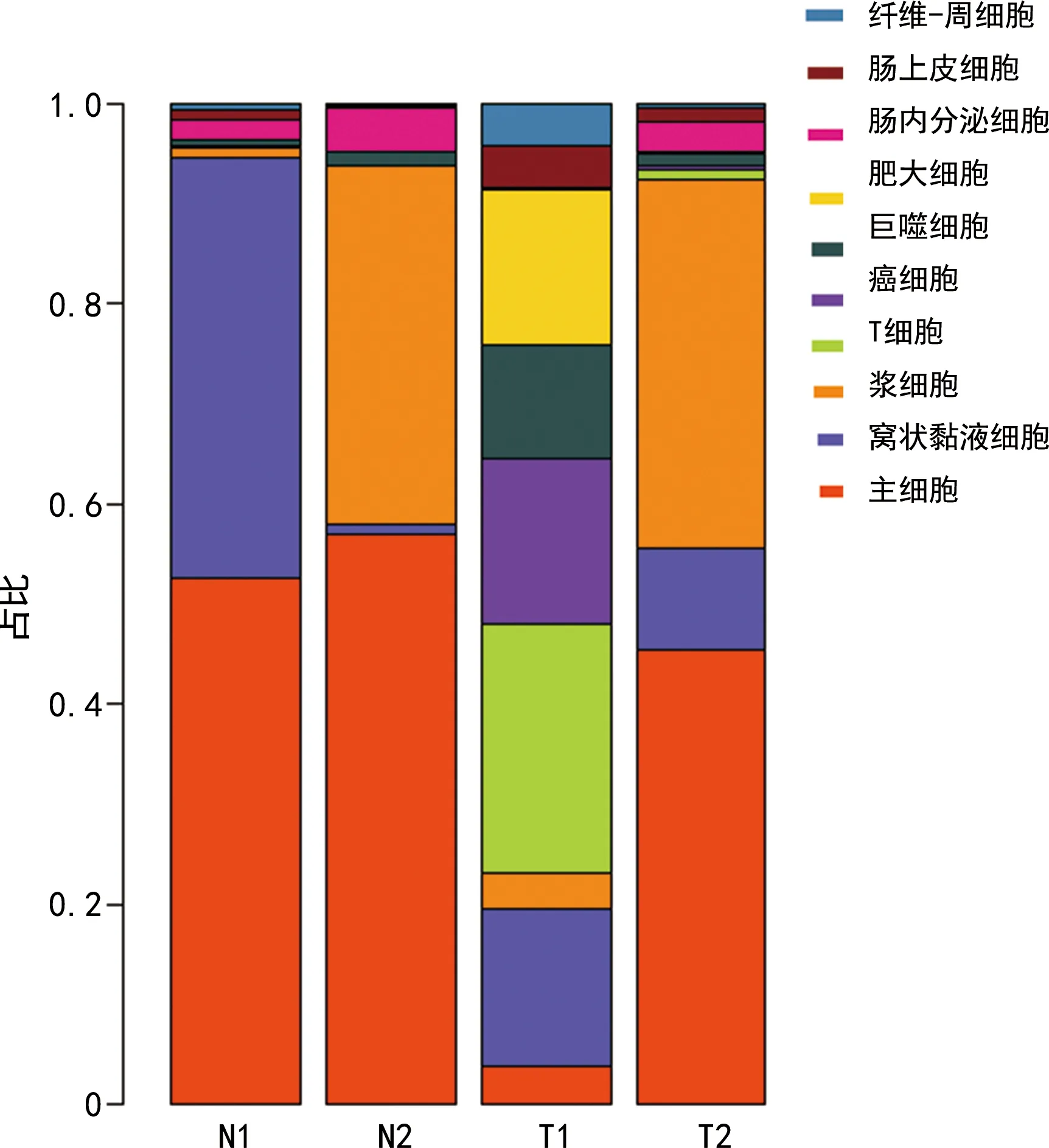
圖1 胃腺癌中不同細胞類型占比
2.2 與胃癌轉移相關的一種主細胞亞型
根據主細胞的轉錄譜自動聚類,主細胞亞聚類顯示4簇,分別為主細胞1、主細胞2、主細胞3和主細胞4。采用擬時序分析法進行了轉錄軌跡分析,發現存在主細胞2、主細胞3、主細胞1向癌細胞的轉錄過渡狀態。主細胞3在淋巴轉移陽性患者的胃癌組織標本中明顯富集,見圖2。
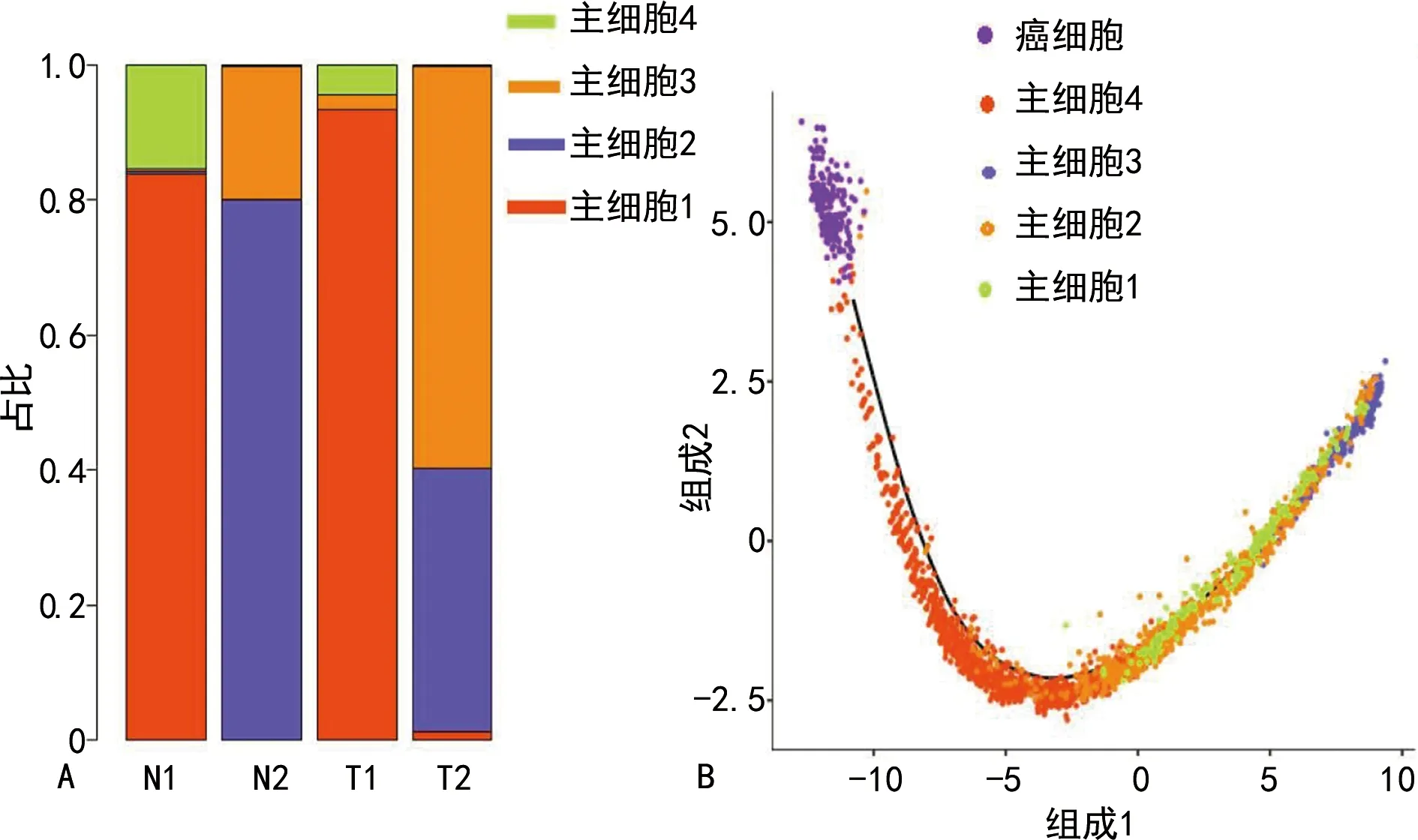
A:主細胞亞聚類的比例;B:從主細胞到癌細胞的轉化過程。
2.3 與胃癌轉移相關的一種窩狀黏液細胞亞型
窩狀黏液細胞亞聚類為3簇,窩狀黏液細胞1和窩狀黏液細胞2主要存在于淋巴結轉移陰性組的標本中,與腫瘤組織(T1)比較,在正常組織(N1)中含量略有增加。窩狀黏液細胞3主要富集于淋巴結轉移陽性組的標本中。使用受體-配體相互作用實現了細胞通信網絡。在這個網絡中,窩狀黏液細胞3與癌細胞之間的相互作用最為明顯。窩狀黏液細胞3標記基因CXCL5在窩狀黏液細胞3中特異性表達,見圖3。
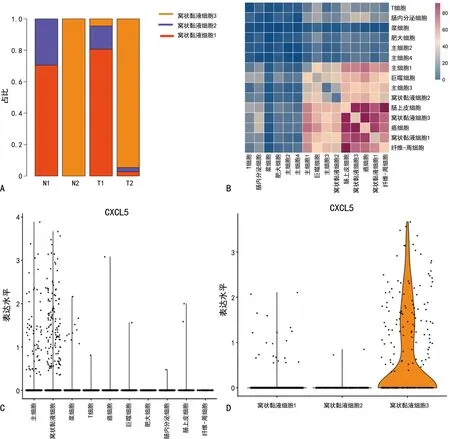
A:不同亞簇的窩狀黏液細胞在標本中的比例;B:細胞通信網絡;C:CXCL5在不同細胞類型中的表達情況;D:CXCL5在3個窩狀黏液細胞亞簇中的表達情況。
2.4 淋巴結轉移陽/陰性組胃癌組織XIST、CXCL5表達水平比較
RT-qPCR檢測結果顯示,淋巴結轉移陽性組的胃癌組織中XIST、CXCL5表達水平均高于淋巴結轉移陰性組(P<0.05),見表1。
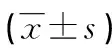
表1 淋巴結轉移陽/陰性組胃癌組織XIST、CXCL5表達水平比較
3 討 論
淋巴結轉移是胃癌根治術后復發的最重要危險因素之一,淋巴結清掃已被證明可以提高胃癌的生存率[5]。單細胞RNA測序可以更好地揭示細胞之間的異質性,識別不同的細胞亞群,剖析細胞分化過程和細胞作用關系,目前,單細胞RNA測序在胃癌淋巴結轉移中的研究鮮有報道。因此,將單細胞RNA測序技術應用于胃癌淋巴結轉移探尋有關的細胞學特征和相關分子標志物等十分有必要。
本研究中發現了一種新的主細胞亞聚類——主細胞3,可能是胃腺癌轉移的潛在標志。上皮化生是胃癌發生、發展的一個重要過程,主細胞的異常分化被認為是導致上皮化生的主要原因[6-7]。解痙多肽表達化生(spasmolytic polypeptide expressing metaplasia,SPEM)作為胃癌癌前病變,有報道稱,發生化生時,主細胞會直接轉化為SPEM細胞,而當化生消退時,SPEM細胞則會重新分化為主細胞[8]。本研究通過擬時序分析發現了在假的時間軸上,存在主細胞2、主細胞3、主細胞1向癌細胞的轉化。本研究發現,主細胞2與正常主細胞標記基因類似,均高表達LIPF,而主細胞1和SPEM細胞相似,均高表達MUC6、SOX9[3]。作為正常的主細胞和SPEM細胞之間的中間狀態,主細胞3僅在淋巴轉移陽性患者的標本中明顯富集,提示主細胞3可能是主細胞的一種新亞型,可以作為轉移的標志。有了這個實驗基礎,繼續對主細胞3的差異富集基因XIST進行RT-qPCR實驗。XIST基因是哺乳動物中X基因失活的主調控因子,據報道,XIST在多種惡性腫瘤中過表達,并與更具有侵襲性的表型相關[9]。越來越多的研究表明,XIST異常上調與多種實體腫瘤的晚期腫瘤分期、分化差和生存期縮短直接相關[10]。整理文獻發現,對XIST在胃癌淋巴結轉移的研究鮮有報道。本課題組對XIST進行RT-qPCR,發現XIST在淋巴結轉移陽性組的胃癌組織中表達水平更高,提示XIST過表達能夠促進胃癌腫瘤細胞的淋巴結轉移,從而提高腫瘤的惡性程度。
本研究發現窩狀黏液細胞3主要存在于淋巴結轉移陽性組的標本中,且在胃癌組織中明顯富集,通過細胞互作分析發現其與癌細胞相互作用強烈。同時GO分析顯示窩狀黏液細胞3差異基因富集的信號通路很多與細胞分離、細胞遷移相關,如細胞骨架蛋白綁定、有絲分裂細胞周期、細胞分裂等[11-12]。對其差異基因進行分析,發現CXCL5為其標記基因。CXCL5是實體瘤中腫瘤微環境中重要的趨化因子之一,研究發現其來源可能與腫瘤微環境中的腫瘤自分泌和旁分泌有關[13]。根據以往的研究,與相應癌旁組織及正常組織比較,CXCL5在鼻咽癌、胃癌、結直腸癌等癌組織中表達水平明顯升高[14-16]。本課題組對CXCL5進行RT-qPCR實驗,發現CXCL5在淋巴結轉移陽性組的胃癌組織中表達水平更高,提示CXCL5過表達能對胃癌腫瘤細胞的淋巴結轉移有促進作用。
綜上所述,本研究將單細胞RNA測序應用于胃癌淋巴轉移,確定了兩種可能對淋巴轉移有促進作用的細胞類型——主細胞3和窩狀黏液細胞3,并對這兩種細胞類型進行差異基因鑒定,發現其標記基因XIST、CXCL5在淋巴結轉移陽性患者的胃癌組織中明顯高表達,提示主細胞3、窩狀黏液細胞3及其標記基因XIST、CXCL5有望成為預測胃癌淋巴轉移和治療的分子生物標志物。

