oprC蛋白多克隆抗體制備及其免疫效果研究
陳 曦, 安 娜, 張 彬, 吳泳樺, 鄧 薔, 胡 冬
(四川省綿陽市中心醫院檢驗科, 四川 綿陽 621000)
鮑曼不動桿菌(Acinetobacter baumannii,A.baumannii)屬革蘭氏陰性菌,屬危害健康的主要病原菌之一,具有獲得性耐藥和環境適應能力,在醫院環境中廣泛存在,粘附性較強,可粘附在醫用器材和醫護人員手上、且存活時間較長[1]。目前國際上A.baumannii的疫苗尚未成功,導致A.baumannii感染在社區和醫院存在,且患者死亡率較高[2]。另外,A.baumannii基因組對大多數抗菌藥均產生耐藥性,且隨著臨床上使用抗生素的逐年增加,導致耐藥性逐年增強[3],因此找到新的治療和預防策略從而對抗A.baumannii的感染已成為目前刻不容緩的工作。近幾年來,學者們對A.baumannii疫苗研究做出了較多探索,在研究中發現了滅活全細胞、外膜復合物和外膜囊泡等多組分抗原,外膜蛋白、膜轉運蛋白、生物膜相關蛋白、莢膜多糖和膜相關多糖等單抗原[4,5]。但這些抗原安全性卻有待研究。本文以A.baumannii外膜受體oprC為研究對象,探討其抗體制備過程和生物學活性,為A.baumannii疫苗的研究提供一定參考。
1 材料與方法
1.1實驗動物與試劑:健康BALB/c小鼠購自北京Vital River實驗動物技術有限公司,SPF級,生產許可證號:SCXK(京)2019-0103,使用許可證號:SCXK(京)2019-0006,體重(20±2)g。EcoRⅠ、HindⅢ酶購自Thermo Scientific;T4連接酶購自SinoBio;異丙基硫代-β-D-半乳糖苷購自蘇州亞科科技有限公司;弗氏完全佐劑購自美國Sigma公司。
1.2實驗方法
1.2.1抗原的制備:ATCC 17978培養基培養A.baumannii 16~18h,提取總DNA,以NCBI(https://www.ncbi.nlm.nih.gov)上oprC的DNA為目的基因,設計上游加EcoRⅠ(5'-TAATACGACTCACTATAGGG-3')、下游加HindⅢ(5'-GCTAGTTATTGCTCAGCGG-3')酶切位點的引物,擴增目的片段,反應程序為:95℃、5min,95℃、30s,55℃、30s,72℃、2min,35個循環;72℃、10min。T4連接酶連接目的片段到pET28a上,得重組質粒。重組質粒轉E.coli BL21感受態細胞中,制備單克隆菌落,并經雙酶切和測序驗證。單菌落37℃培養過夜,LB培養液在光密度值0.6時添加異丙基硫代-β-D-半乳糖苷誘導目的基因表達,SDS-PAGE鑒定重組蛋白表達情況,同時空載上所含(標簽)蛋白作為對照,載體標簽為N-His、N-Thrombin、N-T7、C-His。
1.2.2重組蛋白的純化:GST柱親和層析法純化蛋白。重組質粒菌液置于ATCC 17978培養液中培養并擴培,密度合適時離心收集細菌,每升菌液用50mL PBS重懸,加1%TritonC-100、1%β-巰基乙醇、苯甲基磺酰氟,并超聲裂解菌體,15000g離心10min取上清并添加GST-beads,輕搖1h吸附蛋白;2000g離心3min棄上清,加1mL GST Elution Buffer,輕搖10min,2000g離心3min收集上清,SDS-PAGE鑒定蛋白純度,Bradford法鑒定蛋白濃度,將蛋白置于-20℃保存。
1.2.3多克隆抗體的制備:純化好的融合蛋白作為抗原免疫小鼠,目的蛋白:弗氏完全佐劑=1∶1混勻后采用多線注射法皮下注射小鼠,一免為0.1mg蛋白/小鼠;一周后二免,目的蛋白:弗氏不完全佐劑=1∶1混勻后,0.1mg蛋白/小鼠皮下注射小鼠;三免、四免方法與二免相同且間隔時間相同。四免結束后4d眼部采血,采集的血液于37℃恒溫箱中靜置1h,4℃冰箱過夜,待血清析出后移置新的離心管中置于-20℃冰箱保存。陰性對照組同一時間點注射等體積PBS做對照處理,同時相同方法收集血清做陰性對照。
1.2.4抗體效價測定:酶聯免疫吸附(enzyme linked immunosorbent assay,ELISA)法測定抗體效價。抗原0.5μg,抗原包被液將抗原稀釋至100μL,加入96孔板中,4℃過夜;加入200μL PBST+5%脫脂奶粉,4℃封閉過夜,以1∶200、1∶400、1∶800、1∶1600、1∶3200、1∶6400、1∶12800、1∶25600、1∶51200梯度稀釋陰性、陽性血清,每孔加100μL,37℃孵育1h;PBST洗板3次,加入1∶3000稀釋辣根過氧化物酶標記的山羊抗鼠IgG,每孔100μL,37℃孵育1h;加底物鄰苯二胺100μL,37℃孵育20min,2moL/L H2SO4終止反應,讀取OD 490,P/N≥2.1為判定標準,確定抗體最終效價。
1.2.5重組蛋白對感染小鼠的存活率:腹腔注射4.2×108CFU/mL A.baumannii,對60只小鼠進行攻毒實驗,小鼠表現為弓背、豎毛癥狀時,30只小鼠注射oprC蛋白多克隆抗體,另30只小鼠只進行攻毒實驗,從第0天開始至第21天觀察小鼠生存情況,統計21d生存率。
1.2.6感染后血清中荷菌量情況:另每組隨機6只小鼠感染12h,眼球靜脈取血50μL,無菌條件下涂板,平板置于37℃培養箱中培養過夜,計數細菌定值量。
1.2.7HE染色各組小鼠臟器情況:1.2.6小鼠取靜脈血后,分別取小鼠肺、肝臟、脾臟、腎臟,4%多聚甲醛固定,待固定后,經脫水處理,二甲苯透明,經包埋后,切片機切片,厚度4μm,蘇木精-伊紅染色,光學顯微鏡下觀察臟器病理變化和炎癥損失。
2 結 果
2.1目的片段擴增成功:NCBI中oprC全基因組為模板PCR擴增長度為2115bp,全基因組擴增大小為>2000bp,大體與oprC基因全長預期相符。見圖1。

圖1 PCR擴增oprC序列瓊脂糖膠圖片
2.2雙酶切鑒定重組質粒大小為1500bp-3000bp:目的片段與pET28a質粒連接,pET28a空質粒5369bp,篩選oprC+pET28a重組質粒,質粒圖譜見圖2。重組質粒經過EcoRⅠ、HindⅢ雙酶切驗證連接情況。oprC+pET28a重組質粒經雙酶切后瓊脂糖膠上呈現兩個片段,1500bp-3000bp間為oprC片段,5000bp附近為pET28a質粒片段。空質粒pET28a片段長度5000bp附近。大小與預期相符。見圖3。
圖2 質粒圖譜

圖3 酶切鑒定重組質粒瓊脂糖膠圖片
2.3原核表達鑒定重組蛋白大小為70kDa:pET28a蛋白大小為26kDa,oprC蛋白大小為70kDa。異丙基硫代-β-D-半乳糖苷誘導目的基因表達為蛋白,在97.2kDa附近蛋白表達量升高推測為oprC+pET28a重組蛋白(獨立組分),20.1kDa與29.0kDa之間某一區域蛋白表達量升高,推測為pET28a標簽蛋白表達。大小與預期相符。見圖4。
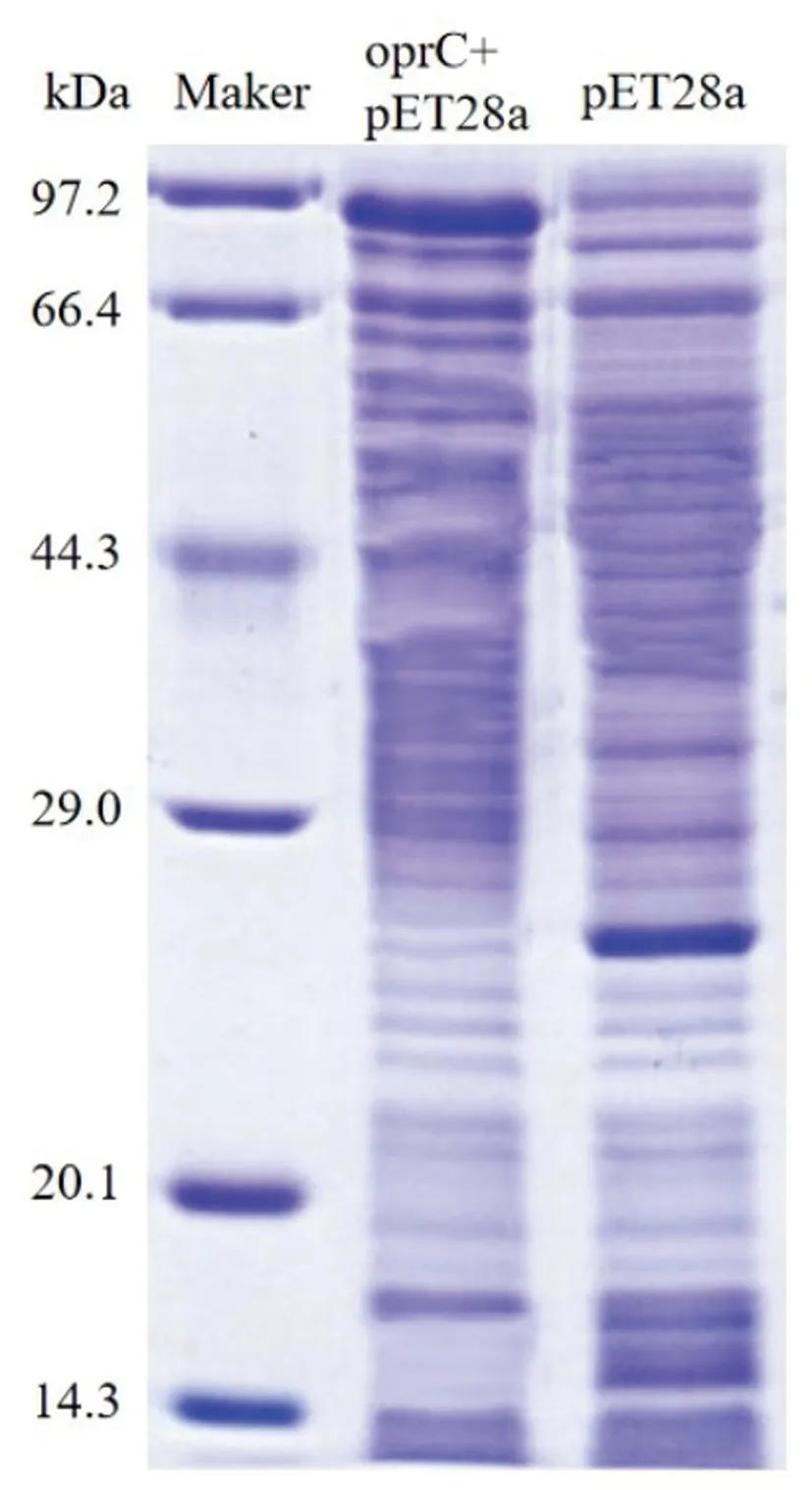
圖4 重組蛋白鑒定SDS-PAGE膠圖片
2.4抗體效價為1∶12800,ELISA法檢測結果顯示,oprC抗血清效價為1∶12800。見圖5。
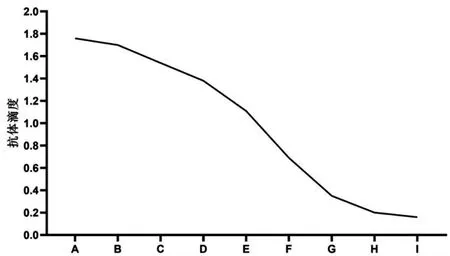
圖5 oprC抗血清效價檢測示意圖
2.5oprC蛋白多克隆抗體提高小鼠的存活率:攻毒實驗后注射oprC蛋白多克隆抗體小鼠存活率為80%,只進行攻毒實驗小鼠存活率為30%,兩者存活率比較差異有統計學意義(P<0.05)。見圖6。
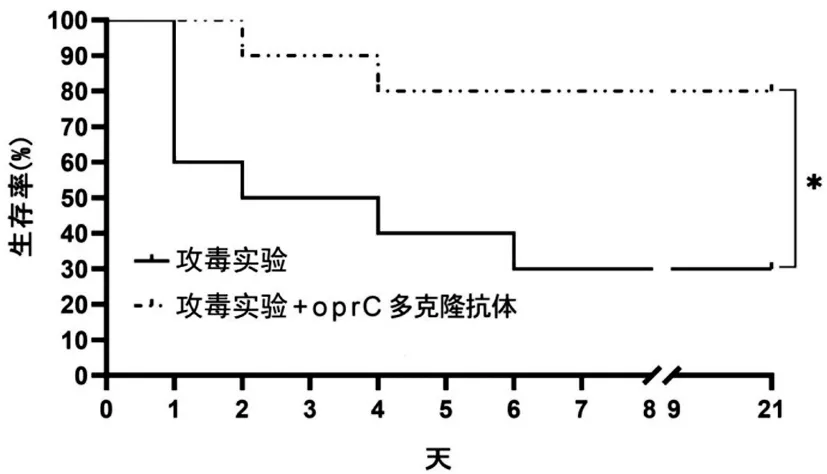
圖6 攻毒實驗后小鼠生存率情況
2.6oprC蛋白多克隆抗體降低感染后血液中荷菌量:感染12h后,單純攻毒實驗小鼠血液中荷菌量為(4.3×105/CFU),攻毒實驗+oprC多克隆抗體小鼠血液中荷菌量為(1.9×105/CFU);攻毒實驗+oprC多克隆抗體小鼠血液中荷菌量明顯低于單純攻毒實驗小鼠(P<0.05)。
2.7oprC蛋白多克隆抗體減輕組織病理損傷:攻毒實驗顯示小鼠肺組織中肺泡壁充血明顯、間質內血管明顯擴張,腔內出現明顯的炎癥滲出及炎癥細胞浸潤明顯;肝臟組織內變化不明顯;脾臟中紅髓變大、白髓變小,淋巴細胞數量減少、變得稀疏;腎臟組織中腎小球出現肥大、系膜增厚現象,腎小球基底膜增厚,組織纖維化、炎癥細胞浸潤明顯。攻毒實驗+oprC多克隆抗體中肝臟差異不明顯外,其余各組織癥狀均有所緩解。見圖7。
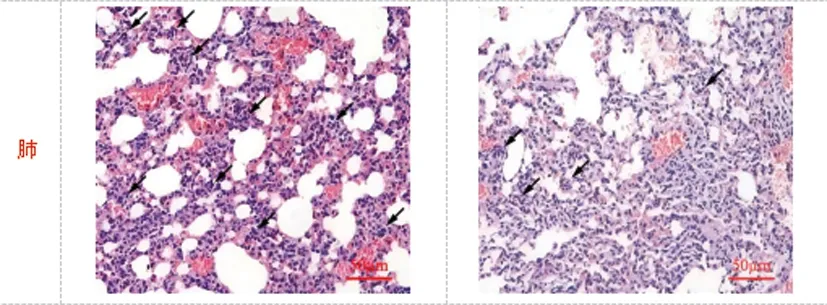
圖7 兩組肺、肝臟、脾臟、腎臟病理性損傷情況
3 討 論
A.baumannii是一種新型的機會型醫院病原菌,A.baumannii感染表現為醫院和社區獲得性肺炎、血流感染、心內膜炎、泌尿道感染、傷口感染、燒傷感染、皮膚和軟組織感染以及腦膜炎等[6],危害嚴重。為降低A.baumannii感染的疾病,噬菌體和抗生素制劑治療A.baumannii,造成A.baumannii耐藥,嚴重影響治療效果[7]。改善A.baumannii耐藥性,可能是緩解疾病方法之一。A.baumannii外膜蛋白是目前研究最深入的耐藥蛋白之一,A.baumannii附著在支氣管上皮細胞中,參與氧化應激和抗微生物作用,從而發揮其功能[8]。外膜蛋白的研究中心在2014年6月研究中發現6個陽性蛋白,包括外膜蛋白ompA、omp34kDa,外膜受體蛋白oprC、oprB,OXA-23和鐵載體受體蛋白,這些外膜蛋白均存在于菌體表面,且與細菌毒力、耐藥性、細菌生長關系密切,可作為防治A.baumannii的抗原疫苗和被動免疫療法候選組分[8]。外膜蛋白ompA主要分布于菌體及其外膜囊泡中,可誘發宿主細胞氧化應激,并侵襲至線粒體和細胞核中,促進細胞凋亡壞死[9];omp34kDa參與細胞粘附作用[10]。外膜蛋白的主動和被動免疫均可提高小鼠的存活率,抑制器官和外周血中的細菌負擔,并降低血清炎性細胞因子和趨化因子的水平[11]。外膜受體蛋白oprB影響葡糖糖轉運過程,DNJ-NAc可通過OprB進入細胞,DNJ-NA是一種與葡萄糖具有相似抗感染性蛋白[12]。OXA-23樣家族是伊朗A.baumannii和醫院不動桿菌對碳青霉烯耐藥的主要原因[13]。鐵載體受體蛋白在細菌鐵離子攝取機制中發揮重要作用,是細菌的毒力因子和潛在的疫苗靶基因[14]。外膜受體蛋白由于磷脂雙分子層對膜受體的動態構象、信號轉導及蛋白間的相互作用均有調節作用,可影響膜結構和功能。
本研究以外膜受體蛋白oprC為研究對象,其結構和功能尚未發現相關報道。根據NCBI中oprC的DNA全基因序列設計引物,在A.baumannii中克隆出全長,NCBI預測全長為2115bp,凝膠電泳預測正確。與pET28a構建重組質粒,并誘導重組蛋白大小表達,重組蛋白并作為免疫原免疫小鼠,得到抗血清抗體,抗體效價為1∶12800;且oprC蛋白多克隆抗體對A.baumannii感染小鼠有一定保護作用。小鼠全身感染A.baumannii模型在12h發現荷菌量在oprC蛋白多克隆抗體中出現明顯降低現象,且肺、脾臟、腎臟炎癥病理損傷得到明顯改善。早期4d過程中死亡率較高,且機體接種疫苗的免疫效果較差,抗A.baumannii的被動免疫可誘導小鼠產生較高的oprC抗體,介導體液免疫反應,從而治療疾病。
綜上所述,本研究成功構建并表達oprC重組蛋白,制備oprC蛋白多克隆抗體,并對oprC抗體的免疫保護效果做了初步探究,為A.baumannii基因工程重組疫苗奠定一定的基礎。

