慢性鼻-鼻竇炎內窺鏡手術后伴發分泌性中耳炎的危險因素分析
甘輝云, 杜敬東, 歐陽虹, 程 杰
(三峽大學附屬仁和醫院耳鼻咽喉科, 湖北 宜昌 443001)
慢性鼻-鼻竇炎(Chronic rhinosinusitis,CRS)是鼻腔及鼻竇的慢性炎性疾病,據相關資料顯示[1],CRS在我國的發病率約為10%左右。針對該病臨床多采用鼻內窺鏡手術治療,操作方便,對鼻竇解剖結構損傷較小,有利于術后鼻腔及鼻竇功能恢復,但部分患者術后仍會出現不同程度的并發癥[2]。分泌性中耳炎(otitis media with effusion,OME)是CRS患者內窺鏡手術后常見的伴發疾病,相關資料顯示[3],鼻內窺鏡術后OME的發生率可達到5%~55%,OME患者主要表現為中耳積液與聽力下降,該病若不及時治療可致患者出現永久性聽力障礙,嚴重影響患者的生活與工作,需引起高度重視[4]。鑒于此,本研究特對218例CRS患者的臨床資料進行回顧,分析其內窺鏡手術后伴發OME的危險因素,并根據分析結果對CRS患者治療期間進行防控建議,報道如下:
1 資料與方法
1.1一般資料:對醫院2016年2月至2020年2月收治的218例行CRS內窺鏡手術患者的臨床資料進行回顧,男性121例、女性97例,年齡19~68歲,平均(35.86±5.73)歲,病程1~25年,平均(9.35±1.47)年,非息肉性CRS患者173例,息肉性CRS患者45例,海口分型:Ⅰ型82例,Ⅱ型94例,Ⅲ型42例,上額竇炎98例(單側75例,雙側23例),篩竇炎69例(單側53例,雙側16例),蝶竇炎51例(單側40例,雙側11例),咽鼓管功能鼓室導抗圖分布:A型189例,As型10例,Cs型19例,合并吸煙史46例,酗酒史39例,所有患者均實施局部麻醉。本次研究經過醫院倫理委員會審批通過。納入標準:①經診斷為CRS的成年患者;②均進行內窺鏡手術治療且有完整的臨床資料者;③本人或家屬同意對其臨床資料進行分析者。排除標準:①主動放棄治療者;②轉至上級醫院接受治療者;③伴有神經或認知功能障礙者;④伴有腫瘤、心力衰竭、肝功能衰竭者;⑤免疫系統缺陷者;⑥嚴重感染、出血者;⑦自然失訪者。
1.2方法:OME的判斷方法[5]:①聽力出現不同程度的下降,并伴有耳鳴、耳堵;②耳鏡檢查顯示鼓氣時鼓膜活動差,鼓膜上有發絲樣液平線或見鼓膜增厚呈油紙樣;③聽力檢查呈傳導性耳聾或混合性耳聾,聲阻抗股室壓圖呈B型或C型。將出現上述癥狀≥2項者記為伴發OME。
1.3觀察指標:①統計CRS內窺鏡手術后伴發OME的情況;②對比發生者和未發生者一般資料;③統計CRS內窺鏡手術后伴發OME的危險因素及其危險系數。
1.4統計學分析:將SPSS20.0軟件作為統計學工具,計數資料以“率”描述,以χ2檢驗;采用Logistic回歸分析探討CRS內窺鏡手術后伴發OME的危險因素。P<0.05為差異有統計學意義。
2 結 果
2.1CRS內窺鏡手術后伴發OME的情況:本組218例CRS內窺鏡手術患者術后3個月內共有16例伴發OME(14例患者為單側耳,2例患者為雙側耳),發生率為7.34%(16/218),其余202例CRS內窺鏡手術患者未伴發OME。
2.2伴發OME的發生者和未發生者一般資料對比:本組發生者與未發生者性別、年齡、CRS病程、吸煙史、酗酒史、哮喘史分布對比差異均無統計學意義(P>0.05),發生者伴有變應性鼻炎病史、反復呼吸道感染、乳突氣化不良、鼻息肉、術前長時間應用鼻減充血劑構成比均高于未發生者(P<0.05),術后定期術腔清理、術后應用鼻內糖皮質激素、術后應用抗生素、術后應用粘液稀化劑構成比均低于未發生者(P<0.05),見表1。
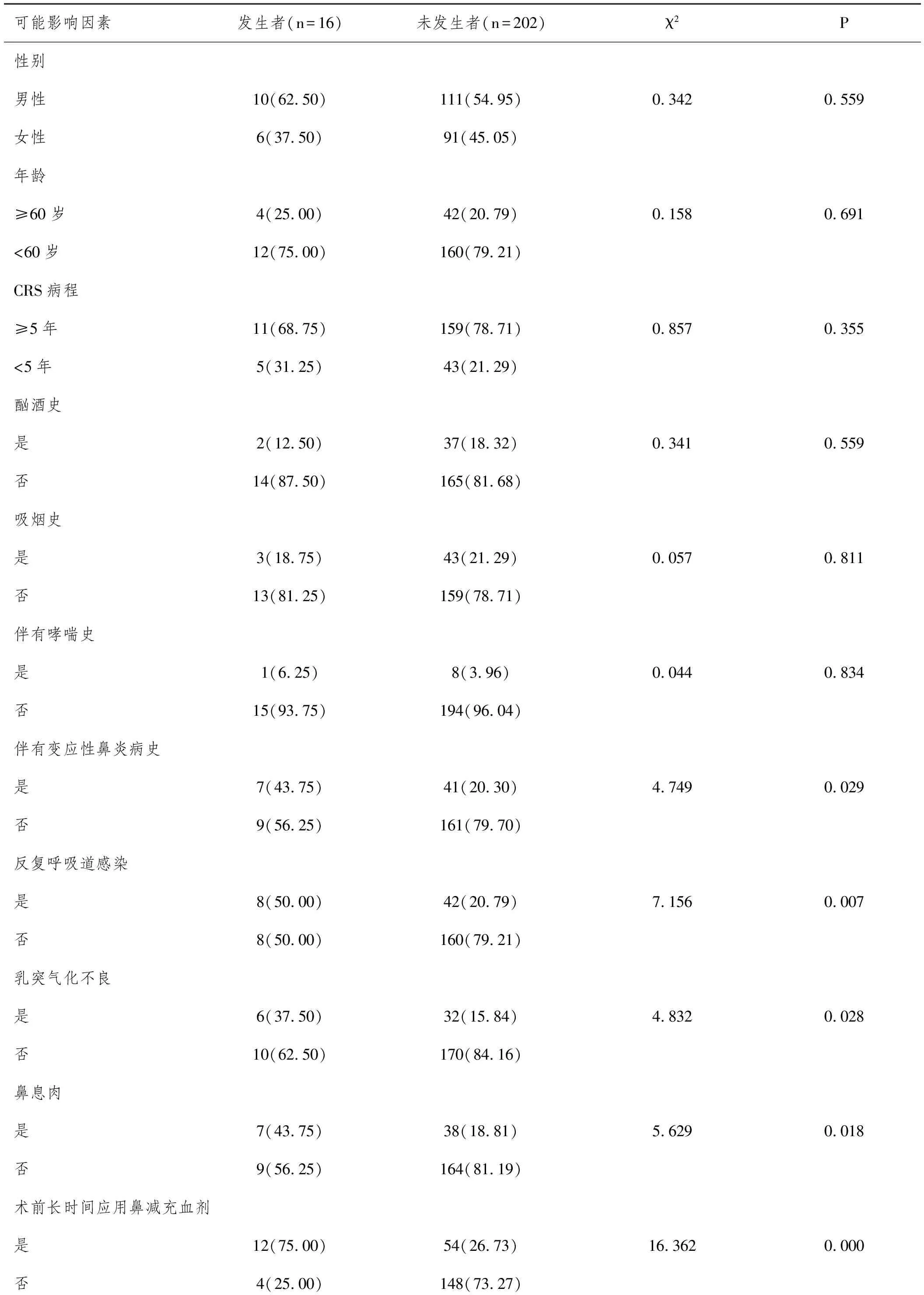
表1 發生者和未發生者一般資料對比n(%)
2.3危險因素Logistic回歸分析:將單因素分析結果中P<0.05的因素作為自變量納入Logistic多元回歸分析模型并進行賦值(伴有變應性鼻炎病史:否=0,是=1;反復呼吸道感染:否=0,是=1;乳突氣化不良:否=0,是=1;鼻息肉:否=0,是=1;術前長時間應用鼻減充血劑:否=0,是=1;術后定期術腔清理:否=0,是=1;術后應用鼻內糖皮質激素:否=0,是=1;術后應用抗生素:否=0,是=1;術后應用粘液稀化劑:否=0,是=1),將OME發生與否記為因變量并進行賦值(發生=1,未發生=0),采用逐步向前法篩選危險因素。經Logistic回歸分析可知,伴有變應性鼻炎病史、反復呼吸道感染、乳突氣化不良、鼻息肉、術前長時間應用鼻減充血劑均是CRS內窺鏡手術后伴發OME的獨立危險因素(P<0.05),術后定期術腔清理、術后應用鼻內糖皮質激素、術后應用抗生素、術后應用粘液稀化劑均是其保護因素(P<0.05),見表2。
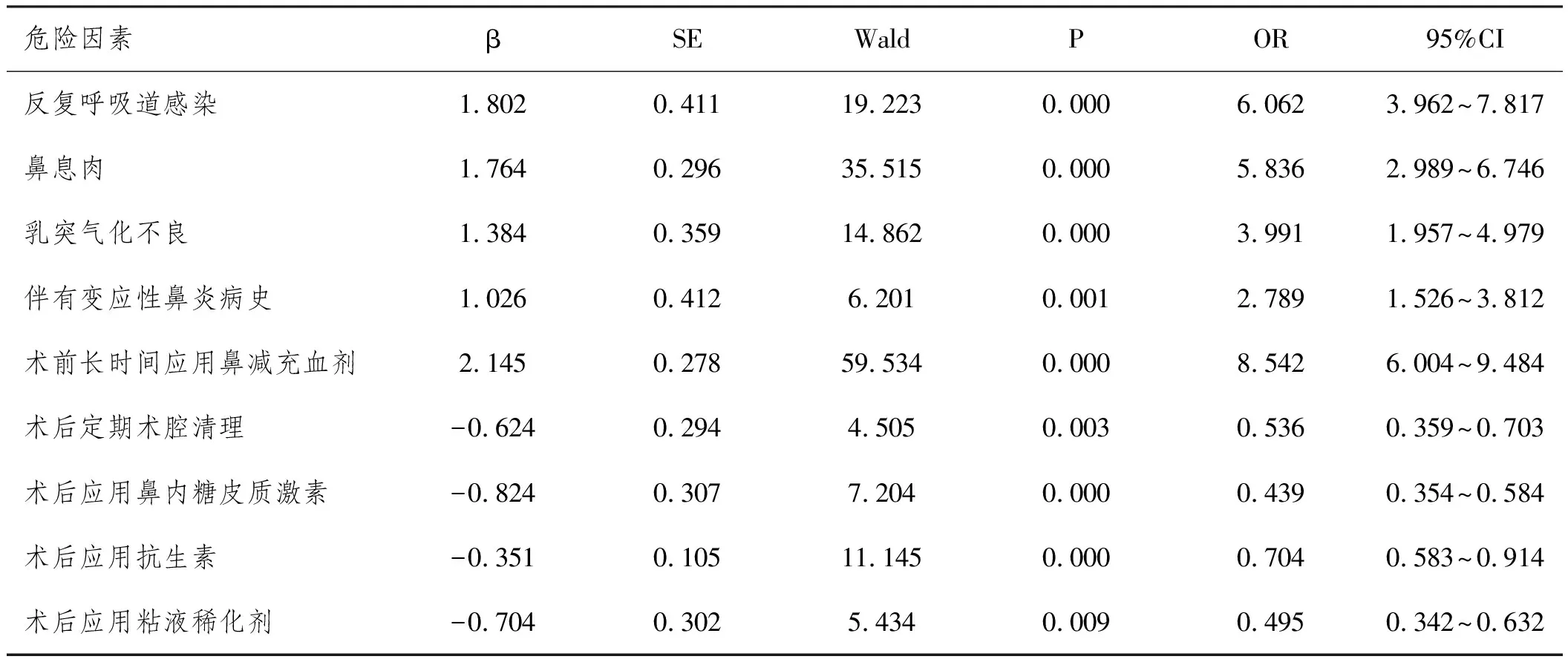
表2 危險因素Logistic回歸分析結果
3 討 論
3.1CRS內窺鏡手術后伴發OME現狀及探討危險因素的必要性:OME是CRS患者常見的伴發疾病,由于患者治療藥物應用、機體差異、基礎疾病等可導致部分CRS患者內窺鏡手術后有OME的情況發生。本次研究中,218例CRS患者中OME的發生率為7.34%,既往報道[6]在50例慢性鼻竇炎患者內窺鏡手術后OME的發生率為12.00%,本研究低于上述報道數據,可能是因為醫院接受的CRS患者治療狀況、患者身體狀況、疾病情況等不同導致。同時也證實CRS患者內窺鏡手術后伴發OME的風險較高,肯定了對其危險因素進行深入探討分析的必要性和重要性。影響CRS患者內窺鏡手術后伴發OME的危險因素多種多樣,需對其進行深入探討和分析,才能作為制定CRS患者內窺鏡手術后伴發OME防控措施的基礎,為其指明方向,改善患者預后。
3.2危險因素分析:在本研究單因素和多因素分析結果中顯示,伴有變應性鼻炎病史、反復呼吸道感染、腺樣體肥大、乳突氣化不良、鼻息肉、術前長時間應用鼻減充血劑均是CRS內窺鏡手術后伴發OME的獨立危險因素,表明CRS內窺鏡手術后伴發OME的危險因素多種多樣,提醒臨床醫務人員需引起高度重視。有報道證實合并腺樣體肥大、乳突氣化不良、鼻息肉等均可增加CRS患者內窺鏡手術后OME的發生風險[7],與本研究報道相符,共同證實上述自變量均為CRS患者內窺鏡手術后伴發OME的危險因素。結合既往相關報道,分析本研究結果中的危險因素增加CRS內窺鏡手術后伴發OME的原因為:伴有變應性鼻炎病史患者由于變應性使機體鼻腔黏膜長時間處于高反應狀態,造成黏膜腫脹或者滲出,分泌物增多,使咽鼓管口水腫阻塞,局部產生炎性介質,導致咽鼓管狹窄、阻塞,進而導致中耳負壓,引發OME。反復呼吸道感染患者易發生鼻咽部的炎癥水腫,進而引起粘液纖毛運輸系統的滲出及咽鼓管的異常開放,呼吸道病原菌通過咽鼓管進入中耳造成感染,且炎癥刺激可導致咽鼓管的機械阻塞及功能異常,進而可導致OME的發生[8]。乳突氣化越差,黏膜炎癥越明顯,中耳壓力越低,乳突氣化不良患者的乳突對中耳腔的眼里調節能力降低,當咽鼓管功能發生障礙時,機體中耳腔易造成負壓,導致中耳滲液[9]。鼻息肉患者鼻黏膜發生病變,鼻腔內分泌物增加,導致咽鼓管狹窄、阻塞,形成中耳負壓,最終引發OME。鼻減充血劑可溶解纖毛膜,致使機體部分纖毛脫落,損傷鼻黏膜上皮,進而造成上皮細胞變形壞死,損傷鼻黏膜下皮,造成鼻黏膜上皮下腺體過度增生肥厚,肥大的腺樣體壓迫咽鼓管咽口,導致咽鼓管的通氣引流發生障礙,導致OME的發生[10]。
3.3保護因素分析:本次研究還顯示,術后定期術腔清理、術后應用鼻內糖皮質激素、術后應用抗生素、術后應用粘液稀化劑均是CRS內窺鏡手術后伴發OME的保護因素,有報道證實術后定期術腔清理、術后應用抗生素等均可改善CRS內窺鏡手術預后,降低CRS患者內窺鏡手術后OME的發生風險[11],與本研究報道相符。術后定期通過術腔清理囊泡、小息肉、肉芽、纖維素性粘連病變組織,使咽鼓管通氣引流通暢,有助于降低OME的發生幾率。術后應用鼻內糖皮質激素有利于減輕水腫,減少分泌物,促進術后愈合,降低術后OME的發生風險。術后應用抗生素可有效抑制細菌繁殖,降低術后感染幾率,有利于減少OME的發生。術后應用粘液稀化劑可有效改善患者術后黏膜分泌,增強咽鼓管引流,降低術后感染事件的發生率,對預防CRS內窺鏡手術后OME的發生具有一定效果。
3.4防控建議:根據本研究報道和分析結果,制定控制CRS內窺鏡手術后伴發OME的措施,具體如下:①對于伴有變應性鼻炎病史、反復呼吸道感染患者,治療醫師應術前開展頭腦風暴會議,積極討論最適合患者情況的治療方案,以期找出最佳治療方案;②對乳突氣化不良、鼻息肉患者,治療醫師重視此類基礎疾病并對癥支持治療,包括內窺鏡手術時同時行腺樣體切除術、清除鼻息肉等,全面治療出現的各種癥狀,盡可能改善患者預后;③對于術前長時間應用鼻減充血劑患者,應積極進行藥物治療的健康宣講,呼吁廣大患者合理使用藥物;④術后定期術腔清理患者要積極做好復查、回訪,同時積極進行藥物綜合治療,提高治療效果;⑤對于術后應用鼻內糖皮質激素、術后應用抗生素、術后應用粘液稀化劑患者,合理使用激素、抗生素等藥物,盡可能減輕對機體其它器官功能造成的影響,可考慮中西醫結合治療方案。
3.5小結:CRS內窺鏡手術后伴發OME的風險較高,乳突氣化不良、鼻息肉等均是CRS內窺鏡手術后伴發OME的獨立危險因素,術后定期術腔清理、術后應用抗生素等均是其保護因素,建議根據報道結果加強防控建議,降低CRS內窺鏡手術后OME的發生率,促進康復。

