芍藥內酯苷對新生缺氧缺血性腦損傷小鼠的神經保護的實驗研究
陽 梅, 李明玉, 李德淵
(1.四川大學華西第二醫院眉山市婦女兒童醫院新生兒科, 四川 眉山 620010 2.四川大學華西第二醫院新生兒科, 四川 成都 610000)
新生兒圍產期缺氧缺血性腦損傷(Hypoxic ischemic brain injury,HIE)是許多嚴重人類神經功能障礙的重要危險因素,如運動和學習障礙、腦癱、癲癇,甚至死亡,占新生兒總數的23%[1,2]。HIE直接導致大量神經元死亡,細胞凋亡為引起神經元死亡的一個重要途徑,尤其海馬區[3]。機體的炎癥、氧化應激反應均能夠誘導細胞凋亡。芍藥內酯苷是一種單萜苷,是常用中藥芍藥的活性成分之一。近年來,隨著藥效學的深入研究,人們發現其具有不同于芍藥苷的獨特藥效學特征,在神經損傷疾病的治療方面具有獨特的優越性[4,5]。磷脂酰肌醇3-激酶/絲氨酸-蘇氨酸激酶/雷帕霉素哺乳動物靶點(Phosphatidylinositol 3-kinase/Serine-threonine kinase/Mammalian target of rapamycin,PI3K/AKT/mTOR)信號通路是參與細胞轉錄、翻譯、遷移、代謝、增殖和存活的中央樞紐[6]。多項研究表明,該信號通路激活后可通過減輕自噬發揮神經保護作用[7]。本研究旨在探究芍藥內酯苷對HIE腦損傷幼鼠的神經保護作用的機制。
1 資料與方法
1.1一般資料
1.1.1實驗動物來源:45只出生9d的幼鼠及母鼠,來自北京維通利華實驗動物公司;合格證號SCXK(京)2018-0032。
1.1.2試劑及器材:芍藥內酯苷(貨號:39011-90-0)購自成都瑞芬思生物科技有限公司;2,3,5-氯化三苯基四氮唑(Triphenyltetrazolium chloride,TTC)染色液購自北京索萊寶生物技術有限公司;脫氧核苷酸末端轉移酶(TdT-mediated dUTP-biotin nick end labeling,Tunel)試劑盒購自羅氏(Roche)公司;小鼠MDA、SOD、GSH 酶聯免疫吸附試驗(ELISA)檢測試劑盒和小鼠白介素IL-6、IL-18、IL-1β ELISA檢測試劑盒均購自上海碧云天商務技術有限公司;兔抗鼠ICAM-1多抗、兔抗Cleaved caspase-3、Cleaved caspase-9多抗及兔抗PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR等一抗均來自艾博抗(上海)貿易有限公司;XBS-02B型全自動缺氧動物模型飼養箱購自杭州艾普儀器設備有限公司;IXplore Pro自動化顯微鏡系統購自日本Olympus。
1.2方 法
1.2.1新生小鼠缺氧性腦損傷(HIE)模型的制造:將小鼠麻醉、仰臥固定,解剖顯微鏡下操作:頸中線切開皮膚,分離頸總動脈、內動脈、外動脈,尼龍繩雙重結扎頸總動脈,中間剪斷頸總動脈,縫合皮膚。將小鼠在電爐旁溫暖,直至全部蘇醒,再轉移至母鼠籠中休息。2h后再將小鼠轉移至恒溫缺氧箱,10%氧氣、90氮氣的缺氧箱中維持40min,再放置37℃恒溫箱2h,轉移至母鼠籠。
1.2.2動物分組:45只小鼠隨機分3組,每組15只,分別標記為假手術組、模型組、芍藥內酯苷組。模型組、芍藥內酯苷組小鼠均需HIE造模。假手術組小鼠,僅做分離頸內、外、總動脈,不做栓塞。模型組小鼠按照上述操作造模。芍藥內酯苷組小鼠,造模后給予30mg/kg芍藥內酯苷灌胃,每天1次,連續21d。假手術組、模型組小鼠,給予等量的蒸餾水灌胃。
1.2.3指標檢測
1.2.3.1腦梗死面積檢測:TTC染色法檢測小鼠腦梗死:斷頭法處死小鼠,取新鮮腦組織-20℃,30min,切成2mm。置于TTC溶液孵育30min,白色為梗死區。甲醛中固定,拍照,Image J軟件分析腦梗死率(%)為梗死面積與總面積百分率。
1.2.3.2腦組織細胞凋亡檢測:Tunel檢測細胞凋亡:取新鮮的腦組織,4%多聚甲醛固定12h,制作石蠟切片。按照Tunel試劑盒中石蠟包埋切片的檢測方法操作。使用蛋白酶K對二甲苯、梯度乙醇處理的切片進行室溫處理15min,PBS沖洗,晾干。濕盒內操作標記、顯色:用Tunel反應混合液37℃孵育1h。DAPI室溫下反應15min,PBS沖洗,抗熒光猝滅劑封片。熒光顯微鏡下觀察,拍照。Tunel染色陽性凋亡細胞顯綠色,DAPI核染細胞顯藍色。陽性凋亡細胞的百分率為腦組織細胞凋亡率。WB檢測組織中Cleaved caspase-3、Cleaved caspase-9蛋白表達:腦組織勻漿,裂解液冰上裂解,超聲裂解,提取總蛋白。對蛋白BCA定量,沸水變性。聚丙烯酰胺凝膠電泳濃縮、分離蛋白,濕轉法將蛋白轉移至PVDF膜。封閉液對膜封閉處理后滴加一抗溶液(1500倍稀釋的兔抗Cleaved caspase-3、Cleaved caspase-9),37℃孵育2h,PBS沖洗,再滴加二抗溶液(500倍稀釋的HRP標記山羊抗兔二抗),繼續孵育1.5h,沖洗。滴加電化學發光顯色液,凝膠成像系統曝光。Image J分析條帶灰度。
1.2.3.3腦組織氧化應激水平檢測:取腦組織勻漿液做樣本。按照小鼠MDA、SOD、GSH酶聯免疫吸附試驗(ELISA)檢測試劑盒要求操作,處理樣本、判定實驗有效性、計算樣本中MDA、SOD、GSH的含量。
1.2.3.4腦組織炎癥水平檢測ICAM-1、IL-6、IL-18、IL-1β:取新鮮的腦組織,4%多聚甲醛固定12h,制作石蠟切片。脫蠟后,反復蒸煮2次,進行熱抗原修復。先將組織用山羊血清封閉處理,室溫下孵育1.5h。200倍稀釋的兔抗鼠ICAM-1多克隆抗體作為一抗,37℃孵育組織1h,500倍稀釋的山羊抗兔二抗作為二抗,37℃孵育組織1h。加100倍稀釋的鏈霉親和素-生物素復合物(SABC)孵育30min,滴加顯色液。脫水后,封片,200倍顯微鏡下觀察、拍照。棕褐色為ICAM-1蛋白陽性,用陽性數與總細胞數百分比表示ICAM-1蛋白表達情況。取腦組織勻漿液做樣本。小鼠白介素IL-6、IL-18、IL-1β ELISA檢測試劑盒分析樣本中IL-6、IL-18、IL-1β的含量。具體操作步驟見各個試劑盒說明書。
1.2.3.5腦組織PI3K/AKT/mTOR通路活性檢測:腦組織勻漿后,進行蛋白免疫印跡實驗,檢測其中PI3K/AKT/mTOR通路關鍵基因PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR的蛋白表達量。具體操作步驟同1.2.3.2中的蛋白檢測方法。
2 結 果
2.1芍藥內酯苷對HIE小鼠腦梗死面積的影響:與假手術組相比,模型組小鼠腦梗死率明顯升高,與模型組相比,芍藥內酯苷組小鼠腦梗死率顯著降低(P<0.05)。見表1。
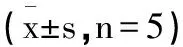
表1 不同濃度芍藥內酯苷對HIE小鼠腦梗死面積的影響
2.2芍藥內酯苷對HIE小鼠腦組織細胞凋亡的影響:與假手術組相比,模型組小鼠腦細胞凋亡率顯著升高(圖1),Cleaved caspase-3、Cleaved caspase-9蛋白顯著升高(圖2),與模型組相比,芍藥內酯苷組小鼠腦細胞凋亡率降低(圖1),Cleaved caspase-3、Cleaved caspase-9蛋白表達也降低(圖2)(P<0.05)。見表2。
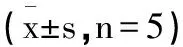
表2 芍藥內酯苷對HIE小鼠腦細胞凋亡的影響
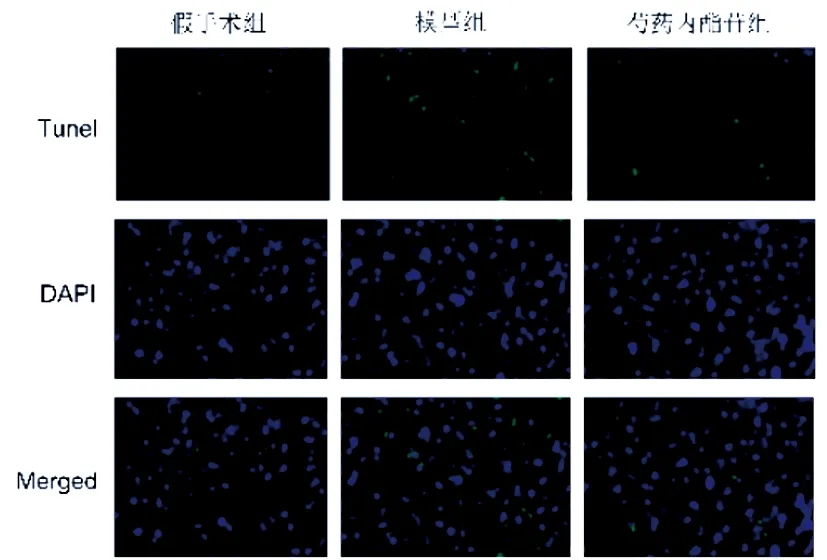
圖1 芍藥內酯苷對HIE小鼠腦組織細胞凋亡的影響
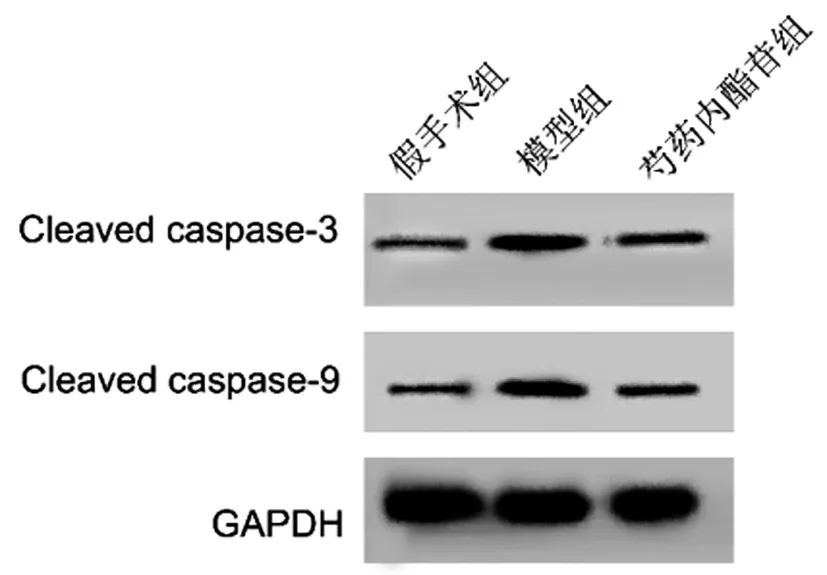
圖2 芍藥內酯苷對HIE小鼠腦組織Cleaved caspase-3和Cleaved caspase-9蛋白表達的影響
2.3芍藥內酯苷對HIE小鼠腦組織氧化應激的影響:與假手術組相比,模型組小鼠腦組織MDA含量升高,SOD、GSH含量均降低,與模型組相比,芍藥內酯苷組小鼠腦組織MDA含量降低,SOD、GSH含量均升高(P<0.05)。見表3。
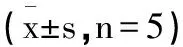
表3 芍藥內酯苷對HIE小鼠腦組織氧化應激的影響
2.4芍藥內酯苷對HIE小鼠腦組織炎癥因子的影響:與假手術組相比,模型組小鼠腦組織ICAM-1、IL-6、IL-18、IL-1β均顯著升高,與模型組相比,芍藥內酯苷組小鼠腦組織ICAM-1、IL-6、IL-18、IL-1β均顯著降低(P<0.05)。見圖3、表4。
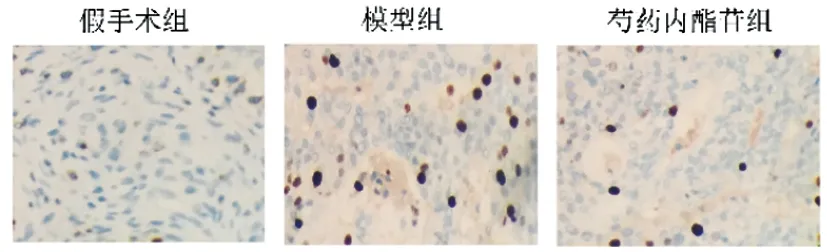
圖3 芍藥內酯苷對HIE小鼠腦組織ICAM-1表達的影響
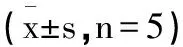
表4 不同濃度芍藥內酯苷對HIE小鼠腦組織炎癥反應的影響
2.5芍藥內酯苷對小鼠腦組織PI3K/AKT/mTOR通路的影響:與假手術組相比,模型組小鼠腦組織p-PI3K、p-AKT、p-mTOR均顯著降低,與模型組相比,芍藥內酯苷組小鼠腦組織p-PI3K、p-AKT、p-mTOR均顯著升高(P<0.05)。見圖4、表5。
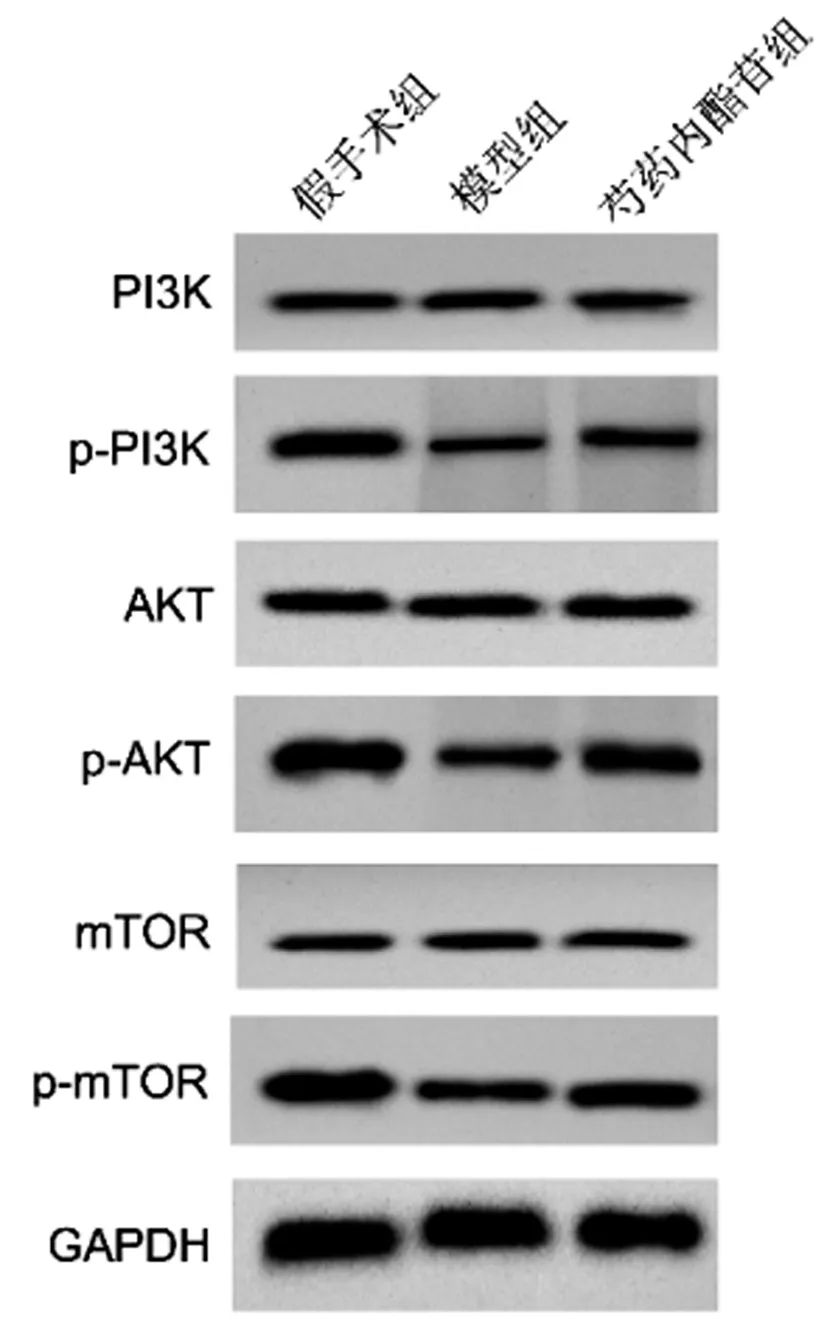
圖4 小鼠腦組織PI3K/AKT/mTOR通路相關蛋白表達
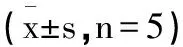
表5 芍藥內酯苷調控小鼠腦組織PI3K/AKT/mTOR通路相關蛋白表達
3 討 論
國內外學者對芍藥內酯苷、芍藥苷的神經保護功能均有研究[8,9],但是其發揮保護作用的機制仍未清楚。Wang等[10]制造大鼠蛛網膜下腔出血模型,探究芍藥苷的作用發現,芍藥苷能改善模型大鼠的神經功能,減少腦含水量,減輕氧化應激反應,抑制活性氧ROS、MDA,SOD、谷胱甘肽過氧化物酶(GSH-Px),抑制小膠質細胞激活和神經炎癥反應,降低神經元凋亡率,說明了芍藥苷可減輕大鼠蛛網膜下腔出血的早期腦損傷。Jiang等[11]研究發現,芍藥苷減輕了缺氧誘導的大鼠腦內神經元損傷及炎性損傷,還減輕缺氧誘導的星形膠質細胞焦亡,進一步研究揭示了芍藥苷抑制缺氧星形膠質細胞HIF1a/miR-210/caspase1/GSDMD信號通路的活性,說明了芍藥苷通過抑制HIF1a/miR-210/caspase1/GSDMD信號通路改善缺氧誘導的星形膠質細胞焦亡,為缺氧性腦損傷的治療提供依據。sICAM-1參與新生兒HEI體內免疫反應和炎癥反應,其表達上調,誘導炎癥介質TNF-α和IL-6大量釋放,加重病情[12]。此研究結果顯示:芍藥內酯苷降低了HIE小鼠的腦梗死率、腦組織細胞凋亡率,下調了SOD、GSH,上調MDA,并下調ICAM-1、IL-6、IL-18、IL-1β,充分說明了芍藥內酯苷增強了HIE小鼠抗凋亡、抗氧化應激、抗炎癥能力,以發揮對HIE小鼠的神經保護功能。
PI3K/AKT/mTOR通路在腦缺血損傷中的神經保護作用已被廣泛研究[12,13]。Wei等[14]研究發現,PI3K/AKT/mTOR信號通路在缺血缺氧性腦損傷新生小鼠中的活性降低,中藥氧化苦參堿治療后該通路的活性得到恢復,小鼠海馬組織神經元的自噬得到明顯減輕,神經功能得到提高。當歸減少缺血性腦卒中小鼠腦梗死,促進神經元的存活,抑制Bcl-2/Bax線粒體功能,其機制為激活PI3K/AKT/mTOR信號通路的活性[15]。因此,本研究推測,PI3K/AKT/mTOR信號通路可能也參與了芍藥內酯苷的藥理作用。此研究結果顯示,HIE小鼠腦組織中p-PI3K、p-AKT、p-mTOR的表達分別下調40%、55.56%、49.31%。芍藥內酯苷治療后,他們的表達均得到了一定恢復,趨于假手術小鼠。這說明了PI3K/AKT/mTOR信號通路確實在HIE小鼠中活性受到抑制,再次驗證了前人的實驗結果,同時也說明了通路的活性受芍藥內酯苷的調控,可能參與了芍藥內酯苷的抵抗HIE新生小鼠腦細胞凋亡、氧化應激、炎癥的過程。
綜上所述,芍藥內酯苷抑制HIE新生小鼠腦組織氧化應激、炎癥及神經元凋亡,降低腦梗死面積,產生這種神經保護作用的機制與激活PI3K/AKT/mTOR信號通路相關,為芍藥內酯苷用于臨床保護神經奠定基礎。

