“葡萄糖充足-溶解氧濃度周期”組合控制策略強(qiáng)化Schizochytrium sp.S31生產(chǎn)二十二碳六烯酸
任俊,吳趙梅,陳志炎*
1(江蘇省溧陽市天目湖中等專業(yè)學(xué)校,江蘇 常州,213300)2(揚(yáng)州大學(xué) 食品科學(xué)與工程學(xué)院,江蘇 揚(yáng)州,225127)
二十二碳六烯酸(docosahexaenoic acid, DHA),俗稱腦黃金,是一種對(duì)人體非常重要的omega-3多不飽和脂肪酸[1]。研究表明,DHA是作用于神經(jīng)系統(tǒng)細(xì)胞生長(zhǎng)及維持的一種主要元素,是大腦和視網(wǎng)膜的重要構(gòu)成脂肪酸,對(duì)嬰兒智力和視力發(fā)育均具有至關(guān)重要的作用[2]。傳統(tǒng)的DHA生產(chǎn)途徑主要是通過以深海魚油為原料進(jìn)行大規(guī)模提取[3]。然而,此種生產(chǎn)方式所獲得的DHA產(chǎn)品的質(zhì)量和產(chǎn)量均無法滿足市場(chǎng)需求[3]。因此,開發(fā)與之相適應(yīng)的新型DHA生產(chǎn)工藝變的尤為重要。
大量研究表明,利用裂殖壺菌(Schizochytriumsp.)通過微生物工業(yè)發(fā)酵法大規(guī)模制備DHA是解決其質(zhì)量和產(chǎn)量不足的有效方法[4]。作為一種典型的好氧型產(chǎn)油微生物,裂殖壺菌生產(chǎn)DHA過程,需維持溶解氧濃度(dissolved oxygen concentration, DO)在充足水平,進(jìn)而實(shí)現(xiàn)促進(jìn)細(xì)胞生長(zhǎng)和DHA積累的目的[5]。然而,好氧微生物若長(zhǎng)期處于DO充足(過量)狀態(tài)下,胞內(nèi)活性氧(reactive oxygen species, ROS)易發(fā)生大量積累,進(jìn)而損害其生物量和目標(biāo)產(chǎn)物的生產(chǎn)[6-8]。因此,如何解決裂殖壺菌發(fā)酵生產(chǎn)DHA過程DO充足與ROS積累的矛盾已成為限制DHA大規(guī)模生產(chǎn)的主要瓶頸之一。在適應(yīng)性實(shí)驗(yàn)室進(jìn)化中,若微生物細(xì)胞長(zhǎng)期處于某一培養(yǎng)環(huán)境導(dǎo)致毒性物質(zhì)的積累,可通過切換至與其相反的培養(yǎng)環(huán)境進(jìn)行恢復(fù)處理,實(shí)現(xiàn)有效地緩解環(huán)境壓力(毒害)的目的[9]。基于此,本文擬構(gòu)建一種新型的周期切換DO控制策略,即將培養(yǎng)(流加)階段等分為若干階段,每個(gè)階段的前期維持DO于充足水平以滿足細(xì)胞生長(zhǎng)和DHA生產(chǎn)的供氧需求,后期維持DO于受限狀態(tài)以實(shí)現(xiàn)抑制ROS積累的目的,最終實(shí)現(xiàn)裂殖壺菌高效生產(chǎn)DHA。
1 材料與方法
1.1 實(shí)驗(yàn)菌種
裂殖壺菌Schizochytriumsp.S31購自美國菌種收藏中心(ATCC)。
1.2 培養(yǎng)基
固體活化培養(yǎng)基(g/L):葡萄糖5,蛋白胨1,酵母粉1,海鹽40,瓊脂20,pH自然。
種子培養(yǎng)基(g/L):葡萄糖5,蛋白胨1,酵母提取物1,海鹽40,pH自然。
分批培養(yǎng)基(g/L):葡萄糖100,酵母菌粉10,其他組分參照文獻(xiàn)[10]。
葡萄糖流加培養(yǎng)基:葡萄糖500 g/L。
1.3 裂殖壺菌的分批補(bǔ)料生產(chǎn)DHA過程
將保藏于甘油管(-80 ℃)中的裂殖壺菌菌種轉(zhuǎn)接至固體活化培養(yǎng)基,并在28 ℃的條件下培養(yǎng)3 d。之后,挑選單菌落接種于裝有種子培養(yǎng)基的搖瓶中,在28 ℃、220 r/min的條件下培養(yǎng)36 h。在此基礎(chǔ)上,將種子液按照13%的接種量轉(zhuǎn)接至5 L攪拌式發(fā)酵罐進(jìn)行分批補(bǔ)料發(fā)酵,初始體積為2.0 L,通氣量2 L/min。培養(yǎng)溫度控制于28 ℃,通過流加磷酸或NaOH將pH全程控制于7.0。同時(shí),待分批發(fā)酵液中葡萄糖質(zhì)量濃度逐漸消耗至40 g/L時(shí),通過脈沖流加葡萄糖的方式,維持其質(zhì)量濃度為40 g/L左右。培養(yǎng)過程中的DO控制方法分別按照下列方式:
DO充足控制:在培養(yǎng)階段通過不斷提高攪拌轉(zhuǎn)速(≤800 r/min)維持DO>10%。如攪拌水平達(dá)到最大值時(shí),DO仍不能控制于10%以上,則通入純氧將DO全程控制于充足水平。
周期DO控制:以通入純氧時(shí)為起始時(shí)刻,將培養(yǎng)階段等分為10個(gè)10 h階段,每個(gè)階段的前8 h通純氧維持DO于充足水平(≥10%),后2 h通過切換至空氣供氧模式維持DO于受限水平(接近于零)。
1.4 細(xì)胞干重、葡萄糖濃度和ROS濃度的測(cè)定
細(xì)胞干重(dry cell weight, DCW)采用真空冷凍干燥法進(jìn)行測(cè)定,具體操作流程與文獻(xiàn)[2]相同。葡萄糖濃度則采用DNS法[11]進(jìn)行測(cè)定。胞內(nèi)ROS濃度的測(cè)定方法與參考文獻(xiàn)[12]所報(bào)道的方法相同,其單位定義為熒光強(qiáng)度(fluorescence intensity, FI)/g DCW。
1.5 檸檬酸裂解酶(citrate lyase, ACL)、蘋果酸酶(malic enzyme, ME)和葡萄糖-6-磷酸脫氫酶(glucose 6 phosphate dehydrogenase, G6PDH)酶活性的測(cè)定
利用超聲波破碎儀對(duì)裂殖壺菌細(xì)胞進(jìn)行破壁處理,之后離心取上清液進(jìn)行ACL、ME和G6PDH酶活性的測(cè)定,其測(cè)定方法參照參考文獻(xiàn)[13]。酶活力單位定義:1 min內(nèi)NADPH的生成量,其數(shù)值等同于在340 nm波長(zhǎng)下吸光值A(chǔ)增加0.001。比酶活力:酶活力單位/mg 可溶性蛋白。其中,可溶性蛋白采用Bradford方法進(jìn)行測(cè)量[10]。
1.6 油脂提取及其各脂肪酸組分測(cè)定
油脂提取和甲酯化過程與文獻(xiàn)[14]相同,內(nèi)標(biāo)選用十九烷酸。采用氣相色譜分析法與內(nèi)標(biāo)法測(cè)定并計(jì)算油脂中各組分脂肪酸的含量[2]。
1.7 葡萄糖比消耗速度和維持代謝系數(shù)的確定
葡萄糖比消耗速度的計(jì)算方法:以葡萄糖消耗量(g/L)為縱坐標(biāo)、獨(dú)立培養(yǎng)時(shí)間(t)為橫坐標(biāo)進(jìn)行多項(xiàng)式(二次)的線性擬合。基于此,通過葡萄糖消耗量對(duì)培養(yǎng)時(shí)間進(jìn)行微分計(jì)算,即可確定葡萄糖比消耗速度。需要指出,分批培養(yǎng)階段的葡萄糖消耗量由公式(1)計(jì)算得出,葡萄糖流加階段的葡萄糖消耗量則由公式(2)計(jì)算得出:
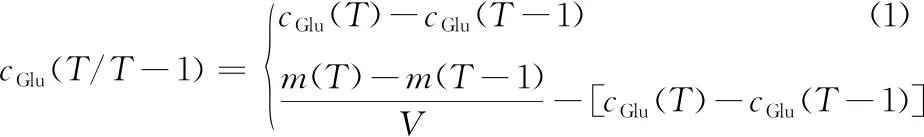
(2)
式中:T和T-1分別代表當(dāng)前及上一個(gè)取樣的時(shí)刻,h;cGlu(T/T-1)代表T和T-1時(shí)刻之間的葡萄糖消耗量,g/L;m(T)和m(T-1)分別代表T和T-1時(shí)刻的葡萄糖流加瓶的質(zhì)量,g;cGlu(T)和cGlu(T-1)分別代表T和T-1時(shí)刻的發(fā)酵液中葡萄糖質(zhì)量濃度,g/L;V代表發(fā)酵液體積,L。
對(duì)于葡萄糖脈沖流加階段,通過每隔2 h讀取葡萄糖流加瓶質(zhì)量的變化計(jì)算得出葡萄糖的流加量(g)。另一方面,通過采用適當(dāng)調(diào)節(jié)取樣次數(shù)(基準(zhǔn)為間隔4 h)和取樣體積的方法以實(shí)現(xiàn)維持發(fā)酵液體積(V)于恒定狀態(tài)的目的。此時(shí),由于發(fā)酵液體積的恒定,采用公式(2)對(duì)葡萄糖消耗量(g/L)進(jìn)行計(jì)算,過程得到了簡(jiǎn)化。
維持代謝的確定:對(duì)于無胞外產(chǎn)物生成的細(xì)胞反應(yīng),其維持代謝系數(shù)可由公式(3)[15-16]計(jì)算得出:
(3)
式中:qGlu、YX/S、μ和m分別表示葡萄糖比消耗速度(1/h)、裂殖壺菌細(xì)胞對(duì)葡萄糖的得率系數(shù)、細(xì)胞比生長(zhǎng)速度(1/h)和維持代謝系數(shù)(1/h)。
1.8 數(shù)據(jù)分析
所有實(shí)驗(yàn)重復(fù)3次,通過采用Excel和Origin 9軟件對(duì)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析和繪圖。
2 結(jié)果與分析
2.1 “葡萄糖充足-DO周期”組合控制策略抑制胞內(nèi)ROS積累、強(qiáng)化裂殖壺菌生物量及DHA的積累
利用裂殖壺菌生產(chǎn)DHA的發(fā)酵過程普通認(rèn)為維持碳源(葡萄糖)濃度于高水平可有效增強(qiáng)DHA的積累。因此,在5 L發(fā)酵罐中開展了初始葡萄糖質(zhì)量濃度為100 g/L的裂殖壺菌分批發(fā)酵培養(yǎng)。如圖1-a所示,在采用該發(fā)酵條件時(shí),在葡萄糖充足條件下,由于裂殖壺菌高密度發(fā)酵過程的高耗氧特性導(dǎo)致DO在培養(yǎng)16 h時(shí)迅速降至接近于零的水平。然而,作為典型的好氧產(chǎn)DHA微生物,裂殖壺菌細(xì)胞若長(zhǎng)期處于DO接近于零的水平會(huì)嚴(yán)重影響細(xì)胞生長(zhǎng)及DHA的生產(chǎn)。如圖1-c所示,當(dāng)細(xì)胞長(zhǎng)期處于DO受限條件下,在培養(yǎng)60 h時(shí)細(xì)胞濃度發(fā)生了明顯下降,最終細(xì)胞濃度和DHA產(chǎn)量?jī)H達(dá)到42.88 g/L和3.92 g/L 的較低水平。
a-DO;b-ROS濃度;c-細(xì)胞干重和DHA產(chǎn)量
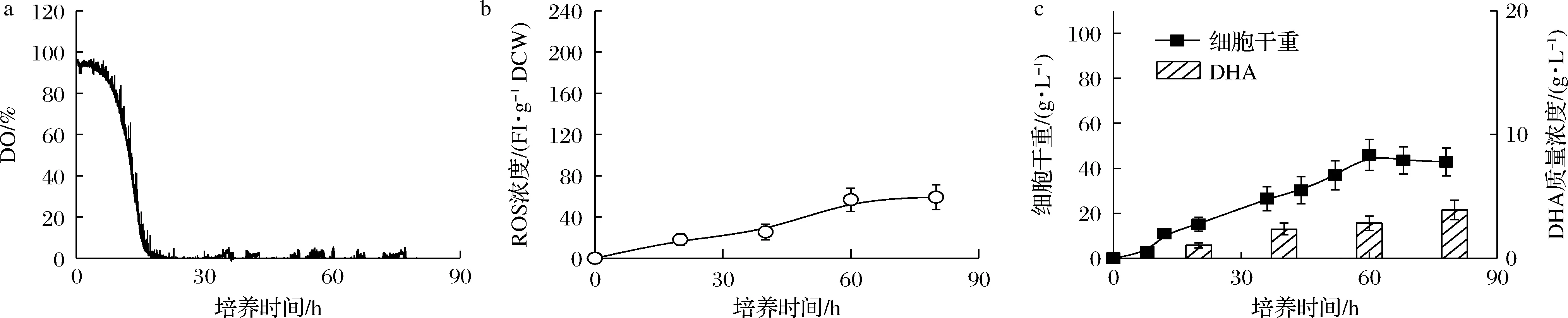
為此,本文采用了切換至純氧供氧的模式解決了傳統(tǒng)空氣供氧模式不能實(shí)現(xiàn)將DO控制于充足水平的難題。同時(shí),采用脈沖式流加葡萄糖的方式將發(fā)酵液中葡萄糖質(zhì)量濃度全程維持于40 g/L左右的高水平狀態(tài),最終將培養(yǎng)過程維持在“葡萄糖充足-DO充足”的水平。圖2顯示了“葡萄糖充足-DO充足”條件下的裂殖壺菌生產(chǎn)DHA的發(fā)酵性能。如圖2-c所示,在采用該控制策略下,細(xì)胞干重和DHA的積累均得到了一定程度地強(qiáng)化,分別達(dá)到了83.85 g/L和9.76 g/L的較高水平。
然而,微生物細(xì)胞若長(zhǎng)期處于高DO狀態(tài),胞內(nèi)ROS易發(fā)生大量積累[7]。此時(shí),胞內(nèi)積累的ROS又會(huì)與蛋白質(zhì)、核酸等發(fā)生非特異性反應(yīng),誘導(dǎo)細(xì)胞死亡,嚴(yán)重破壞目標(biāo)產(chǎn)物的生產(chǎn)性能[6, 15]。如圖2-b所示,當(dāng)裂殖壺菌細(xì)胞長(zhǎng)期處于DO充足狀態(tài)下,胞內(nèi)ROS的積累量達(dá)到了209.37 FI/g DCW的極高水平,進(jìn)而導(dǎo)致發(fā)酵后期裂殖壺菌生物量和DHA產(chǎn)量的積累速度減緩(圖2-c)。
a-DO;b-ROS濃度;c-細(xì)胞干重和DHA產(chǎn)量
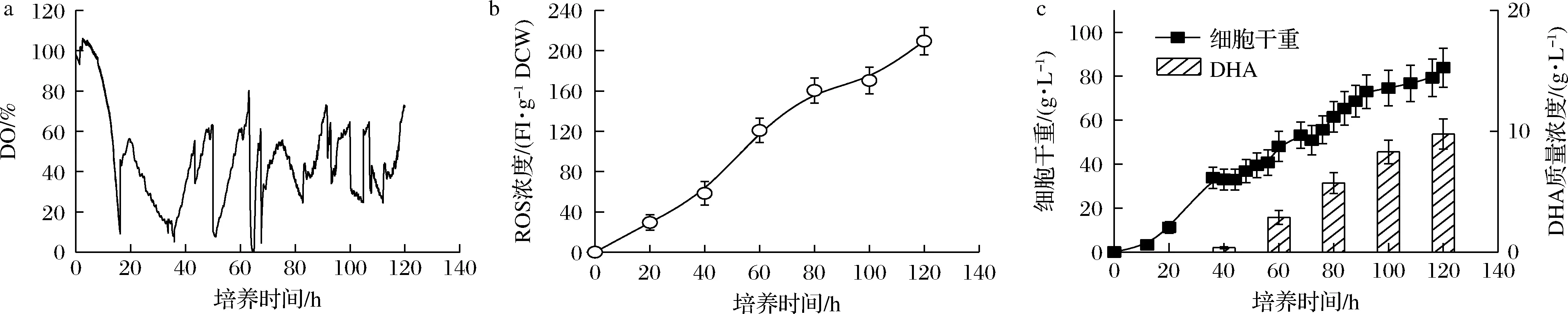
基于對(duì)采用“葡萄糖充足-DO受限”和“葡萄糖充足-DO充足”控制策略下,發(fā)酵性能的分析可知,DO充足狀態(tài)可一定程度強(qiáng)化裂殖壺菌生產(chǎn)DHA過程中細(xì)胞生長(zhǎng)及DHA積累,但存在胞內(nèi)ROS易發(fā)生嚴(yán)重積累的難題。另一方面,雖然DO受限狀態(tài)嚴(yán)重影響細(xì)胞的生長(zhǎng)及DHA的積累,但此時(shí)ROS積累可得到一定程度地緩解。基于此,本論文提出一種新型的“葡萄糖充足-DO周期”組合控制策略,即以通入純氧時(shí)為起始時(shí)刻,將培養(yǎng)階段等分為10個(gè)10 h階段,每個(gè)階段的前8 h通純氧維持DO于充足水平(≥10%),后2 h切換成空氣供氧維持DO于受限狀態(tài)(接近于零);同時(shí),葡萄糖質(zhì)量濃度在整個(gè)培養(yǎng)階段全程維持40 g/L左右的高濃度水平。圖3顯示了“葡萄糖充足-DO周期”組合控制策略下裂殖壺菌生產(chǎn)DHA的發(fā)酵性能。如圖3所示,采用該新型控制策略時(shí),在有效保證氧氣供應(yīng)水平的同時(shí),胞內(nèi)的ROS積累也得到一定程度地緩解(209.37 FI/g DCW vs 146.38 FI/g DCW)。最終,裂殖壺菌細(xì)胞濃度和DHA的產(chǎn)量分別達(dá)到了100.88 g/L和13.69 g/L的最高水平(圖3-c)。其中,DHA產(chǎn)量相比于對(duì)照兩批次的3.92 g/L(葡萄糖充足-DO受限)和9.76 g/L(葡萄糖充足-DO充足),分別提高了256.1%和40.3%。
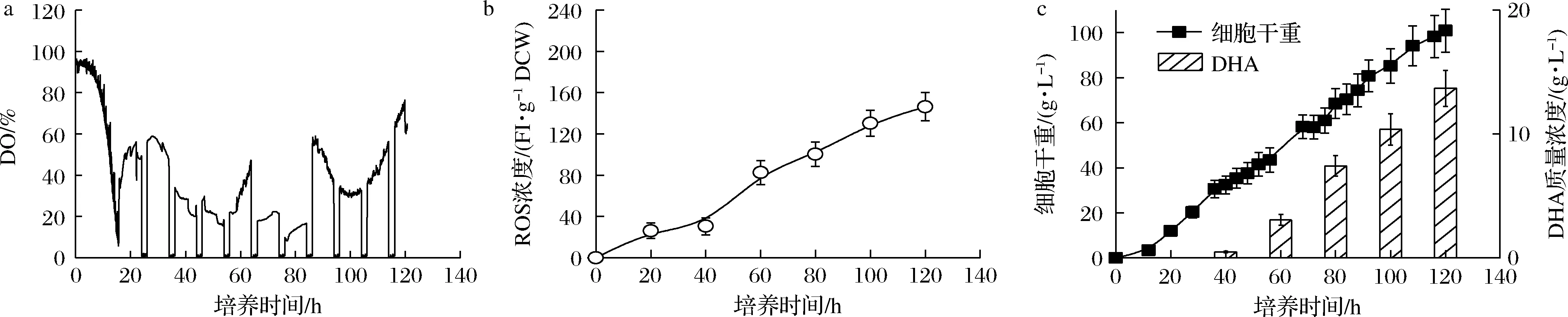
a-DO;b-ROS濃度;c-細(xì)胞干重和DHA產(chǎn)量
2.2 “葡萄糖充足-DO周期”組合控制策略降低細(xì)胞維持代謝系數(shù)
大量研究表明,胞內(nèi)ROS積累會(huì)與蛋白質(zhì)、核酸等大分子物質(zhì)非特異性反應(yīng),誘導(dǎo)其變性甚至造成細(xì)胞死亡[8, 17]。在此條件下,裂殖壺菌細(xì)胞不得不強(qiáng)化葡萄糖流向維持代謝途徑的碳流量,以實(shí)現(xiàn)消除胞內(nèi)ROS積累脅迫的影響。裂殖壺菌生產(chǎn)DHA過程在不同控制策略下的葡萄糖流向維持代謝途徑的碳流量可通過公式(3)進(jìn)行計(jì)算。圖4顯示了不同控制策略下,裂殖壺菌生產(chǎn)DHA過程中細(xì)胞比生長(zhǎng)速度、葡萄糖比消耗速度和維持代謝系數(shù)的變化情況。如圖4所示,當(dāng)采用“葡萄糖充足-DO周期”組合控制策略時(shí):(1)細(xì)胞比生長(zhǎng)速度和葡萄糖比消耗速度均得到明顯增強(qiáng)(圖4-a和4-b);(2)葡萄糖流向維持代謝部分的碳流由0.026 6 1/h降至0.021 2 1/h的較低水平(圖4-c)。最終,采用該最優(yōu)控制策略時(shí)裂殖壺菌細(xì)胞濃度和DHA的產(chǎn)量分別達(dá)到了100.88 g/L和13.69 g/L的最高水平(圖3-c)。

a-細(xì)胞比生長(zhǎng)速度;b-葡萄糖比消耗速度;c-維持代謝系數(shù)計(jì)算
2.3 “葡萄糖充足-DO周期”組合控制策略強(qiáng)化細(xì)胞代謝活性
一般而言,利用裂殖壺菌生產(chǎn)脂肪酸的合成過程主要包含以下兩類途徑:脂肪酸合成酶(fatty acid synthase, FAS)途徑和聚酮合成酶(polyketide synthase, PKS)途徑。然而,無論采用FAS亦或是PKS脂肪酸合成途徑,所需要的前體物質(zhì)均為乙酰輔酶A(acetyl-CoA)和輔因子NADPH[18]。因此,解析乙酰輔酶A和NADPH的合成途徑并對(duì)其合成過程中的關(guān)鍵酶活力進(jìn)行比較分析,是闡明采用“葡萄糖充足-DO周期”組合控制策略時(shí),可有效強(qiáng)化DHA生產(chǎn)的又一有效抓手。研究表明,ME途徑和磷酸戊糖途徑(pentose phosphate pathway,PPP)是裂殖壺菌生產(chǎn)脂肪酸過程細(xì)胞質(zhì)中輔因子NADPH的主要來源[18-20]。另一方面,雖然線粒體中的糖酵解(glycolysis)途徑、支鏈氨基酸分解代謝和脂肪酸β氧化途徑可產(chǎn)生大量供脂肪酸合成所需的前體物質(zhì)乙酰輔酶A,但是,通過FAS途徑和/或PKS途徑合成脂肪酸的過程主要發(fā)生于細(xì)胞質(zhì)中,同時(shí),線粒體內(nèi)膜不允許乙酰輔酶A的穿透,因此,糖酵解途徑、支鏈氨基酸分解代謝和脂肪酸β氧化途徑產(chǎn)生的乙酰輔酶A無法直接為細(xì)胞質(zhì)中脂肪酸的合成提供有效的前體物質(zhì)[18]。之后,CHEN等[21]研究闡明了可為脂肪酸合成直接提供前體乙酰輔酶A的代謝途徑為細(xì)胞質(zhì)中ACL所催化的檸檬酸轉(zhuǎn)化過程。同時(shí),圖5系統(tǒng)總結(jié)了裂殖壺菌中供給脂肪酸合成的前體物質(zhì)乙酰輔酶A和輔因子NADPH主要來源的代謝簡(jiǎn)圖[20]。

圖5 裂殖壺菌生產(chǎn)DHA過程中的葡萄糖代謝簡(jiǎn)圖
為此,本文系統(tǒng)比較了不同控制策略下裂殖壺菌生產(chǎn)DHA過程中關(guān)鍵酶——ACL、ME和G6PDH活性的變化情況。其中,ACL的功能是催化檸檬酸生成草酰乙酸和乙酰輔酶A,為脂肪酸的合成提供前體物質(zhì)乙酰輔酶A;ME可催化L-蘋果酸轉(zhuǎn)變?yōu)楸幔橹舅岬暮铣商峁┣绑w物質(zhì)NADPH;G6PDH催化葡萄糖-6-磷酸經(jīng)代謝產(chǎn)生NADPH和核糖-5-磷酸,可為脂肪酸的合成提供前體物質(zhì)NADPH。如圖6所示,在采用“葡萄糖充足-DO周期”組合控制策略時(shí),3種關(guān)鍵酶(ACL,ME和G6PDH)活性均得到了一定程度的增強(qiáng)。故此,在采用該最優(yōu)控制策略時(shí),可為脂肪酸(DHA)的合成提供充足的前體物質(zhì)NADPH和乙酰輔酶A。最終,在此優(yōu)化控制策略下,DHA的產(chǎn)量達(dá)到了13.69 g/L的最高水平,相較于對(duì)照兩批次的3.92 g/L(葡萄糖充足-DO受限)和9.76 g/L(葡萄糖充足-DO充足),分別提高了256.1%和40.3%。
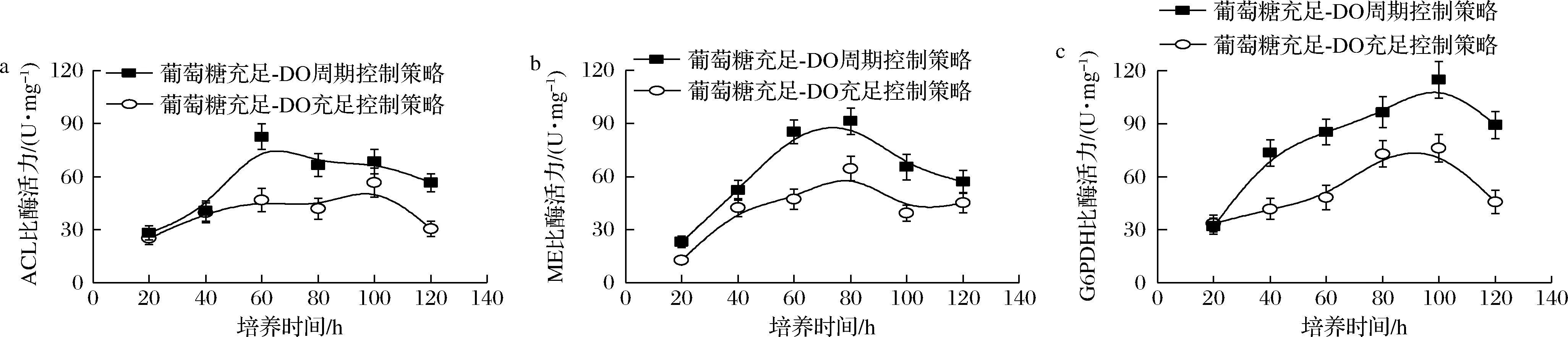
a-ACL比酶活力;b-ME比酶活力;c-G6PDH比酶活力
3 結(jié)論
針對(duì)傳統(tǒng)“葡萄糖充足-DO充足”控制策略下,裂殖壺菌生產(chǎn)DHA過程有毒物質(zhì)ROS易發(fā)生大量積累脅迫其發(fā)酵性能的難題,本文提出了一種新型的“葡萄糖充足-DO周期”組合控制策略,即將培養(yǎng)階段等分為10個(gè)10 h階段,每個(gè)階段的前8 h維持DO于充足水平,后 2 h 維持DO于受限狀態(tài),同時(shí),全程維持葡萄糖于充足狀態(tài)。結(jié)果表明,采用該新型組合控制策略時(shí),在有效保證氧氣供應(yīng)水平的同時(shí),胞內(nèi)的ROS積累也得到一定程度地緩解(209.37 FI/g DCW vs 146.38 FI/g DCW)。最終,裂殖壺菌細(xì)胞濃度和DHA的產(chǎn)量分別達(dá)到了100.88 g/L和13.69 g/L的最高水平。其中,DHA產(chǎn)量相比于對(duì)照兩批次的3.92 g/L(葡萄糖充足-DO受限)和9.76 g/L(葡萄糖充足-DO充足),分別提高了256.1%和40.3%。

