基于低分散激光剝蝕系統-電感耦合等離子體飛行時間質譜的快速元素成像
李冬月 鄭令娜 常盼盼 汪 冰 竺 云 王 萌* 豐偉悅
(1.天津師范大學 物理與材料科學學院,天津 300387;2.中國科學院高能物理研究所 中科院納米生物效應與安全性重點實驗室,北京 100049)
生物體內的微量元素雖然含量低,卻參與許多重要的生理過程,還與多種疾病的發生密切相關[1]。隨著科學研究的深入,不但需要得到生物樣品中元素總量和元素形態的信息,還要獲得樣品中元素的空間分布,這為分析化學提出了新的挑戰。
目前,生物體內元素原位成像的分析技術主要有激光電離質譜(Laser Desorption Mass Spectrometry,LDMS)[2],二次離子質譜(Secondary Ion Mass Spectroscopy,SIMS)[3]、激光誘導擊穿光譜(Laser Induced Breakdown Spectroscopy,LIBS)[4]、X射線熒光光譜(X-ray fluorescence,XRF)[5-6]和激光剝蝕-電感耦合等離子體質譜(Laser Ablation-Inductively Coupled Plasma Mass Spectrometry,LA-ICP-MS)[7]。其中,LA-ICP-MS具有樣品前處理簡單,分析靈敏度高、線性范圍廣,空間分辨率高等優點,成為痕量元素原位成像的常用方法[8]。
在LA-ICP-MS進行生物元素成像分析時,高能量激光微束轟擊剝蝕池中的生物切片表面,產生的氣溶膠由載氣吹掃進入ICP-MS,檢測得到剝蝕區域的元素信息,再將切片上每個剝蝕微區的結果重構,得到元素成像圖。由此可見,LA-ICP-MS是一種逐點成像的方法,成像速度主要受到氣溶膠產生和傳輸、質譜分析速度等因素的影響。近幾年出現了專用于元素成像的激光剝蝕系統,配有高頻率的激光器(如大于100 Hz),提高了樣品剝蝕速度[9]。采用低分散(Low Dispersion)快速洗脫剝蝕池,單脈沖激光產生的氣溶膠在剝蝕池中停留時間(即單脈沖響應,Single Pulse Response,SPR)縮短至10 ms以下[10]。同時,新一代電感耦合等離子體飛行時間質譜(ICP-TOFMS)可以在不到50 μs的時間內得到從6Li—238U的全質譜圖[11]。上述分析儀器的發展,極大地提高了LA-ICP-MS成像速度。Vanhaecke組采用低分散激光剝蝕-電感耦合等離子體質譜實現了每秒250像素的快速元素成像[12]。LA-ICP-MS與免疫技術結合后(即成像質譜流式技術)能夠以1 μm的分辨率在2 h內完成1 mm2大小樣品的元素成像[13]。隨著新一代LA-ICP-MS的發展,需要發展與之匹配的成像方法,以實現快速的生物元素成像。
銀納米顆粒(AgNP)是一種廣譜抗菌、抗病毒和抗炎材料,隨著AgNP在個人護理產品、保健品以及醫療用品等領域的廣泛應用,AgNP在生物體內代謝和清除受到了廣泛關注。腎臟是血液過濾和廢物清除的主要器官,在體內納米顆粒清除中起著關鍵作用。本文使用低分散激光剝蝕系統與電感耦合等離子體飛行時間質譜聯用,建立了新的基于點剝蝕的成像模式,實現了對尾靜脈注射AgNP小鼠腎臟切片的快速元素成像。
1 實驗部分
1.1 儀器與試劑
ArF準分子激光剝蝕系統(Iridia Bio,美國Teledyne公司),電感耦合等離子體飛行時間質譜(icpTOF 2R,瑞士TOFWERK AG公司),氣溶膠快速進樣系統(ARIS,美國Teledyne公司),冷凍切片機(LEICA 1900,德國Leica公司)。
高純Ar氣和He氣購自北京普萊克斯公司。銀納米顆粒(AgNP,50 nm,檸檬酸修飾)購自上海滬正納米科技有限公司。標準物質購NIST 612購自美國國家標準與技術研究院。Superfrost防脫玻片購自美國Thermo Fisher公司。
1.2 動物實驗
本實驗所用CD1(ICR)小鼠購自北京維通利華實驗動物技術有限公司,體重20 g。小鼠尾靜脈注射銀納米顆粒(劑量:6.25 mg/kg,注射體積:200 μL),24 h后心臟灌流,取腎組織,快速冷凍后用冷凍切片機制成10 μm厚度的切片,干燥后置于干燥器中備用。
1.3 LA-ICP-TOFMS成像分析
LA與ICP-TOFMS使用ARIS系統連接。激光剝蝕產生的氣溶膠由He氣帶出樣品池,進入ICP-TOFMS分析。使用NIST 612標準參考物優化激光剝蝕系統和ICP-TOFMS的參數,使115In+的信號最強,同時將氧化物水平(UO+/U+)保持在較低水平。優化剝蝕池He氣流速,以獲得最佳的單脈沖響應值(SPR)。優化激光剝蝕能量密度,達到樣品最優剝蝕效果并減少引入來自基底的干擾。優化后的LA-ICP-TOFMS參數見表1。LA采用點剝蝕模式,激光剝蝕時自動觸發ICP-TOFMS以標準模式采集質譜數據。所得數據用HDIP 1.6軟件(美國Teledyne公司)畫出元素成像圖。

表1 LA-ICP-TOFMS儀器參數Table 1 LA-ICP-TOFMS operating parameters
2 結果與討論
2.1 快速成像條件
LA-ICP-MS的元素成像可采用點剝蝕模式或線剝蝕模式(圖1)[14]。點剝蝕模式時,激光束在樣品表面逐點剝蝕采樣,等待剝蝕得到的氣溶膠完全從剝蝕池洗脫后,再進行下一點剝蝕。此時,采集的數據真實反映每個采樣點上的元素信息。激光光斑越小,采樣點越多,得到的元素成像圖的分辨率越高。但洗脫時間長的激光剝蝕系統若采用點剝蝕模式會導致成像時間過長。
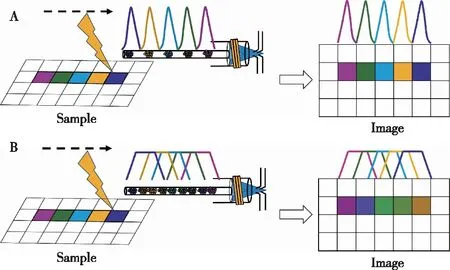
圖1 兩種剝蝕模式示意圖 A為點剝蝕模式,使用低分散快速剝蝕池;B為線剝蝕模式,使用常規剝蝕池Figure 1 Schematic diagram of two ablation modes.A:Spot ablation mode using a low dispersion ablation cell;B:Line ablation mode using a standard ablation cell.
線剝蝕模式時,激光束在樣品表面沿直線連續剝蝕樣品,不同樣品微區產生的氣溶膠會在剝蝕池內發生一定程度的混合。此時,成像的分辨率取決于光斑尺寸、激光頻率、線掃描速率和剝蝕線間距等條件。線剝蝕模式具有很好的分析靈敏度,但由于不同樣品微區產生的氣溶膠會混合,造成了成像結果的失真。文獻中已有的LA-ICP-MS成像分析,受到常規剝蝕池洗脫時間長(SPR:~1 s)的限制,多數采用線剝蝕模式以縮短成像時間[15]。
本文使用的低分散快速激光剝蝕系統,配備了快速洗脫剝蝕池和氣溶膠快速引入系統(ARIS),可以采用點剝蝕模式完成快速成像。優化剝蝕池載氣流速,可以得到最佳的SPR。當內池He流量為0.4 L/min,外池He流量為0.2 L/min時,得到最佳SPR(20 ms±1 ms),此時可以實現每秒40像素的成像速度。理論上越小的激光光斑能獲得更高的空間分辨率,但由于成像時間的限制,本文采用20 μm的方形光斑。在點剝蝕模式下,樣品臺移動速度設為800 μm/s(20 μm×40 Hz)。
LA-ICP-MS成像還要求質譜儀具有快速分析瞬時信號的能力,同時能消除譜學偏離(Spectral Skew)產生的結果偏差[16]。順序掃描的四級桿ICP-MS在測量時,每個核素測量需要毫秒量級的駐留時間(Dwell Time)和穩定時間(Settling Time)[17],限制了其分析瞬時信號中核素的個數。與四級桿ICP-MS不同,本文采用的ICP-TOFMS分析速度快,能夠在46 μs得到一張全質譜圖(即波形,Waveform),適合分析瞬時信號。為了獲得更好的信噪比,本文將516張質譜圖疊加,這樣每個像素點的采樣時間為23.74 ms,與SPR時間匹配以得到最優的成像結果。此外,在全譜測量時,由于存在高濃度的基體離子,會造成ICP-TOFMS檢測器的飽和。本文使用的ICP-TOFMS采用陷波技術(Notch Filter),選擇將質荷比為28、32、40、80等四個質量數的基體離子去除,消除了基體離子的影響。
2.2 LA-ICP-TOFMS小鼠腎臟的元素成像
本文使用LA-ICP-MS對暴露AgNP的小鼠腎切片中Ag和其他多種生物微量元素快速成像,采用點剝蝕模式,以20 μm的分辨率分析尺寸為14 mm×7 mm的腎臟切片,分析時間約為2 h。與常規的LA-ICP-MS系統相比,成像速度提高了約一個數量級。
圖2 展示了19種元素成像圖,其他元素由于含量低或基體離子干擾,沒有得到清晰的成像結果。如果采用碰撞池技術,可以消除多原子離子的干擾[18],提高52Cr、56Fe、80Se等核素的成像效果。由圖2可見,不同元素在腎切片中具有不同分布模式。P和S等主量元素,在腎臟切片基本呈均勻分布;Na在腎髓質中含量較高,這與Na+參與形成腎髓質高滲透壓的結論相一致[19];Mn與Na的分布相反,在腎髓質和腎皮質的交界處含量較高,而在腎椎體中含量較低,呈現出中空的圖像;由于腎皮質中血流量遠遠大于腎髓質,因此腎皮質的Fe含量(主要來自血細胞)較高。Ag并不是生命必需元素,在生物體內的背景很低,因此圖2中Ag的信號可以認為來自于注射的AgNP。可以看出,AgNP在腎皮質及腎皮質與腎髓質交界區域含量較高,特別是在腎皮質和腎髓質交界處的含量高于腎皮質區,而在腎椎體中含量很低。圖3是P、Mn和Ag三種元素合并圖,可以直觀地看出不同元素在腎切片中的不同分布。總之,元素成像可以得到微量元素及金屬納米顆粒在不同微區的原位分布,為微量元素的微區代謝、金屬納米材料吸收、分布和轉運等生物醫學研究提供了直觀可靠的分析手段。
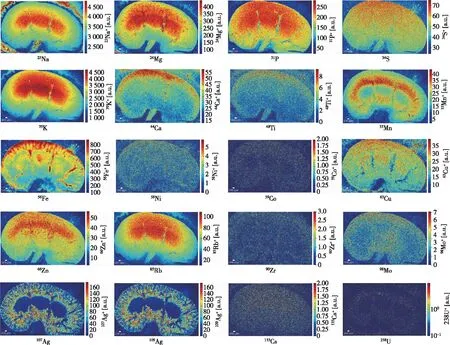
圖2 小鼠腎組織切片元素成像圖Figure 2 Elemental images of a tissue section from a mouse kidney.
生物元素的定量成像需要制備基體匹配的標準物質。文獻中已有使用定量摻雜金屬的明膠切片作為基質匹配的標準物質,實現了生物樣品的定量成像的報道[20]。如果將LA-ICP-TOFMS技術與免疫組織化學技術結合,使用金屬標簽標記的抗體,特異性識別組織樣品中待測分子(抗原),通過測量金屬標簽而得到生物切片中多種生物分子的原位分布,進一步擴展了LA-ICP-TOFMS技術的應用。Giesen等利用上述方法實現了對腫瘤組織的32 種生物分子的多重成像[21]。
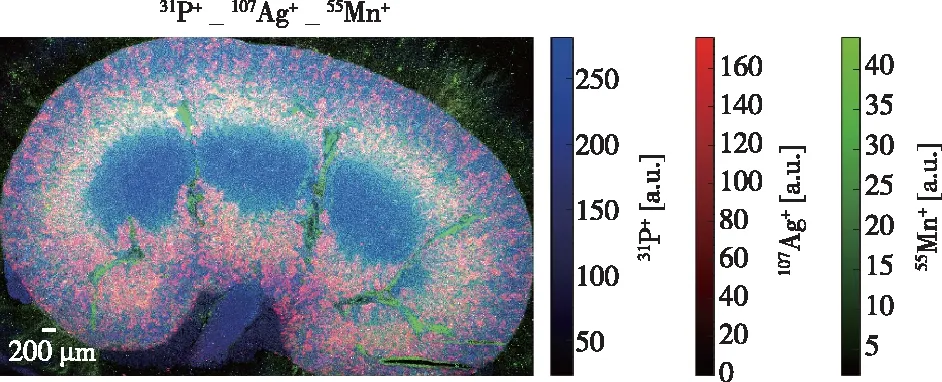
圖3 腎組織切片中P、Mn和Ag疊加元素成像圖Figure 3 The merged image of P Mn and Ag of of a tissue section from a mouse kidney.
3 結論
本文使用低分散激光剝蝕系統與電感耦合等離子體飛行時間質譜聯用,建立了新的基于點剝蝕的成像模式,實現了對小鼠腎臟切片的快速、高分辨的多元素成像。LA-ICP-TOFMS成像方法為原位研究生物體內元素提供了直觀可靠的手段,有望在生物醫學研究中得到更廣泛的應用。

